乳腺癌HER2的PET显像临床研究进展
2019-09-18黄钱焕徐宇平
黄钱焕,徐宇平,杨 敏
(1.江阴市人民医院,江苏 江阴 214400;2.江苏省原子医学研究所 卫生部核医学重点实验室 江苏省分子核医学重点实验室,江苏 无锡 214063 )
乳腺癌是女性最常见的癌症,据世界癌症中心最新统计结果显示,全球每年约有170万人被诊断为乳腺癌,以及约50万人死于此病,分别占癌症病例的25%和癌症死亡人数的15%。乳腺癌患者中约有18%~25%的过表达人表皮生长因子受体2(HER2)[1]。HER2属于酪氨酸激酶的表皮生长因子受体家族,它诱导信号通路促进多种细胞过程,包括增殖、分化、存活、血管生成和抗凋亡功能,预示着更具侵袭性的疾病和不良的临床结果[2-3]。
曲妥珠单抗是一种针对HER2胞外结构域的人源化单克隆抗体,可以延长HER2阳性患者的复发时间,提高总体生存率[4]。然而,转移性乳腺癌患者中有44%~64%对曲妥珠单抗作为单一药物治疗耐药,而只有12%~22%的患者在曲妥珠单抗耐药联合细胞毒性药物治疗中获益[5]。因此,治疗前及治疗期间需准确评估HER2状态。临床上应用穿刺活检或手术获取病理组织,通过免疫组织化学(IHC)和荧光原位杂交(FISH)确定HER2状态。然而,通过活检获取肿瘤组织有创伤,而且活检穿刺过程中有可能通过从原发病灶向远处器官播散癌细胞[6]。有报道原发肿瘤与转移灶之间HER2表达有相对较高的不一致率(6%~48%);HER2阴性原发肿瘤患者可能有HER2阳性转移灶[5-7],活检肿瘤的肿瘤内异质性,以及小样本量不一定代表整个肿瘤的或转移灶的HER2表达状态[8-9]。此外,Pectasides等[10]研究表明,经过几个月的曲妥珠单抗治疗后,37%的肿瘤不再表达HER2。上述情况表明,无创、准确、全面评估HER2状态有助于更合理地使用曲妥珠单抗。
在这种情况下,使用特定放射性药物靶向HER2的正电子发射断层扫描(PET)显示出巨大的优势。PET显像是一种无创性检查,靶向HER2探针与HER2蛋白具有特异性的结合能力,可以显示全身的HER2阳性病灶。相比活检方法具有优势,为患者提供了一种补充性和非侵入性选择,可以评估全身HER2状态,监测HER2靶向治疗的反应,早期鉴别耐药的患者,有助于指导医师为患者量身定制治疗方案。此外,由于基因扩增并不总是导致HER2蛋白的过度表达,一些体细胞突变基因扩增阴性的肿瘤细胞能表达HER2蛋白,此时使用靶向HER2 PET检查显示出对FISH检查的优势[11-12]。
将靶向HER2的分子应用于PET显像已引起了广泛的兴趣,最近开发了许多新的放射性药物应用于临床前及临床研究[13]。本文主要综述靶向乳腺癌HER2 PET显像应用于临床研究的最新进展,有助于医师快速了解分子影像在乳腺癌HER2诊疗研究中的临床结果,推进HER2 PET技术的临床转化。
1 靶向放射性药物
1.1 完整抗体
IgG分子对靶标抗原亲和力高,相对治疗而言有理想的药代动力学。然而,IgG分子的半衰期长,相对分子质量(150 kDa)大,导致肿瘤穿透率低而缓慢。而在显像之前需要足够的血液清除率以达到最佳的肿瘤与血液比例,限制了在分子影像中的应用[14]。
1.1.189Zr-DFO-Trastuzumab
血液中抗体的循环时间长,应根据其物理半衰期(t1/2)选择合适的放射性核素。锆-89(89Zr)通过正电子发射衰减,平均能量低(Eβ+平均值为396 keV),半衰期为3.27 d,可以匹配抗体的长生物半衰期,提供良好的PET空间分辨率[15-16]。
Dijkers等[17]在转移性乳腺癌患者中进行了首例人类89Zr-trastuzumab PET显像临床试验。临床研究招募了14例HER2阳性转移性乳腺癌患者,以确定最佳剂量和给药时间。结果表明,89Zr-trastuzumab显示出良好的肿瘤摄取和HER2阳性转移病灶的可视化。这些病变通常与计算机断层扫描(CT)和磁共振成像扫描的可用数据一致。曲妥珠单抗的单克隆抗体由于其尺寸大而不能穿过完整的血脑屏障,对脑转移的药物递送提出了挑战。Dijkers等[17]观察到脑转移灶的摄取可能是脑转移部位血脑屏障的破坏,评估89Zr-trastuzumab肿瘤摄取的最佳时间为给药后4~5 d,没有观察到与输注有关的反应或不良事件,估计总辐射剂量与2次腹部CT扫描(18 mSv)相当。
随后,Gaykema等[18]应用89Zr-trastuzumab为一个34岁患有右侧两种原发性乳腺癌(一个为HER2阳性,另一个为HER2阴性)女性患者解决了临床困难。患者的主要治疗包括右侧乳房切除术和腋窝淋巴结清扫术,以及术后行化疗联合曲妥珠单抗靶向治疗。术后两年复查CT显示纵隔大肿块和肝脏小占位。肝脏病变的活检显示没有肿瘤细胞。为了获得纵隔病变组织,需要进行纵隔镜检查。患者随后行89Zr-trastuzumab PET检查评估肿瘤的HER2状态。PET扫描显示在纵隔肿块、颈部淋巴结及骶椎中有摄取,未检测到肝脏占位病变。从89Zr-曲妥珠单抗PET扫描得出结论,纵隔转移灶是HER2阳性,避免了行纵隔镜手术。
为了研究89Zr-trastuzumab是否可以检测原发部位为HER2阴性乳腺癌患者的HER2阳性转移灶,Ulaner等[19-20]对两组患者行前瞻性临床试验。第一组纳入了9例患者,第二组纳入了11例患者,所有患者均进行病理检查,证实HER2阴性的原发性乳腺癌。20位患者中,有3位患者(15%)为病理学证实的HER2阳性远处转移,6位患者(30%)PET检查提示可疑后被病理证实HER2阴性,被认为是89Zr-trastuzumab假阳性的结果。研究结果表明,在HER2阴性原发性乳腺癌患者的一小部分患者中,HER2靶向显像可以检测患者体内未知的HER2阳性转移灶,但假阳性结果限制了89Zr-trastuzumab的临床转化,需要进一步完善该探针的设计。
1.1.264Cu-DOTA-trastuzumab
虽然89Zr-trastuzumab PET可以检测出HER2阳性病灶,但是因为半衰期长而使患者受到高辐射照射。相反,64Cu的半衰期为12.7 h,表明64Cu-DOTA-trastuzumab PET可能在高分辨率和低辐射下获得足够的肿瘤组织对比度[21]。
Tamura等[22]进行了第一项64Cu-DOTA-trastuzumab PET人类临床试验,以确定其安全性、分布、内部剂量测定和初始HER2阳性肿瘤图像。对6例原发性或转移性HER2阳性乳腺癌患者注射约130 MBq64Cu-DOTA-trastuzumab后,分别在1、24、48 h行PET检查。从这6名患者的血液,尿液和正常组织样品收集放射性数据,并评估探针的不同器官生物分布和内部剂量测定。在注射64Cu-DOTA-trastuzumab后以及1周随访期间收集所有患者的安全性数据,得出注射后48 h是评估肿瘤摄取64Cu-DOTA-trastuzumab的最佳时机。64Cu-DOTA-trastuzumab PET期间的辐射暴露与常规18F-FDG PET期间的辐射暴露相当。血液中的放射性活度很高,但在正常组织中摄取量低。2例患者的64Cu-DOTA-trastuzumab PET显示脑转移,提示血脑屏障破坏。3例患者的64Cu-DOTA-trastuzumab PET显像显示了最初由CT确定的病变部位的原发性乳腺肿瘤。研究结果表明,64Cu-DOTA-trastuzumab PET可用于鉴别原发和转移性乳腺癌患者HER2阳性病灶。在足够的PET成像所需的剂量下,剂量测定和药理学安全性结果可接受。
此外,Sasada等[23]在64Cu-DOTA-trastuzumab可以无创监测乳腺癌患者的HER2阳性原发灶及转移灶的基础上,进一步研究了该探针检测瘤内异质性的可行性。试验为一例53岁的右侧乳腺癌女性患者,穿刺活检标本病理示HER2 IHC 1+,行64Cu-DOTA-trastuzumab PET显示肿瘤周边有强烈的摄取。在强摄取的肿瘤表浅部位再次行活检后病理示HER2 IHC 2+。为使用HER2 PET显像描述HER2特异性瘤内异质性(IHC1+和2+)可视化的第一份报告。
另一项是关于64Cu-DOTA-trastuzumab的摄取值与HER2表达量的相关性研究[24],共38例患者,其中HER2阳性患者17例,HER2阴性患者18例,HER2可疑患者3例。HER2阳性和HER2阴性乳腺肿瘤的平均SUVmax分别为(2.6±0.9)和(1.4±0.9)(P<0.001)。SUVmax值与HER2-IHC评分相关(r=0.619)。当HER2-PET显像的SUVmax截断值设定为1.98(曲线下面积为0.853,95%置信区间为0.715~0.991)时,HER2-PET显像鉴定出18个HER2阳性肿瘤中的15个和17个HER2阴性肿瘤中的15个(P<0.001);敏感性、特异性和准确性分别为83.3%、88.2%和85.7%。结果表明64Cu-DOTA-trastuzumab的摄取值与HER2表达量呈正相关。
1.2 抗体片段
全尺寸抗体作为分子显像示踪剂的普遍问题,其血液中的滞留时间长导致高背景活性,灵敏度低,显像对比度降低。为了克服完整抗体的缺点,已开发出来自曲妥珠单抗的抗体片段,如F(ab′)2,并用半衰期较短的同位素进行标记。IgG相比F(ab′)2的半衰期延长5倍[25]。较低相对分子质量的抗体片段为与较短的半衰期放射性核素结合后可以在较早的时间点和较短的扫描间隔期间进行扫描,已经开发了用于HER2显像的放射性标记的片段抗原结合Fab区域。
Beylergil等[26]为了评估68Ga-DOTA-F(ab′)2-trastuzumab的毒性、药代动力学、生物分布和剂量学特征,招募了16例乳腺癌女性患者,未接受68Ga-DOTA-F(ab′)2-trastuzumab的患者被排除在分析之外。研究包含HER2阴性(n=7)和HER2阳性(n=8)两种情况。后者中有7例接受过曲妥珠单抗治疗,另一例未治疗。结果显示68Ga-DOTA-F(ab′)2-trastuzumab耐受性良好,T1/2为(3.6±0.9) h;在8例HER2阳性患者中有4例观察到肿瘤靶向。结果表明该探针安全,但仍需注射更大量、更好的免疫反应性抗体以及额外患者群体进行进一步评估。
1.3 亲和体
用68Ga标记的曲妥珠单抗F(ab′)2片段是安全的,在注射当天可以显像,但病变检出率不理想。亲和体(affibody)是设计为免疫球蛋白结合蛋白的替代物,也称为“人工抗体”。Affibody分子为58个氨基酸(6.5 kDa)组成的三螺旋结构,为来自葡萄球菌蛋白A衍生的Z结构域[27-28]。尽管Affibody分子体积很小,但结合区域与抗体-抗原相互作用区域相似[29-30],亲和力达到皮摩尔(KD=22 pmol/L),并已开发用于HER2显像[31]。它可以被有效地和特定位点放射性标记用于显像而不影响其体内HER2肿瘤结合,并且曲妥珠单抗的存在不会影响其与HER2结合[32]。
ABY-025是第二代亲和体分子,能降低非特异性肝摄取,结合位点在HER2细胞外的结构域Ⅲ。由于曲妥珠单抗和帕妥珠单抗分别与结构域Ⅳ和Ⅱ结合,因此ABY-025会促进非竞争性相互作用,能为在曲妥珠单抗和/或帕妥珠单抗治疗浓度下使用此显像剂提供优势[33]。Sörensen等[34]首次进行了68Ga-ABY-025临床试验,研究低剂量肽(78±8) μg与高剂量肽(427±19) μg对显像的影响、显像摄取值的可重复性和肿瘤摄取值与病理学的相关性。该临床试验招募了16例已知转移灶和正在进行治疗的乳腺癌女性患者。静脉注射(212±46) MBq68Ga-ABY-025后,在1、2、4 h行PET显像。前10例患者中(6例HER2阳性,4例HER2阴性原发性肿瘤)间隔1 周进行两次不同肽剂量的68Ga-ABY-025 PET/CT。后6例患者中(5例HER2阳性,1例HER2阴性原发性肿瘤)间隔1 周重复进行68Ga-ABY-025 PET扫描,检测个体病变摄取值的可重复性。结果显示,高剂量肽4 h显像最能区分HER2阳性转移灶(P<0.01)。 PET SUV值与病理HER2评分呈正相关(r=0.91,P<0.001)。 HER2阳性的摄取值比HER2阴性病变的摄取值高5倍(P=0.005)。重复显像的内部相关性r=0.996。68Ga-ABY-025 PET能够正确识别HER2阳性原发灶及转移灶,并改变了3例患者的靶向治疗。
此外,Sörensen等[35]招募了8例乳腺癌转移患者,为了测量68Ga-ABY-025体内的生物分布,并测定2组不同剂量肽的辐射剂量。在注射68Ga-ABY-025 后的1、2、4 h放射性核素摄取高的为肾脏和肝脏。低剂量肽(LD)的总有效剂量为(0.030±0.003) mSv/MBq,高剂量肽(HD)为(0.028±0.002) mSv/MBq。结果表明,注射200 MBq68Ga-ABY-025后,LD的辐射吸收剂量为6.0 mSv,HD为5.6 mSv。因此,从辐射剂量考虑,行乳腺癌HER2 PET/CT扫描优选高剂量肽。
1.4 纳米抗体
纳米抗体被认为是最小的天然来源抗原结合片段(12~15 kDa),其由骆驼科免疫球蛋白G的重链部分的可变结构域组成[36]。小尺寸、高稳定性、纳摩尔亲和力和低免疫原性使他们有可能成为优异的分子成像探针[37-38]。
Keyaerts等[39]报道了68Ga-HER2-Nanobody的安全性、生物分布、剂量学和乳腺癌患者中肿瘤靶向潜力。20例女性原发性或转移性乳腺癌患者(HER2 IHC 2+或3+)分为3组,每组接受的68Ga-HER2-Nanobody的量分别为0.01、0.1、1 mg(放射性活度范围为 53~174 MBq)。估计生物半衰期为1 h,肾脏系统是消除放射性药物的主要途径。接受最高辐射剂量的器官为膀胱壁(0.406 mGy/MBq),每例患者平均4.6 mSv。结果表明,使用68Ga-HER2-Nanobody安全且没有副作用。在转移性疾病患者中,大多数确定疾病部位中示踪剂积聚远高于背景。示踪剂积累中原发病灶更易变。68Ga-HER2-Nanobody PET/CT可能不适用于评估原发性乳腺癌病变中的HER2表达。
2 优缺点比较
对靶向乳腺癌HER2 PET分子探针的介绍可以看出,完整抗体、抗体片段、亲和体、纳米抗体的优点和局限性列于表1。可根据临床的不同需求选择不同的HER2探针。例如,监测抗体靶向治疗(例如曲妥珠单抗、帕妥珠单抗)时,基于抗体的探针可能是优选的。用于诊断或预测对小分子治疗的应答(例如拉帕替尼,放射性标记的纳米抗体)时优选相对分子质量小的探针。
3 总结与展望
乳腺癌HER2的表达增加与不良预后相关。对乳腺癌患者HER2状态的准确及全面评估是决定治疗策略的重要前提。以PET为代表的分子影像具有很大的优势,可以成为“精准医学”时代的宝贵工具。本文概述了目前HER2 PET显像剂用于临床研究的最新状况,其范围从单克隆抗体到小分子。核素标记的曲妥珠单抗探针的全抗体方法难以通过PET扫描产生敏感的图像。这是因为与较低相对分子质量的分子相比,高相对分子质量的抗体导致相对较慢的全身清除率和相对较低的肿瘤血液比率,低效的外渗和肿瘤穿透性。但小分子如Affibody和纳米抗体已经表现出良好的体内特性。通过进一步的前瞻性临床研究和验证,靶向乳腺癌HER2的PET显像更有助于为患者定制个性化的治疗,早期监测治疗反应,提早停止无效并且昂贵的治疗,及时调整治疗方案,为患者节省费用,改善患者预后。
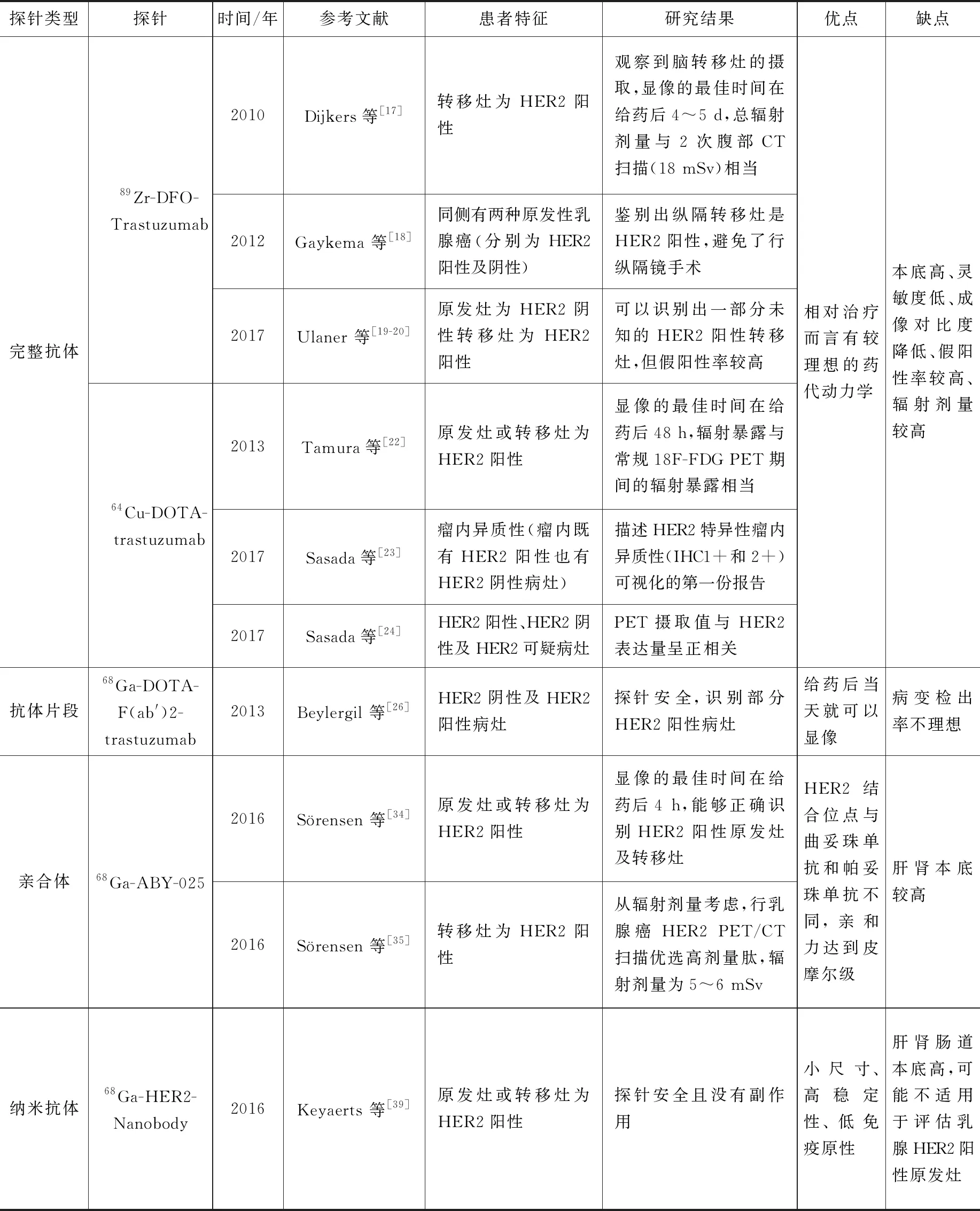
表1 乳腺癌HER2探针PET显像的临床研究Table 1 Clinical PET image for HER2-positive breast cancer
