一种死宰猪肉鉴别诊断方法的建立
2019-09-18马贵达张若曦顾文源刘天驹张建虹董维亚石玉祥韩庆安
马贵达,张若曦,顾文源,李 翀,刘天驹,张建虹,董维亚,石玉祥,袁 芳,刘 博,韩庆安,王 斌
(1.河北工程大学生命科学与食品工程学院,河北 邯郸056001;2.河北省动物疫病预防控制中心,河北 石家庄050011;3.河北省动物卫生监督所,河北 石家庄050051;4.衡水市动物疫病预防控制中心,河北 衡水053000)
死宰猪肉是指法律法规规定的,患有对人体有害的传染性疾病、寄生虫病和中毒性疾病的生猪,非经屠宰死亡的生猪以及经检疫检验不合格、不能食用的猪肉及其肉类产品[1]。目前,死宰猪肉进入市场的情况时有发生,严重危害了人民群众的身体健康[2]。我国现行的市场肉品检验中主要以感官检查和实验室检测为鉴别手段[3]。感官检查方法包括视检、嗅检和触检[4]。实验室检测主要有pH值测定法、过氧化物酶反应法、硫酸铜蛋白沉淀法、细菌内毒素氧化呈色法等定性的检测方法[5-8]。这些方法往往存在较大的经验性和主观性,无法提供准确的图谱和定量化数据,缺乏充分科学的依据和数据[10]。因此,需要建立一种有数据支撑、检测结果准确的死宰猪肉鉴别诊断方法。
过氧化物酶(Peroxidase,POD)是评价猪肉健康与否的重要指标[5,7]。在新鲜健康的畜禽肉中含有POD,但慢性死亡的畜禽以及当畜禽处于病理状态或濒死状态时肉中的POD 显著减少,甚至完全消失[11]。此外,在临床屠宰中,死宰畜禽常出现放血不及时,使血液坠积于胴体的血管,皮下以及肌肉组织中,导致血红蛋白(Hemoglobin,Hb)残留现象[7]。因此,本试验以猪肉中的POD 和Hb 为研究靶标,建立一种新型的死宰肉和屠宰肉鉴别诊断方法,为肉品检验提供科学的理论依据和数据支持。
1 材料与方法
1.1 样品采集 分别于5 头屠宰猪胴体的6 个不同部位(A.通脊肉;B.五花肉;C.前臀尖;D.前腿肉;E.后臀尖;F.后腿肉)采集待检肉样30 份;屠宰猪肉样品来自河北省某屠宰加工企业;分别于6 头死宰猪胴体的六个不同部位采集待检肉样36 份,死宰猪肉样品来自石家庄某动物无害化处理厂。每份肉样采集约50 g,置于-20 ℃冷冻保存备用。
1.2 主要试剂与设备 PBS 缓冲液(0.01 mol/L,pH 值7.2~7.4),购自北京索莱宝科技有限公司;磷酸二氢钠、硫酸,均购自国药集团化学试剂有限公司;过氧化脲,购自上海安耐吉化学有限公司;3,3′,5,5′-四甲基联苯胺溶液(TMB),购自北京博奥拓达科技有限公司;辣根过氧化物酶,购自Sigma 中国有限公司;猪血红蛋白ELISA 检测试剂盒,购自无锡市东林科技发展有限责任公司(Develop 公司)。
高速组织捣碎机(金坛市精达仪器制造有限公司,型号JJ-2);紫外分光光度计(上海菁华科技仪器有限公司,型号755B);酶标仪(安图实验仪器郑州有限公司,型号PHOMO);隔水恒温箱(上海智城分析仪器制造有限公司,型号ZXGP-A2270)。
1.3 肉浸液的制备 手剪法:将待检测肉样去除筋腱和脂肪,取5~10 g 肉样均匀剪碎后加入10 倍肉样量的PBS 至小烧杯中,用玻璃棒搅拌均匀,浸泡一定时间后,分别取4 mL 肉浸液以3 000 r/min 离心5 min 后取上清液2 mL 以备检测。
机搅法:将待检测肉样去除筋腱和脂肪,取5~10 g 肉样和10 倍肉样量的PBS 至高速组织捣碎机以最大转速16 000 r/min 机搅30 s 至机搅完全,随后转移至小烧杯中,用玻璃棒搅拌均匀,浸泡一定时间后,分别取4 mL 肉浸液以3 000 r/min 离心5 min 后取上清液2 mL 以备检测。
1.4 过氧化物酶检测 比色皿内按顺序加入磷酸二氢钠缓冲液(15.6 g/L,pH 值4.5)2 mL、过氧化脲溶液(9.4 g/L)0.2 mL、样品肉浸液0.2 mL、3,3′,5,5′-四 甲 基 联 苯 胺 溶 液(TMB)(0.65 g/L)0.2 mL,室温下反应1 min,加入0.1 mL 硫酸溶液(2 mol/L)终止反应,在紫外分光光度计上测样品OD450nm值。
将辣根过氧化物酶溶液(10 mg/L)作为标准品稀释1 000 倍,再进行倍比稀释,利用标准品的浓度和检测OD450nm值绘制标准曲线,并换算被检样品的浓度。
1.5 血红蛋白ELISA 检测 参照无锡市东林科技发展有限公司猪血红蛋白ELISA 检测试剂盒说明书,对经过前处理后的屠宰猪和死宰猪肉浸液进行血红蛋白ELISA 检测,利用标准品的浓度和检测OD450nm值绘制标准曲线,并换算被检样品的浓度。
2 结果
2.1 POD 检测结果 在先前报道的POD 检测方法中,肉样的研磨处理方式和肉浸液的浸泡时间各有不同[5,8-10,12]。为确定前处理方式,对手剪和机搅两种方法进行对比,结果显示(见中插彩版图1),手剪法处理的肉样POD 检测OD450nm值在0.2~0.8之间,机搅法处理的肉样检测结果在0.2~1.2 之间;经机搅法处理后的肉浸液,屠宰猪POD 检测OD450nm值较死宰猪更高,其中死宰猪和屠宰猪前臀尖(C)经机搅法处理后,POD 的检测结果明显区分,而死宰猪和屠宰猪通脊肉(A)、后臀尖(E)和后腿肉(F)经机搅法处理后,POD 的检测结果差异更加显著,表明与手剪法对比,机搅法肉样的研磨程度更加均一,死宰猪肉和屠宰猪肉POD 的检测结果差异更加明显。表明机搅法更适用于POD检测。
以机搅法为肉样前处理方式,设立5 个不同的浸泡时间点(10 min、30 min、60 min、90 min 和120 min)进行比较,结果显示(见中插彩版图2),死宰猪与屠宰猪通脊肉(A)、五花肉(B)、后臀尖(E)、后腿肉(F)的POD 浓度无法区分;屠宰猪前臀尖(C)、前腿肉(D)的POD 浓度显著较高。
2.2 血红蛋白ELISA 检测结果 栗邵文等研究中指出临床检测中为了避免死宰猪肉漏检现象,POD检测必须辅以感官检测、微生物检验和其他理化检验方法进行综合判断[12]。在临床屠宰中,死宰畜禽常出现放血不完全现象,导致胴体内Hb 残留较多[7],所以肌肉中的Hb 含量可作为鉴别死宰肉的潜在检测靶标[16]。经前处理后的肉样,在不同时间(10 min、30 min、60 min、90 min 和120 min)浸泡后进行血红蛋白ELISA 检测及结果分析比对,结果显示,死宰猪肉Hb 浓度分布区间显著高于屠宰猪肉,但是,死宰猪后腿肉(F)与屠宰猪前臀尖(C)、前腿肉(D)的Hb 浓度分布区间重合,难以区分。结果表明,血红蛋白ELISA 检测可部分鉴别死宰肉和屠宰肉,但是不能完全鉴别(见中插彩版图3)。
2.3 以POD 和Hb 双靶标检测方法的建立 由于血红蛋白的空间结构与辣根过氧化物酶(HRP)相似,且具备有生物酶的特性进而被作为一种过氧化物酶广泛适用[14]。因此推测将两个不同靶标转化为定量检测肉品中具有过氧化物酶活性物质的血红蛋白含量,分析血红蛋白残留的相对比例,可能能够区分死宰肉与屠宰肉[15]。
为验证我们的推测,将检测肉浸液中Hb 浓度与POD 浓度之比定义为R 值,并进行比对,结果显示,机搅后不同浸泡时间的死宰猪和屠宰猪肉浸液的R 值分布区间有明显区分,即死宰猪肉R 值明显高于屠宰猪,且不同部位均可明显区分(见中插彩版图4)。
R 值在300~400 可作为区分死宰猪与屠宰猪的有效隔离区间,此区间设立为区分阈值,建立鉴别诊断方法。 即设定R ≤300 为屠宰猪肉,R≥400 为死宰猪肉,300 表1 不同浸泡时间下死宰猪肉和屠宰猪肉R 值的符合率 针对前人研究中检测时存在肉样处理方法和检测条件不一致的问题,检测结果难以标准化衡量的现象[5,8-9,12]。本试验中对肉样的处理方式以及浸泡时间进行了综合对比,发现机搅法肉样的研磨程度更具均一性,可有效减小操作误差,保证结果的客观准确性。 POD 是鉴别肉品健康与否的重要指标[5,7]。本实验中发现以单一的POD 浓度为检测指标时,不能有效区分死宰猪和屠宰猪肉。推测是由于急性死亡的畜禽体内POD 消耗较少,在利用POD 检测鉴别死宰肉时会存在漏检的可能性[12];或者由于死宰猪肉中血液坠积的原因,使死宰猪肉中POD 的浓度受Hb 残留的干扰而升高,导致检测结果存在偏差[14-15]。因此,在临床上为了避免漏检,需要结合其他方法进行辅助检测[12]。本试验发现,以单一的Hb 浓度为检测指标时,死宰猪肉和屠宰猪肉中Hb浓度分布区间可以在一定程度区分,然而误差范围较大,这也可能是因为采样部位和屠宰前运动程度不同而造成的[16]。 在上述试验的基础上,为了确定一种可以排除血红蛋白干扰的死宰肉鉴别诊断方法,本研究尝试双靶标检测发现,将肉浸液中Hb 浓度与POD 浓度之比设立R 值,利用R 值的阈值可以有效避免肌肉中Hb 对POD 检测时干扰而影响对死宰猪肉的鉴别[14-15]。相较于单一的检测靶标,死宰猪和屠宰猪R 值在各浸泡时间下均有明显区分。此外,在各浸泡时间条件下,POD 浓度和Hb 浓度以及R 值的差异并不显著。因此,R 值检测法的设立,可以作为一种有数据支撑、检测结果准确的新型鉴别死宰猪肉方法,为肉品检验提供科学的理论依据和数据支持。 本试验发现,机搅法处理肉样且肉浸液浸泡10 min 可作为样品的最佳前处理方式;通过对猪肉中的Hb 残留浓度和POD 浓度双靶标浓度之比R值的研究,建立了一种有数据支撑、检测结果准确的新型死宰猪肉鉴别诊断方法,且鉴别准确率可达95.5%。 图1 不同处理方式POD 检测结果对比 图2 不同浸泡时间POD 浓度对比 图3 血红蛋白ELISA 检测结果对比 图4 不同浸泡时间R 值的对比分析 本方法的建立,不仅为食品安全监督部门和肉品检验工作者解决了死宰猪肉鉴别手段缺乏的问题,还为肉品检测试纸条和试剂盒的研发提供了理论基础;此外,本方法也可结合荧光生物传感器、免疫纳米磁分离技术和微流控芯片技术等,研制病死猪肉快速检测设备。总之,本方法的建立可以有效避免死宰肉的漏检现象,从而保证动物性食品安全和消费者的身体健康。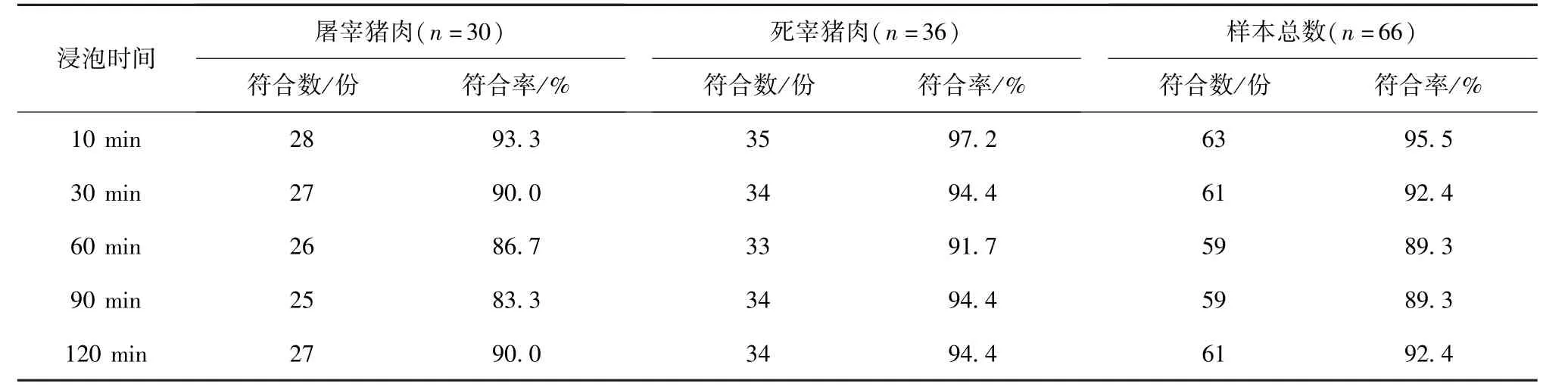
3 讨论




