荷斯坦奶牛瓜氨酸血症PCR-DHPLC 检测方法建立与应用
2019-09-18辛学谦郑小龙张晓文梁成珠岳志芹
辛学谦,郑小龙,张晓文,王 群,姜 帆,孙 涛,梁成珠,岳志芹
(青岛海关技术中心,山东 青岛266002)
瓜氨酸血症(Citrullinemia,CN)是奶牛的一种常染色体隐形遗传性疾病。该病1989 年Dennis 等发现,CN 是由于精氨酸琥珀酸合成酶(Arginino succinate synthetase,ASS)的基因第5 外显子中,编码ASS 第86 位氨基酸的密码子由精氨酸突变为终止密码子(CGA→TGA),造成了编码的精氨酸琥珀酸合成酶失去活性,从而致使尿素循环发生代谢障碍。该病牛出生时表现正常,在出生1 周后就会由于血氨浓度过高而造成死亡,死亡率高达100%[1-3]。
由于该病隐性缺陷基因携带者不表现任何临床症状,隐形缺陷基因可遗传给子代个体,只有当子代出现隐形纯合子时才会被发现并淘汰,这将会给奶牛业的发展造成巨大的损失,同时也不利于奶牛育种的发展。
目前,国际上许多国家已经开始进行奶牛中CN携带者的筛查工作,主要的检测方法为PCRRFLP、PCR-SSCP 和基因测序[4-6],这些方法不适合大规模的批量检测,本试验利用PCR-DHPLC 技术,拟建立一种快速的高通量的检测CN 的方法。
1 材料与方法
1.1 质粒 未突变纯合子(A/A)基因材料:为构建的含有部分SLC35A3 基因质粒pMD-ASS;CN纯合子(a/a)基因材料:为人工致突后质粒pMDCN;CN 携带者(A/a)基因材料:pMD-ASS 与pMDCN 两者的等比例混合物。所有质粒由本实验室保存。
1.2 主要试剂和仪器 三乙胺乙酸盐(TEAA,色谱纯),购自Transgenomic 公司;乙腈(CAN,色谱纯),购自TEDIA 公司;质粒DNA 小量提取试剂盒、PrimeSTAR HS DNA 聚合酶、DNA Marker DL-2 000,购自TaKaRa 公司;其他常规化学试剂,购自北京化学试剂公司;变性高效液相色谱仪器(Transgenomic Wave 4 500),为北京环球基因公司产品。
1.3 PCR 扩增 用Primer Premier 5.0 软件,根据GenBank 中M26198 序列设计一对引物,该引物对扩增范围包含第5 外显子第86 位氨基酸:CN P1:5′-TATGACGTCATTGCCTACCTG-3′CN P2:5′-CGCATACTCCATCAGATCGTT-3′由宝生物工程(大连)有限公司合成,扩增序列长度为408 bp。分别以A/A、a/a 和A/a 基因材料为模板进行PCR 扩增。反应体系为:5×PrimeSTAR Buffer 10 μL,dNTPs 5 μL,引物各2 μL,各种基因型的模板各0.1 μL,PrimeSTAR HS DNA 聚合酶1 μL,补水至50 μL。反应程序为:94 ℃,5 min;94 ℃,30 s,55 ℃,30 s,72 ℃,30 min,35 个循环;72 ℃,10 min。扩增产物经1%琼脂糖凝胶电泳检测后,存于4 ℃备用。
1.4 变性高效液相色谱检测方法的建立
1.4.1 变性条件 将a/a 和A/a 基因型的PCR 产物与A/A 基因型PCR 产物按l∶l 比例混合(各取7.5 μL 混匀),将混合后的PCR 产物按以下变性条件在PCR 仪上进行变性:95 ℃变性5min,94.9 ℃变性6 s,然后通过700 个循环缓慢降温,每个循环减少0.1 ℃,至25 ℃。变性后样本准备在DHPLC 上上样,检测。
1.4.2 DEIPLC 分析条件 利用WAVE 4500 的分析软件预测ASS 扩增基因的部分变性温度,温度条件通分析软件对输入的序列进行解链温度预测得出不同温度的解链预测图,在预测的温度范围内选择最佳温度,以达到最理想的检测效果。
运行软件Navigator software 自动计算出最佳A液(0.1 mol/L TEAA 水溶液)和B 液(0.1 mol/L TEAA 和25%ACN)配比和洗脱梯度后,以0.9 mL/min 的流速将样本在DNA 分离柱中洗脱。
1.5 方法的应用 对山东地区进境的荷斯坦奶牛55 份全血样品提取基因组,按照建立的方法先进行PCR 扩增,PCR 产物进行琼脂糖凝胶电泳检测。将所有PCR 扩增产物与A/A 基因型的PCR 产物进行等体积混合,变性处理后,按照摸索的DHPLC 的分析条件上机检测。
2 结果
2.1 PCR 扩增结果 经过摸索,PCR 扩增条件及体系如1.2 中所描述,产物进行琼脂糖凝胶电泳检测,特异性良好。见图1。
2.2 DHPLC 分析条件 根据序列的信息Navigator software 软件对PCR 扩增产物不同位点在59.2 ℃~63.2 ℃范围内的解链趋势进行了预测,根据预测推荐使用温度为63.2 ℃(见中插彩版图2)。软件计算得到最佳分析条件如下:0.0 min,47.8%缓冲溶液A,52.2%缓冲溶液B;0.5 min,42.8%缓冲溶液A,57.2%缓冲溶液B;5 min,33.8%缓冲溶液A,66.2%缓冲溶液B;5.1 min,0%缓冲溶液A,0%缓冲溶液B,100%缓冲溶液D;5.6 min,0%缓冲溶液A,0%缓冲溶液B,100%缓冲溶液D;5.7 min,47.8%缓冲溶液A,52.2%缓冲溶液B;6.6 min,47.8%缓冲溶液A,52.2%缓冲溶液B;流速:0.9 mL/min。

图1 ASS 部分基因PCR 扩增结果
根据以上分析条件,对3 种基因型进行Mutation detection 检测,得到如下图谱结果(见中插彩版图3)。
2.3 方法的应用 55 份样品均得到单一的大小正确的电泳条带,利用建立的DHPLC 方法进行检测,发现了1 份A/a 基因型的样品,将样品PCR 产物送去测序结果与检测结果一致(见中插彩版图4)。

图2 不同预测温度DNA 双螺旋的百分比

图3 不同基因型样本色谱图
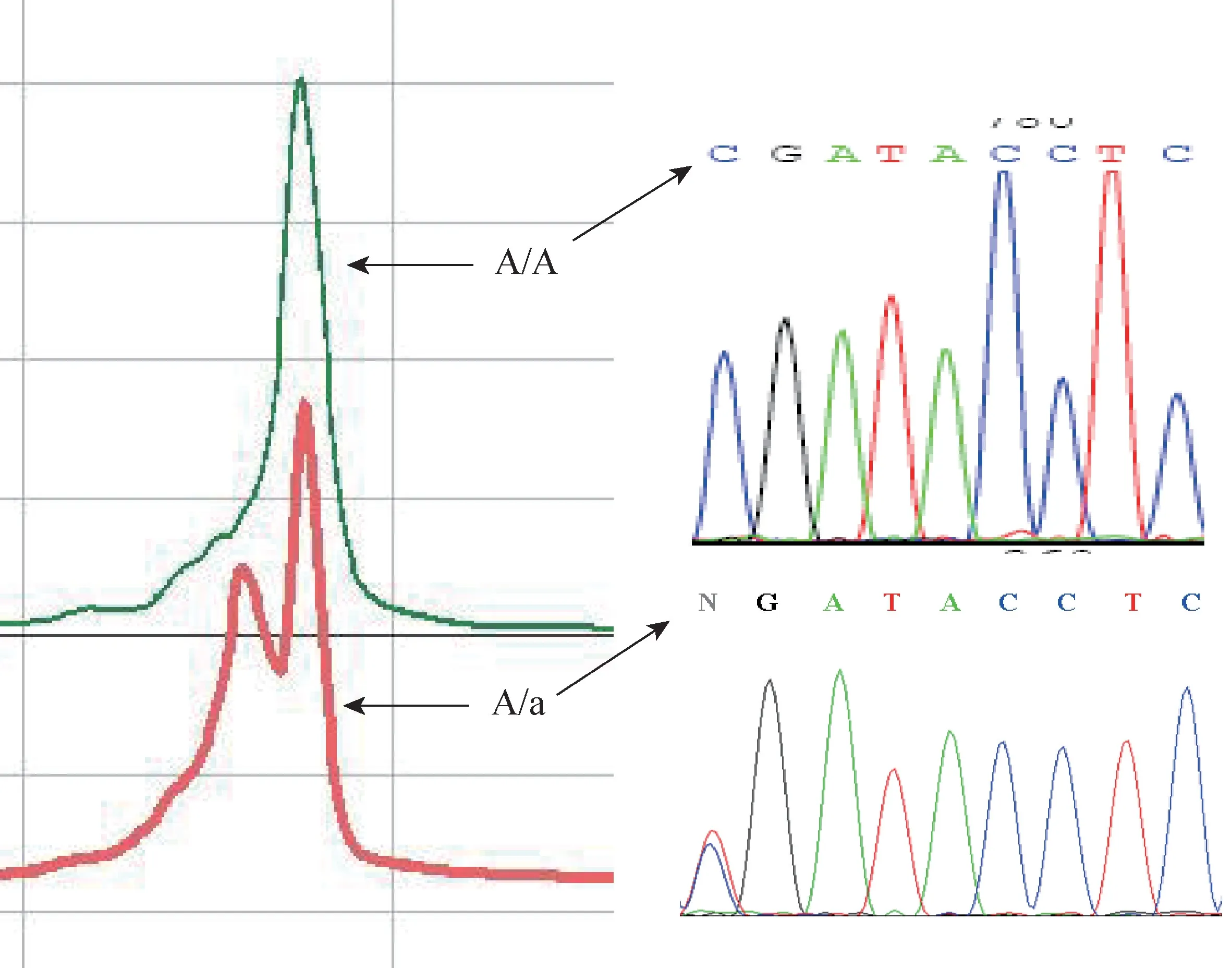
图4 DHPLC 检测结果与对应的测序结果
3 讨论
DHPLC 技术1995 年由Oefner 等建立的一种进行核酸片段的分离和分析的方法,其SNP 检测原理简单如下:杂合子个体的DNA 经扩增产生杂合二倍体,纯合子个体的DNA 扩增产生完全匹配的纯合二倍体,两种扩增产物分别进行变性后缓慢降温复性,杂合子扩增产物将形成同源双链和异源双链的混合物,而纯化子扩增产物则只有同源双链一种,同源双链和异源双链的解链特征不同,在部分变性温度(51 ℃~75 ℃)条件下,随着流动相中乙腈浓度呈线性增加的情况下与同源双链相比,带有突变序列的异源双链在分离柱内的保留时间相对较短。因此在色谱图中,带有突变序列的样品呈现出异源和同源双链两个色谱峰,而不含突变序列的样品则只有同源双链一个峰[7-8]。
DHPLC 在检测SNP 时不能区分A/A 和a/a 基因型的纯合子,因此本研究将PCR 产物与A/A 基因型的PCR 产物进行等量混合,然后进行变性复性处理,易于促使A/A 和a/a 基因型的形成异源双链,有利于突变的检出。理论上a/a 与A/A 基因型等量混合后形成的异源双链与同源双链的量是一样的,形成的谱图应该是高度一致的双峰,但是通常同源双链的退火要优于异源双链,因此在结果中显示同源峰要高于异源峰。从结果谱图中A/A 和a/a 基因型均会出现双峰的谱图,但是由于a/a 基因型个体存活率为零,因此,在日常检测中当出现双峰谱图时,即可认为是A/A 基因型。
本试验使用质粒作为不同基因型的基因材料,在方法建立过程中作为不同基因型的阳性参考样品,有利于方法建立过程中温度、浓度及梯度的确立,使用55 份奶牛样品对所建立的方法进行了验证,通过与测序结果的比对,证明所建立的PCRDHPLC 方法能够应用与临床检测。
DHPLC 在筛查单核苷酸多态位点或基因突变方面具有准确、敏感、高效、自动化等特点,是开展临床基因诊断的一种有效手段。目前已经广泛应用到临床诊断、肿瘤相关基因的筛选、遗传性疾病筛查等领域[9-12]。本试验将该技术应用于奶牛CN 检测中,建立检测方法,为将来大规模CN 筛查奠定基础。
