聚合白背飞虱和褐飞虱抗性基因创制杂交水稻恢复系
2019-09-18朱永生白建林谢鸿光吴方喜罗曦姜身飞何炜陈丽萍蔡秋华谢华安张建福
朱永生 白建林 谢鸿光 吴方喜 罗曦 姜身飞 何炜 陈丽萍 蔡秋华 谢华安 张建福,
聚合白背飞虱和褐飞虱抗性基因创制杂交水稻恢复系
朱永生1, 2白建林2谢鸿光1吴方喜1罗曦1姜身飞1何炜1陈丽萍1蔡秋华1谢华安1, 2张建福1, 2,*
(1福建省农业科学院 水稻研究所/杂交水稻国家重点实验室华南研究基地/农业农村部华南杂交水稻种质创新与分子育种重点实验室/水稻国家工程实验室/福建省作物分子育种工程实验室/福建省水稻分子育种重点实验室, 福州 350003;2福建农林大学 植物保护学院/闽台作物有害生物生态防控国家重点实验室, 福州 350002;*通讯联系人, E-mail: jianfzhang@163.com)
【】为了创制兼抗白背飞虱和褐飞虱的水稻恢复系,分别以抗褐飞虱材料B5(携带褐飞虱抗性基因和)及携带白背飞虱抗性位点的籼型恢复系福恢7011为供体亲本,以骨干恢复系福恢676为轮回亲本,应用低世代分离群体田间表型结合单株鉴定与高世代稳定株系室内筛选和分子标记辅助选择相结合的方法,并对抗虫株系及其测交后代进行考查和农艺性状分析。选育出聚合、和的恢复系材料3份,携带2个抗虫基因的恢复系材料3份。其中6份恢复系的褐飞虱抗性鉴定结果均表现中抗以上。通过抗性鉴定和杂交后代农艺性状分析筛选出具有生产应用潜力的恢复系材料2份。为褐飞虱和白背飞虱抗性聚合新种质的创制和应用提供了基础材料。
水稻;白背飞虱;褐飞虱;抗性基因;聚合育种
稻飞虱是水稻的最主要害虫之一,广泛分布于亚洲尤其是东南亚各主要稻区,属于大范围迁飞性害虫。在我国水稻种植区,对生产造成危害的主要是褐飞虱和白背飞虱[1]。20世纪70年代以来,随着杂交水稻的大面积推广和耕作制度的改革,稻飞虱对水稻生产的危害日趋严重,对我国粮食安全构成严重威胁[2]。稻飞虱除通过吸食直接破坏水稻输导组织,使水分和营养物质的运输受阻而减产外,还能传播很多水稻病毒病或诱发其他真菌和细菌性病害[3],成为水稻高产、稳产的一个重要制约因子。稻飞虱的危害也会对稻米品质产生一定的影响。长期以来,使用化学农药是防治稻飞虱最常用的手段,但过度使用化学农药存在成本高、害虫产生抗药性[4]及对生态环境造成破坏[5]等诸多弊端,对生产粮食的品质和安全也带来不良影响[6],这促使育种家们不断挖掘和寻找更为理想、有效的抗虫、防虫措施。
近年来,国内外开展了系列抗稻飞虱基因的发掘、定位和利用的相关研究,并取得了较好的进展。国内外已经报道了超过44个稻飞虱抗性位点,在35个已知的褐飞虱抗性基因中,[7]、[8]、[9]、[10]、[11]、[12]、[13]、[14]、[15]等已被克隆,而[16]、、和已在生产上得到广泛应用。水稻品种B5是一个同时携带和基因的抗虫品种[17]。徐晓明等[18]以B5为供体亲本,采用分子标记辅助选择,将B5所含的和基因导入两系不育系1892S,获得符合两用核不育系标准,且携带和的3个株系S136、S179和S192,人工接虫鉴定结果表明,3个两系不育系都高抗褐飞虱。胡巍等[19]以来源于栽培稻的抗褐飞虱基因为供体亲本,转入到华南高产水稻品种桂农占中,获得了遗传背景与桂农占95%以上相似的高抗褐飞虱的优异回交株系,为培育抗褐飞虱基因高产水稻品种提供了中间材料。除了应用传统的杂交育种改良水稻褐飞虱抗性外,通过基因工程技术将编码高效杀褐飞虱蛋白的苏云金芽孢杆菌基因密码子改造后通过农杆菌介导法转入蜀恢818,培育出具有褐飞虱抗性的新型恢复系R818-Cry30Fa1,该项研究丰富了抗褐飞虱的种质资源[20]。在已报道的9个白背飞虱抗性基因(位点)中,张建福等[21]用来自粳稻品种春江06的拒食抗性位点改良生产上感虫的恢复系品种明恢86并获得成功。
虽然抗褐飞虱的水稻品种已在生产上得到广泛应用并取得了良好的效果,但由于水稻白背飞虱抗性基因定位相关的研究进展相对缓慢,具有白背飞虱抗性的水稻品种在生产上较少,更缺少兼抗褐飞虱和白背飞虱的水稻品种。同时,鉴于白背飞虱的强适应能力,未来可能存在暴发成灾的隐患。本研究将在生产上应用广泛且表现优异的褐飞虱抗性基因、和白背飞虱抗性位点进行有效聚合,创制兼抗白背飞虱和褐飞虱的新种质,为稻飞虱抗性育种及生产应用提供新的遗传资源。
1 材料与方法
1.1 试验材料
携带水稻褐飞虱抗性基因和的供体亲本材料B5由武汉大学生命科学学院何光存教授提供;携带水稻白背飞虱抗性位点的供体亲本GL77、GL84及感虫对照品种TN1由中国科学院遗传与发育生物学研究所李家洋院士和中国农业科学院水稻研究所钱前研究员提供;携带水稻白背飞虱抗性位点的供体亲本福恢7011由本实验室选育并保存;农艺性状优良但不具备稻飞虱抗性的优质高配合力亲本福恢676(FH676)由福建省农业科学院水稻研究所超级稻研究室选育、保存。
1.2 抗虫性鉴定方法
本研究采用的稻飞虱抗性鉴定方法为标准苗期集团法,稻飞虱室内抗性鉴定委托武汉大学杂交水稻国家重点实验室完成。褐飞虱虫源为在TN1材料上饲养的野生型褐飞虱。鉴定步骤如下:分别以抗虫亲本和感虫亲本作为抗、感对照,每个品种用30~40粒种子浸种催芽,以确保各品种间幼苗状态一致。待种子出芽后,分别播种于盛满营养土的苗盘中。每个品种设两个重复,完全随机排列。待苗长到2叶1心期,剔除病苗、弱苗,保证剩余15~20株长势均匀的健壮苗。按照平均每株苗接入2~3龄飞虱若虫6~7头,放入罩有尼龙网的养虫笼中,让稻飞虱自由取食。当感虫亲本死亡率达到95%以上时统计各品种的死苗率,调查参照中国水稻研究所刘光杰等[22]制定的标准。
大田抗虫鉴定分别在课题组位于海南省三亚的南繁育种基地和位于福建省沙县夏茂的杂交水稻新品种选育与示范基地进行。在全生育期无防治的情况下,这两处育种基地分别在每年的4月中旬和9月中旬,即水稻的成熟前2~3周均有严重的稻飞虱危害。将待鉴定品种按照正常生产时节播种、移栽,每品种设3个重复小区,随机种植,每小区种植5行,每行7株,株行距为23 cm×23 cm,移栽至往年发生飞虱危害较重的田块,每隔三个小区种植一行感虫对照TN1,待成熟时进行抗性鉴定和调查并记录结果。
1.3 水稻DNA提取
在水稻苗期取新鲜嫩叶1~2 g,加液氮研磨,参照李荣华等[23]改进的CTAB法提取水稻基因组DNA。利用BECKMAN DU800核酸/蛋白分析仪检测DNA的浓度和质量,同时把DNA浓度调至约20 ng/μL备用。
1.4 PCR扩增和电泳
用于PCR的引物RM8213[21]、RI35和Y15[24]由福州擎科生物技术有限公司合成(表1)。PCR在ABI 9700 PCR系统上进行。10 μL PCR体系中含有2×PCR混合液5 μL,10 μmol/L正反向引物各0.5 μL,DNA模板1 μL,ddH2O 3 μL。反应程序如下:95℃下预变性5 min;94℃下变性30 s,55℃下退火30 s,72℃下延伸 40 s,35个循环;最后在72℃下延伸5 min。其中退火温度依据不同引物进行调整。扩增产物在6%聚丙烯酰胺凝胶(基因)上恒压电泳(120 V, 90 min),或1.5%琼脂糖凝胶(和基因)上恒压电泳(120 V, 30 min),用荧光染料Genefider染色15 min,最后在BIO-RAD凝胶成像系统上拍照记录。
1.5 农艺性状考查
水稻农艺性状的考查选择灌浆后30 d的成熟单株,每个品种考查5株,分别考查植株的株高及有效穗、每穗粒数、千粒重和结实率等产量性状。利用Excel(Microsoft office 2003)进行数据分析。
2 结果与分析
2.1 抗性基因的导入和回交群体的构建
分别以携水稻褐飞虱抗性基因和的籼型常规品种B5和携带白背飞虱抗性基因的籼型恢复系品种福恢7011为供体亲本,以福恢676为轮回亲本,分别以B5和福恢7011为供体亲本,杂交后回交1代,再从BC1F2中选择抗虫单株进行复交,后经连续5代自交,结合分子标记辅助选择和大田抗性鉴定(图1),通过田间农艺性状选择与受体亲本恢复系株叶形态及丰产性相当,飞虱抗性得到显著提高的新的优良恢复系材料,再通过测配新组合进入区域试验、审定及推广。

MAS表示分子标记辅助选择; IIR表示抗虫鉴定。
Fig. 1. Processes of rice planthopper resistance lines.

表1 水稻褐飞虱与白背飞虱抗性基因连锁标记及引物序列

M为DNA标记,1为阳性对照B5,其他为分离群体中的单株。
Fig. 2. Molecular marker analysis of insect-resistant genefor insect-resistant individuals in segregating populations.

图3 利用分子标记分别对稳定株系的褐飞虱抗性基因Bph14、Bph15及白背飞虱抗性位点qsI-4进行分子鉴定
Fig. 3. Molecular identification of resistance genes,andin stable lines.
2.2 分子标记辅助选择和抗性鉴定创制优良抗虫单株
2.2.1 低世代田间选择与单株分子标记鉴定
从BC1F2开始进行分子标记辅助选择与田间抗性鉴定相结合的方法对杂交后代进行筛选、鉴定。利用与白背飞虱抗性位点紧密连锁的SSR标记RM8213、与褐飞虱抗性基因紧密连锁的共显性标记RI35(武汉大学杜波老师提供,未发表资料)及褐飞虱抗性基因紧密连锁的共显性标记Y15用于抗性基因导入后的分离群体的分子标记辅助选择。为能够选择到形态优异的株系,一般分离群体种植5000个单株以上,先在大田利用自然诱发抗性鉴定去除感虫单株。对剩余的单株再进一步人工筛选,选出农艺性状优良,形态与轮回亲本相近的单株再进行室内分子标记辅助选择加以筛选(选择带型与供体亲本一致的纯合阳性单株,图2),进行群体中农艺性状优异单株的鉴定。即本阶段进行田间综合表现、抗性鉴定与群体分子标记辅助选择相结合筛选优异单株。
2.2.2 入选株系的室内抗性鉴定与分子标记验证
将鉴定出的优异单株进行加代稳定,再对稳定株系进行分子标记验证。从图3-A可知,以供体亲本B5为阳性对照,株系FJ717、FJ718、FJ719、FJ742、FJ745等5个株系携带褐飞虱抗性基因。图3-B结果表明,株系FJ717、FJ718、FJ719、FJ723、FJ745等5个株系携带褐飞虱抗性基因。从图3-C结果可知,以白背飞虱抗源亲本GL77、GL84及经基因导入后获得的恢复系福恢7011作为阳性对照,株系FJ717、FJ718、FJ723、FJ742和FJ745等5个株系携带白背飞虱抗性位点。
综上,在本研究入选的稳定株系中,含有2个抗性基因的稳定株系有3个,含有3个抗性基因的稳定株系也有3个,株系FJ747仅含有一个褐飞虱抗性基因,具体所携带的基因类型及个数如表2所示。即对进入高代稳定的株系进行室内分子标记与室内抗性鉴定结合,最终确认田间、室内环境均表现一致的株系用于测交配组。
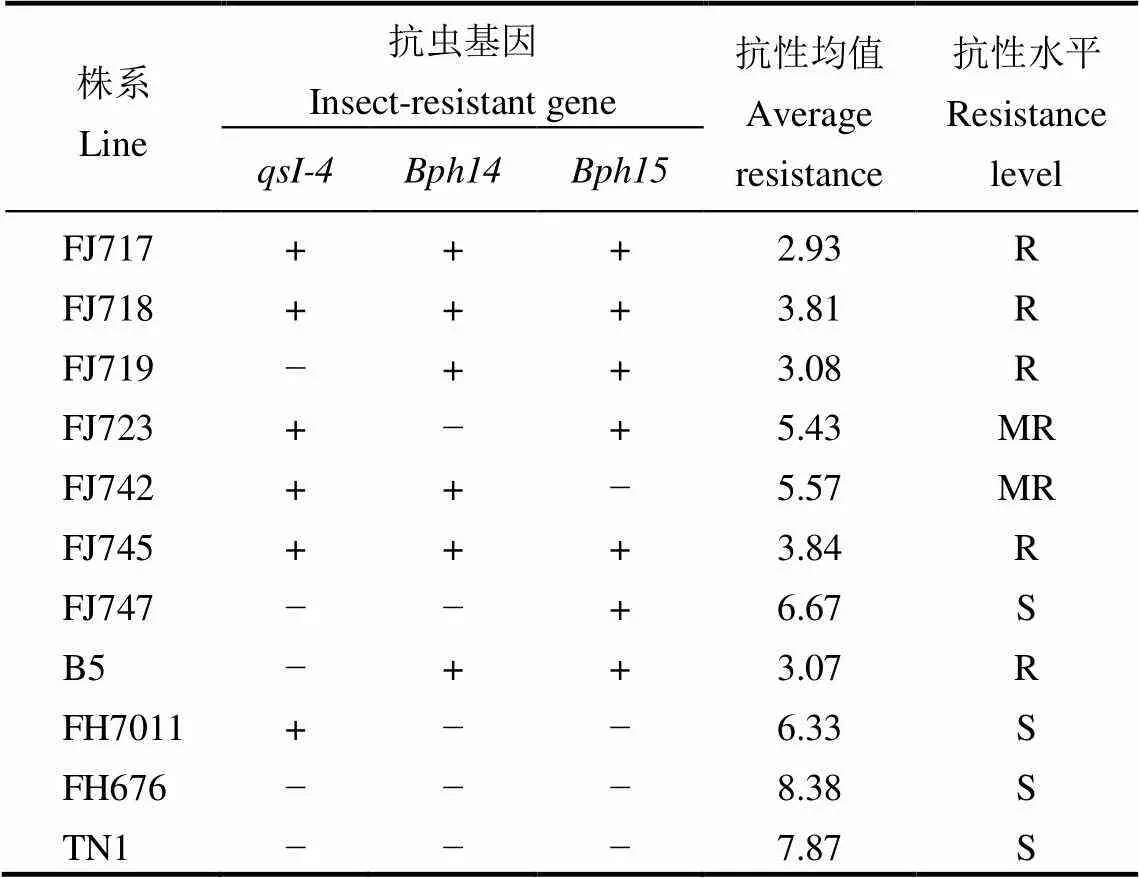
表2 各个株系携带的抗虫基因及抗性水平鉴定

左图为接虫前的幼苗状态,右图为接虫7 d后的情况。
Fig. 4. Artificial resistance identification in the laboratory of the stable lines screened in the field.
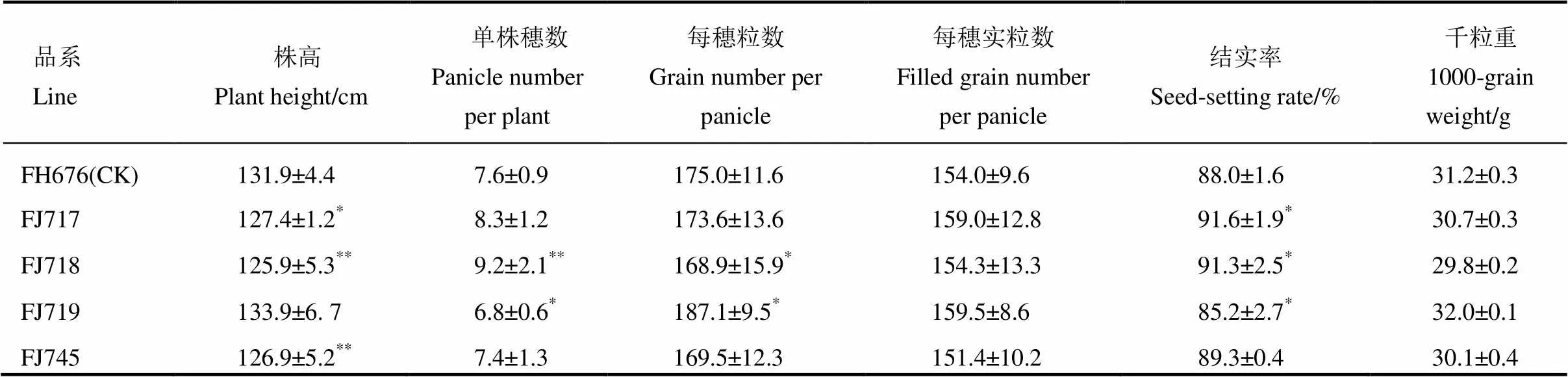
表3 入选抗虫恢复系与轮回亲本的农艺性状比较分析(福建沙县,2016)
表中*和**分别表示在0.05和0.01水平差异显著。
*and**show significant difference at 0.05 and 0.01 levels, respectively.
为了进一步验证经过大田筛选的稳定株系是否能经受室内严格的高强度人工接虫鉴定,我们对上述筛选出的7个株系进行室内褐飞虱抗性鉴定(图4)。供体亲本B5表现高抗,入选株系FJ717、FJ718、FJ719、FJ745也表现高抗褐飞虱,株系FJ723、FJ742和FJ747表现为中抗;携带白背飞虱抗性基因的原始亲本GL77、GL84及改造后的福恢7011均表现中感,轮回亲本福恢676与感虫对照TN1均表现高感。即含有3个抗虫基因或两个褐飞虱抗性基因的株系均表现高抗,携带和的株系FJ723或携带和的株系FJ742和仅携带B的株系FJ747均表现为中抗,这与上述分子标记验证的结果相符(表2)。
2.3 抗虫株系与轮回亲本的农艺性状及后代杂种优势分析
利用分子标记辅助选择和田间自然抗性鉴定与室内人工抗性鉴定相结合,筛选出FJ717、FJ718、FJ719和FJ745等4个株叶形态适中、穗大、结实率高、株系群体稳定、整齐一致的恢复系新材料,对其进行田间农艺性状的考查,并与轮回亲本福恢676进行对比。从表3可以看出,入选的4个抗虫株型系,除FJ719略高于对照外,其他三个株系的株高均显著低于轮回亲本,其中FJ718的有效穗数显著增加,FJ717和FJ718的结实率显著提高,粒重均无显著差异。其他主要农艺性状与轮回亲本均较为接近,说明经过多代定向选择,获得了抗虫基因的导入对农艺性状影响不明显的株系,具有较强的生产应用价值。
为了进一步验证抗虫株系在杂交组合的测配时配合力和后代杂种优势是否与轮回亲本存在显著差异,分别选择具有代表性的三系不育系Ⅱ-32A和两系不育系Y58S进行测交配组。同时在成熟期对F1的各个农艺性状进行考查。从表4可知,所有父本与三系不育系测配的组合理论产量均高于与两系不育系测交的组合。在以三系不育系Ⅱ-32A测配的组合中,Ⅱ-32A/FJ717和Ⅱ-32A/FJ718的理论产量显著高于轮回亲本所测组合。在以两系不育系测配的组合中,Y58S/FJ718和Y58S//FJ745的理论产量显著高于轮回亲本所配组合。
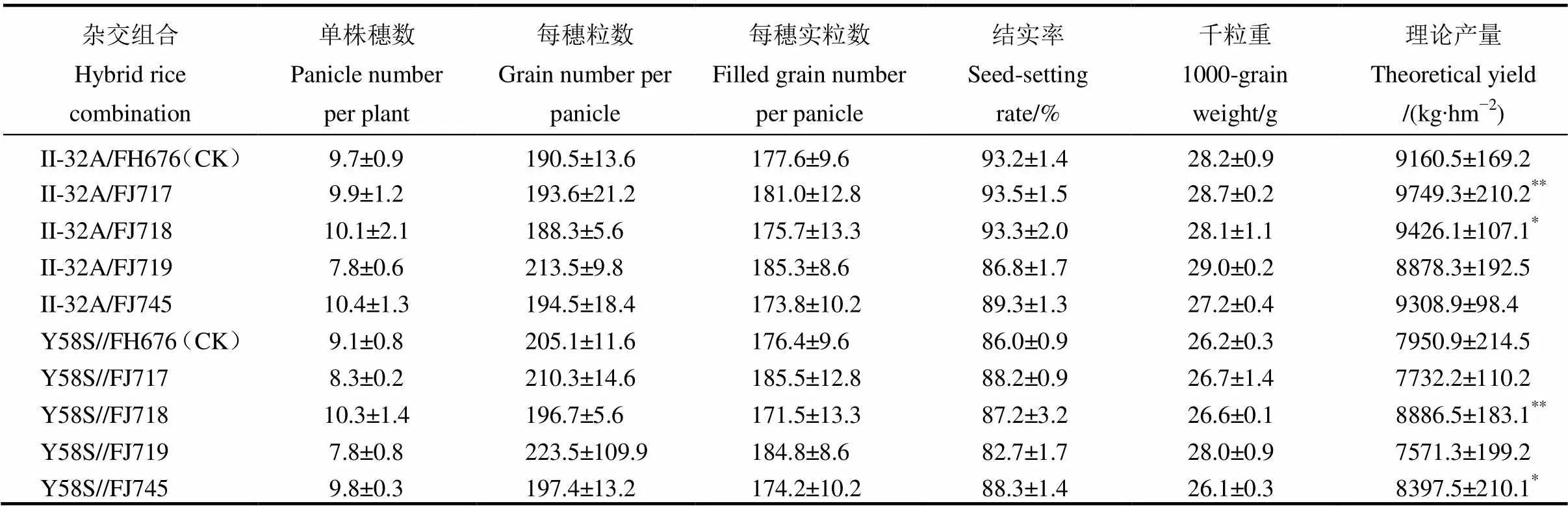
表4 入选抗虫恢复系与轮回亲本的杂交后代农艺性状比较分析(福建沙县,2018)
*和**分别表示与具有相同父本的对照的差异达0.05和0.01显著水平。
*and**show significant difference compared with its CK combination derived from the same male parent at 0.05 and 0.01 levels, respectively.
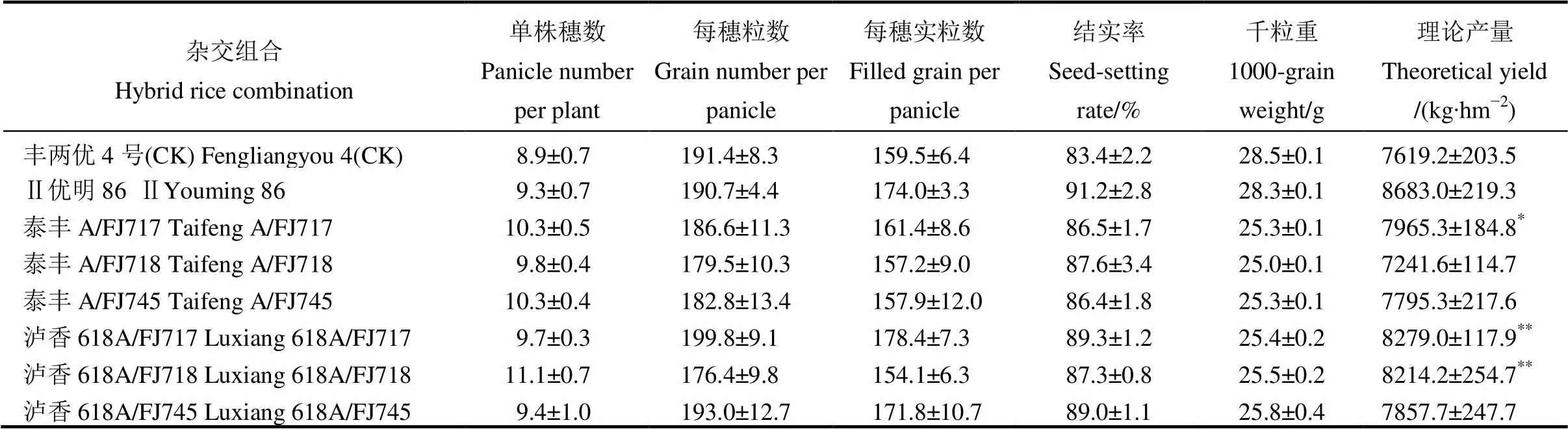
表5 入选抗虫恢复系与轮回亲本的杂交后代农艺性状比较分析(海南三亚,2018)
*和**分别表示与丰两优4号的差异达0.05和0.01显著水平。
*and**show significant difference compared with Fengliangyou 4 at 0.05 and 0.01 levels, respectively.
综上,本研究中所改造的携带抗虫基因的父本与三系不育系测交的后代杂种优势强于两系不育系,且以组合Ⅱ-32A/FJ717理论产量最高,具有较强的后代杂种优势。鉴于本研究中的父本更适合于进行三系杂交水稻测配,在后续的新杂交组合的测交试验中,将注重选择优质、抗病,且遗传背景与农艺性状存在一定互补性的三系不育系进行杂交水稻新品种的测配与筛选,以充分利用所选育恢复系的抗虫性与后代的杂种优势。
2.4 杂交组合的测配与优势组合的筛选
对入选的稳定恢复系配合力和杂种优势分析表明,株系FJ717、FJ718和FJ745与三系不育系的测交后杂种优势强于两系不育系,且3个株系结果表现一致。因此,本研究进一步利用这3个株系,选择适于目前生产和市场需求的优质三系不育系泰丰A、泸香618A等进行测交配组,并以生产推广品种丰两优4号和Ⅱ优明86作为对照。从表5可见,因所用不育系均属于优质型,后代的产量优势均未超过高产型的对照种Ⅱ优明86。但除组合泰丰A/FJ718外,所有测配的组合理论产量均高于丰两优4号,其中泸香618A/FJ717和泸香618A/FJ718的增产达到极显著水平,表现出良好的生产应用潜力。此外,所有测交组合的结实率均在85%以上,充实饱满,形态优异,组合泸香618A/FJ718的平均有效穗达到11个,属于多穗型杂交水稻新组合。以父本FJ717分别与2个优质不育系测配的后代理论产量均高于另外两个父本,表现出更好的杂种优势和产量潜力,且该父本携带了褐飞虱抗性基因、和白背飞虱抗性位点,是直接用于抗稻飞虱杂交水稻新品种选育和作为种质创新的优良亲本,下一步将进行大田测产,进一步验证抗虫父本的后代杂种优势。
3 讨论
稻飞虱抗性育种一直以来都是水稻育种家的重点研究方向。虽然目前生产上褐飞虱的危害面积和所造成的损失均超过白背飞虱,但白背稻虱亦属长距离迁飞性害虫,在我国主要稻区初次虫源由南方热带稻区随气流逐代逐区迁入,其迁入时间早于褐飞虱,且白背飞虱在稻株上的活动位置较褐飞虱高,其温度适宜范围更大,在30℃高温或15℃低温下都能正常生长发育。随着全球气候环境的恶化,气温变幻莫测,白背飞虱具有更强的适应能力,存在着泛滥成灾的潜在风险。因此,目前生产上除了控制褐飞虱的危害,还应前瞻性考虑如何应对白背飞虱的潜在威胁。而选育抗稻飞虱杂交水稻是防治稻飞虱最安全、有效的途径。
随着一系列抗稻飞虱基因的定位和克隆,相关标记的开发和应用已成为水稻抗稻飞虱育种最重要的手段之一。分子标记辅助选择不受环境或植株状态的影响,被广泛应用于对杂交育种后代的检测。多年来,本课题组一直将稻飞虱抗性育种作为重要的研究方向,已成功将白背飞虱抗性位点导入到以明恢86为背景的亲本材料中,所选育的抗性恢复系福恢7011已获得植物新品种权保护,并有多个杂交组合参加省级以上区试。本研究是在此亲本材料的基础上,以携带褐飞虱抗性基因和的亲本B5为抗源,以配合力好,形态优异的骨干恢复系亲本福恢676为轮回亲本,通过杂交导入、回交群体的构建和筛选、高代株系的抗性鉴定和分子验证,综合苗期人工接虫鉴定与成株期田间抗性表现相结合,客观地评价抗稻飞虱基因的遗传改良效应,即以田间筛选和分离群体鉴定以及室内筛选和分子验证相结合的方法,获得了一批具携带2个以上抗性基因的恢复系材料,为稻飞虱抗性的聚合育种提供了新的种质和遗传资源,通过对其杂交后代的农艺性状进行考查,发现FJ717和FJ718等2个株系具有良好的应用价值和潜力。
许多研究证实,由多基因控制的抗虫品种比由单基因控制的抗虫品种表现出更强、更持久的抗虫性,如含有和基因的抗虫品种Ptb33[22]及同时含有主效基因与微效基因的抗虫品种IR64[25]等。鉴于此,为有效提高基因聚合成功率,在基因聚合育种过程中,育种家通常选择位于同一染色体或相同基因座上的基因进行聚合,有利于提高育种效率,获得更多携带目标基因的株系。本研究中供体亲本褐飞虱抗性基因和白背飞虱抗性位点均位于水稻第4染色体,提高了两种抗虫基因聚合的效率。但前人的研究结果也表明,褐飞虱抗性基因和所抗的稻飞虱生物型均为Ⅰ、Ⅱ和Ⅲ[9-10],不能抵抗Ⅳ型褐飞虱的危害,这在一定程度上限制了抗性株系的应用范围。同时,获得的抗虫恢复系测配后代的产量、生育期等农艺性状达到了轮回亲本的水平,但是其后代品质受到一定的影响。因此,在后续研究中将着重围绕品质进行改良,并继续导入具有4型稻飞虱抗性的基因和等,创制新的优异种质资源,提高抗虫材料的应用价值和应用潜力。
[1] 沈君辉, 尚金梅, 刘光杰. 中国的白背飞虱研究概况. 中国水稻科学, 2003, 17(增刊): 7-22.
Shen J H, Shang J M, Liu G J. Management of the whitebacked planthopper,in China: A mini-review.2003, 17(Suppl): 7-22. (in Chinese with English abstract)
[2] 任西明, 向聪, 雷东阳, 管利凤. 水稻抗褐飞虱育种研究进展与展望. 作物研究, 2017, 31(4): 453-458.
Ren X M, Xiang C, Lei D Y, Guan L F. Present status and prospect of resistance breeding of brow planthopper in rice., 2017, 31(4): 453-458.
[3] 蒋宁飞. 利用昌恢891和02428的回交自交系群体定位抗稻飞虱的QTL. 南昌: 江西农业大学, 2016.
Jiang N F. Mapping quantitative trait loci(QTL) for rice planthopper resistance of Changhui 891/02428 backcross inbred lines. Nanchang: Jiangxi Agriculture University, 2016. (in Chinese with English abstract)
[4] 王彦华, 王鸣华. 褐飞虱抗药性及再猖獗研究进展. 农药, 2006, 45(4): 227-231.
Wang Y H, Wang M H. Research progress oninsecticide resistance and proliferation of the resistant biotype.2006, 45(4): 227-231. (in Chinese with English abstract)
[5] 姜辉, 林荣华, 刘亮, 瞿唯钢, 陶传江. 稻飞虱的危害及再猖獗机制. 昆虫知识, 2005, 42(6): 612-615.
Jiang H, Lin R H, Liu L, Qu W G, Tao C J. Planthoppers damage to rice and the resurgence mechanism., 2005, 42(6): 612-615. (in Chinese with English abstract)
[6] 侯丽媛, 于萍, 徐群, 袁筱萍, 余汉勇, 王一平, 王彩红, 万国, 彭锁堂, 魏兴华. 两个水稻抗褐飞虱隐性基因的遗传分析与初步定位. 中国水稻科学, 2010, 24(4): 367-371.
Hou L Y, Yu P, Xu Q, Yuan Y P, Yu H Y, Wang Y P, Wang C H, Wan G, Peng S T, Wei X H. Genetic analysis and preliminary mapping of two recessive resistance genes in rice to brown planthopper,., 2010, 24(4): 367-371. (in Chinese with English abstract)
[7] Jairin J, Sansen K, Wongboon W, Jate K. Detection of a brown planthopper resistance geneat the same chromosomal position ofusing two different genetic backgrounds of rice., 2010, 60(1): 71-75.
[8] Zhao Y, Huang J, Wang Z Z, Jing S L, Wang Y, Ouyang Y, Cai B D, Xin X F, Liu X, Zhang C X, Pan Y F, Ma R, Li Q F, Jiang W H, Zeng Y, Shangguan X X, Wang H Y, Du B, Zhu L L. Xu X, Feng Y Q, He S Y, Chen R Z, Zhang Q F, He G C. Allelic diversity in an NLR geneenables rice to combat planthopper variation., 2016, 113(45): 12850-12855.
[9] Du B, Zhang W, Liu B, Hu J, Wei Z, Shi Z He R, Zhu L, Chen R, Han B, He G. Identification and characterization of, a gene conferring resistance to brown planthopper in rice., 2009, 106(52): 22163-22168.
[10] Lv W, Du B, Shangguan X, Zhao Y, Pan Y, Zhu L, He Y, He G. BAC and RNA sequencing reveal the brown planthopper resistance gene BPH15 in a recombination cold spot that mediates a unique defense mechanism., 2014, 11(15): 674.
[11] Jena K K, Jeung J U, Lee J H, Choi C, Brar D S. High-resolution mapping of a new brown planthopper (BPH)resistance gene,(t), and marker-assisted selection for BPH resistance in rice(L)., 2006, 112(2): 288-297.
[12] Tamura Y, Hattori M, Yoshioka H, Yoshioka M, Takahashi A, Wu J, Sentoku N, Yasui H. Map-based cloning and characterization of a brown planthopper resistance gene BPH26 fromL. ssp.cultivar ADR52., 2014, 4: 58-72.
[13] Wang Y, Cao L, Zhang Y, Cao C, Liu F, Huang F, Qiu Y, Li R, Luo X. Map-based cloning and characterization of BPH29, a B3 domain-containing recessive gene conferring brown planthopper resistance in rice.,2015, 66(19): 6035-6045.
[14] Ren J, Gao F, Wu X, Lu X, Zeng L, Lv J, Su X, Luo H, Ren G., a novel gene encoding an unknown SCR domain containing protein, confers resistance against the brown planthopper in rice., 2016, 6: 37 645.
[15] Hu J, Zhou J, Peng X, Xu H, Liu C, Du B, Yuan H, Zhu L, He G. Thegene interacts with the ethylene pathway and transcriptionally regulates MAPK genes in the response of rice to brown planthopper feeding., 2011, 156(2): 856-872.
[16] Guo J, Xu C, Wu D, Zhao Y, Qiu Y.encodes an exocyst-localized protein and confers broad resistance to planthoppers in rice., 2018, 50(2): 297-306.
[17] Huang Z, He Z, Shu L, Li X. Identification and mapping of two brown planthopper resistance genes in rice., 2001, 102: 929-934.
[18] 徐晓明, 程攀, 陈龙, 曲姗姗, 阴云火, 田发春, 彭炳生, 吴帅, 李土明, 周卫营. 应用分子标记辅助选育抗褐飞虱水稻两系不育系. 安徽农业科学, 2016, 44(20): 107-108.
Xu X M, Cheng P, Chen L, Qu S S, Yin Y H, Tian F C, Peng B S, Wu S, Li T M, Zhou W Y. Breeding TGMS lines with resistance to brown planthopper by marker-assisted selection., 2016, 44(20): 107-108. (in Chinese with English abstract)
[19] 胡巍, 李艳芳, 胡侃, 江奕君, 张扬. 分子标记辅助选择抗褐飞虱基因改良桂农占的BPH抗性. 分子植物育种, 2015, 13(5): 951-960.
Hu W, Li Y F, Hu K, Jiang Y J, Zhang Y. Improving BPH-resistance of rice cultivar Guinongzhan by marker-assisted selection for BPH-resistant genes., 2015, 13(5): 951-960. (in Chinese with English abstract)
[20] 王海鹏, 黄晓西, 梁越洋, 朱军, 张翠霞, 王秀梅, 贡常委, 郑爱萍, 邓其明, 李双成, 王玲霞, 李平, 王世全. 转基因抗褐飞虱水稻的获得及鉴定. 中国水稻科学, 2016, 30(3): 256-264.
Wang H P, Huang X X, Liang Y Y, Zhu J, Zhang C X, Wang X M, Gong C W, Zheng A P, Deng Q M, Li S C, Wang L X, Li P, Wang S Q. Development and Identification of insect resistant transgenic rice withgene., 2016, 30(3): 256-264. (in Chinese with English abstract)
[21] 张建福, 曾大力, 朱永生, 谢鸿光, 蔡秋华, 连玲, 吴方喜, 罗曦, 王颖姮, 郑轶, 谢华安. 分子标记辅助选择创制抗白背飞虱水稻恢复系. 中国水稻科学, 2013, 27(3): 329-334.
Zhang J F, Zeng D L, Zhu Y S, Xie H G, Cai Q H, Lian L, Wu F X, Luo X, Wang Y H, Zheng Y, Xie H A. Breeding of rice restore lines with white-backed planthopper resistance by marker-assisted selection., 2013, 27(3): 329-334. (in Chinese with English abstract)
[22] 刘光杰, 付志红, 沈君辉, 张亚辉. 水稻品种对稻飞虱抗性鉴定方法的比较研究. 中国水稻科学, 2002, 16(1): 52-56.
Liu G J, Fu Z H, Shen J H, Zhang Y H. Comparative study on evaluation methods for resistance to rice planthoppers (Homoptera: Delphacidae) in rice., 2002, 16(1): 52-56. (in Chinese with English abstract)
[23] 李荣华, 夏岩石, 刘顺枝, 孙莉丽, 郭培国, 廖绅裕, 陈健辉. 改进的CTAB提取植物DNA方法. 实验室研究与探索, 2009, 28(9): 14-16.
Li R H, Xia Y S, Liu S Z, Sun L L, Guo P G, Liao S Y, Chen J H. CTAB improved method of DNA extraction in plant., 2009, 28(9): 14-16. (in Chinese with English abstract)
[24] 何光存, 陈荣智, 杜波, 祝莉莉. 水稻抗褐飞虱基因的特异性共显性分子标记及其应用: CN107779522A. 2018-03-09.
He G C, Chen R Z, Du B, Zhu L L. Specific co-dominant molecular markers of rice brown planthopper resistance geneand their application: CN107779522A. 2018-03-09. (in Chinese)
[25] Sidhu G S, Khush G S. Genetic analysis of brown planthopper resistance in twenty varieties of rice,L., 1978, 53: 199-203.
Breeding Restore Lines of Hybrid Rice by Pyramiding Genes for Resistance to White Backed Planthoppers and Brown Planthoppersf
ZHU Yongsheng1, 2, BAI Jianlin2, XIE Hongguang1, WU Fangxi1, LUO Xi1, JIANG Shenfei1, HE Wei1, CHEN Liping1, CAI Qiuhua1, XIE Huaan1, 2, ZHANG Jianfu1, 2, *
(Rice Research Institute, Fujian Academy of Agricultural Sciences/Research Bases of South-China, National Key Laboratory of Hybrid Rice of China/Key Laboratory of Hybrid Rice Germplasm Enhancement and Molecular Breeding in South China, Ministry of Agriculture and Rural Affairs, P. R. China/National Engineering Laboratory of Rice for China/ Fujian Engineering Laboratory of Crop Molecular Breeding/ Fujian Key Laboratory of Rice Molecular Breeding, Fuzhou 350003, China; College of Plant Protection, Fujian Agriculture and Forestry University/State Key Laboratory of Ecological Pest Control for Fujian and Taiwan Crops, Fuzhou 350002,;Corresponding author,:)
【】To breed restore lines of hybrid rice resistant to white backed planthoppers and brown planthoppers,【】we used B5 with brown planthopper resistance genesandand Fuhui 7011 with white backed planthoppers resistance geneas donor parents, and Fuhui 676, a main restorer line, as the recurrent parent through the molecular marker-assisted selection combined with field and indoor identification. The insect-resistant lines and their hybrid progenies were tested and their agronomic traits were analyzed. 【】Three restorer lines with three resistance genes to rice brown planthoppers and white backed planthoppers (,and) and three lines with two resistance genes were bred. Resistance identification indicated that the resistance of the restorer lines was moderately resistant or resistant. Two restorer lines with potential for production and application were screened out by examining the resistant strains and their crossing progenies and analyzing their agronomic traits.【】This study provides new resistance germplasms against brown planthoppers and white backed planthoppers for hybrid rice breeding.
rice; white backed planthopper(WBPH); brown planthopper(BPH); resistance gene; pyramiding breeding
S435.112+.3; S511.0351
A
1001-7216(2019)05-0421-08
10.16819/j.1001-7216.2019.9007
2019-01-10;
2019-03-18。
国家重点研发计划资助项目(2017YFD0100100); 福建省公益类科研院所科研专项(2015R1021-5); 闽台作物有害生物生态防控国家重点实验室开放课题基金资助项目(SKB2017001); 福建省农业科学院创新团队项目(STIT2017-1-1); 福建省农业科学院科技服务团队资助项目(kjfw02)。
