水稻叶倾角分子机制及育种应用的研究进展
2019-09-18胡娟林晗徐娜焦然戴志俊鲁草林饶玉春王跃星
胡娟 林晗 徐娜 焦然 戴志俊 鲁草林 饶玉春,* 王跃星,*
水稻叶倾角分子机制及育种应用的研究进展
胡娟1林晗1徐娜1焦然1戴志俊1鲁草林2饶玉春1,*王跃星2,*
(1浙江师范大学 化学与生命科学学院,浙江 金华 321004;2中国水稻研究所 水稻生物学国家重点实验室,杭州 310006;*通讯联系人,E-mail: ryc@zjnu.cn;wangyuexing@caas.cn)
水稻叶倾角是指叶片与茎秆之间的夹角,叶倾角影响叶片光合作用速率,与株型和产量密切相关,如直立叶片就是水稻理想株型形态因素之一。叶倾角的大小受到多种植物激素的调控,是油菜素内酯、生长素、赤霉素、茉莉酸等多种激素相互作用的结果,另外,其他因素如根系分布、叶片大小、生长环境等也会对水稻叶倾角大小产生一定的影响。本文根据水稻叶倾角的研究进展,着重从叶枕的发育、激素水平及其他因素等方面,对水稻叶倾角的分子机制及其在育种中的应用进行阐述与总结,以期为水稻株型的分子设计育种提供参考,为进一步提高水稻的产量奠定理论基础。
水稻; 叶倾角; 分子机制; 育种应用
水稻(是我国重要的粮食作物,我国的水稻育种主要经历了矮化育种、三系杂交稻培育、两系杂交稻培育、亚种间杂种优势利用、理想株型育种和绿色超级稻培育等6个重要历程[1,2]。近年来,随着分子生物学与基因组学的不断发展,出现了基因组育种、转基因育种、分子标记辅助选择育种与基因编辑育种等新的育种技术手段与方法,我国水稻育种正迈向设计育种的新时代。育种目标也从一味地追求产量到优质、多抗和稳产并重,因此与产量、抗性、优质等性状相关的基因不断被挖掘、克隆与分析,这些基因的挖掘为设计育种奠定了基础,并在培育高产优质的绿色超级稻品种中展现出巨大的潜力[2]。在育种过程中,良好的群体株型是水稻高产的必备条件,日本栽培学家松岛省三、我国育种家杨守仁先生和袁隆平先生对高产水稻的株型要求,都提到了水稻上部功能叶片直立的表型[3-5]。直立叶片可以增加叶片的受光面积,提高光合作用效率,有利于有机物的积累,从而增加水稻产量[6]。
叶片与主茎之间的夹角称为叶倾角,叶倾角的大小是影响光截获、光合效率和种植密度的最重要的冠层结构参数之一[7]。叶片是进行光合作用的主要器官,自水稻抽穗开花期到灌浆结实期,水稻的功能叶(剑叶、倒2叶、倒3叶)是穗部养分的主要供应者,其中,剑叶对水稻产量的贡献率最高[8,9]。周行岳等[9]在关于高产水稻品种株型的研究中发现,高产水稻的剑叶叶倾角应该为13°~17°,倒2叶和倒3叶这两片叶的叶倾角一般要求18°左右,或倒3叶略大于18°。剑叶叶倾角小而倒2、3叶的叶倾角依次增大,使得植株呈塔形,能够更大程度接受阳光照射,加大叶片的受光面积,提高光能利用率。叶倾角是由叶枕近轴面和远轴面细胞分裂与生长不平衡所导致的,而叶枕的发育主要受到油菜素内酯等多种植物激素调控,除此之外植株的生长环境等其他因素也会对水稻叶倾角大小产生一定的影响。本文主要从叶枕的发育、激素水平及其他因素等方面对水稻叶倾角形成的分子机制和水稻叶倾角在育种中的应用进行综述和总结,以期为超高产水稻育种和理想株型的塑造提供一定的理论参考。
1 叶枕的发育对叶倾角的影响
水稻叶倾角是衡量叶片的空间伸展姿态的主要指标,叶倾角的大小与叶枕(叶片与叶鞘的连接处)的发育密不可分。叶枕近轴面与远轴面细胞分裂与生长不平衡,会导致叶倾角的大小发生改变。如叶枕近轴面的细胞伸长、叶枕近轴面的细胞分裂增加或叶枕的机械组织强度降低等,都会使水稻叶倾角增加[10,11]。例如,缺失导致叶枕近轴面细胞伸长,使叶倾角增加[10]。相反,叶枕近轴面细胞不纵向伸长则会使叶倾角减小、叶片直立[12,13]。
通过正向或反向遗传学产生的许多叶枕发育相关突变体都与油菜素类酯的生物合成或信号传导相关,其他植物激素如生长素、赤霉素、茉莉酸、独脚金内酯和乙烯也参与调控叶枕的发育,从而影响叶倾角大小。除植物激素外,机械组织强度、向地性、根系分布、叶片大小和生长环境等也对叶倾角的大小有着不同程度的影响,叶倾角大小相关的调控途径及影响因素总结如图1所示。通过前人的研究,许多与叶倾角调控相关的基因被鉴定与分离。Luo等[14]对植物激素调控水稻叶倾角进行了总结,初步建立了叶倾角的调控网络,但叶倾角的发育和调控机制的研究还有待于进一步完善,从而更好地发挥叶倾角这一性状在水稻育种中的作用。
2 激素对水稻叶倾角的影响
2.1 油菜素内酯
油菜素内酯(brassinolide, BR)最早是在油菜花粉中发现的一种甾醇内酯化合物,1998年,在第13届国际植物生长物质年会上被正式确认为第六类植物激素[15]。油菜素内酯在植物根茎伸长、维管束分化、光形态建成、种子发芽、生殖发育和向性建成等生长发育过程中发挥着重要作用;同时油菜素内酯还能提高植物的抗逆性,在抗旱、抗盐、抗热、抗病等各方面都有一定的作用[16,17]。叶枕对外源性24-表油菜素内酯敏感。因此,根据24-表油菜素内酯可诱导叶枕近轴面细胞的分裂和伸长而促进弯曲的原理,叶片倾斜实验可以被用作天然或合成的油菜素内酯及其酮类同源物的微量、定量生物测定[18]。根据前人研究,水稻叶倾角的发育与油菜素内酯的合成、油菜素内酯的信号传导及油菜素内酯的稳态等有着重要的关系,目前已报道的油菜素内酯调控水稻叶倾角基因总结如表1所示。
增强油菜素内酯合成相关基因的表达可以增大水稻叶倾角,抑制则导致叶倾角变小,外源喷施油菜素内酯也能达到此效果。BR生物合成途径主要由早期和晚期C-22氧化途径以及早期和晚期C-6氧化途径组成,催化BR生物合成的大多数酶属于细胞色素P450蛋白家族[19-23]。近几十年来,研究人员利用生化及分子生物学、基因研究等方法克隆与鉴定了许多与BR生物合成主要途径相关的基因。矮秆突变体的典型表型有叶倾角明显减小,叶片直立,通过外源的BR处理可恢复。编码细胞色素P450(CYP90D2),催化BR生物合成过程中从6-脱氧茶甾酮(6-deoxoteasterone)→3-脱氢-6-脱氧茶甾酮(3-dehydro-6-deoxoteasterone)和茶甾酮(teasterone)→3-脱氢茶甾酮(3-dehydroteasterone)的反应[20]。BR缺乏矮秆突变体,表现出叶片直立等明显的BR缺乏症症状。作为拟南芥的同源基因,编码氧化还原酶,在BR生物合成早期的24-亚甲基胆固醇(24-MC)到菜油甾醇(CR)反应中起催化作用[21]。突变体呈现出矮化、叶倾角明显减小以及叶片直立的性状,通过外源的BR处理可恢复。编码细胞色素P450 (CYP724B1),对油菜素内酯生物合成中6-脱氧香蒲甾醇(6-DeoxoTY)和香蒲甾醇(TY)的合成起催化作用[22]。插入突变体,表现为叶片直立,属BR缺乏类型的突变体。编码细胞色素P450(CYP90B2),催化油菜素内酯生物合成后期步骤的C-22的羟基化。与在功能上存在重复,单独突变对油菜素内酯合成和植物株型的影响有限[23]。
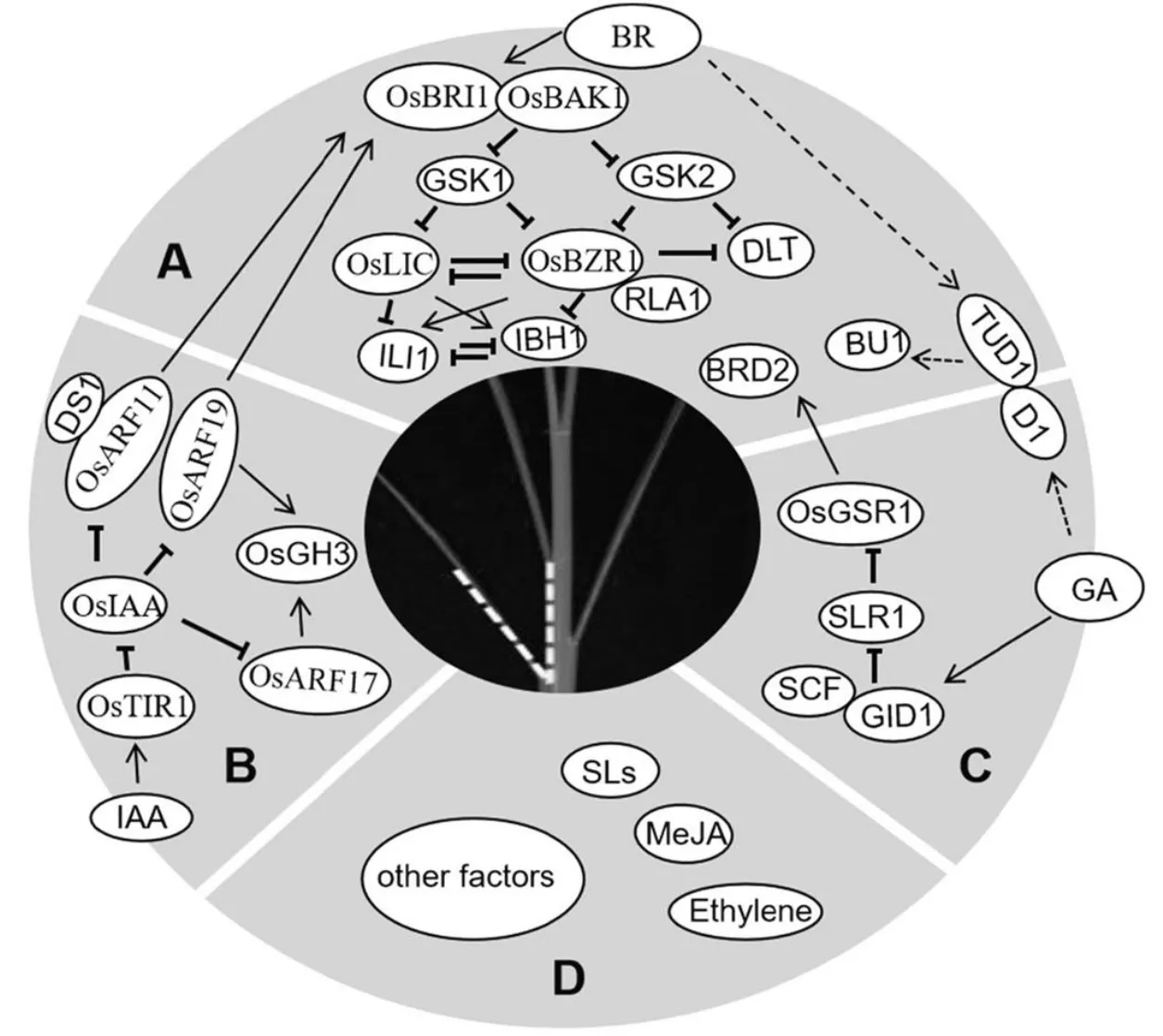
A-A-油菜素内酯信号途径调控叶倾角;B-生长素信号途径调控叶倾角;C-赤霉素信号途径调控叶倾角;D-其他因素调控叶倾角。以垂直条结束的黑线表示抑制性蛋白质与蛋白质相互作用,箭头表示转录的正调控;相连的圆圈表示蛋白质之间直接互作;虚线表示尚未完全理解的相互作用或调节机制。
Fig. 1. Rice leaf inclination angle regulation pathway and its influencing factors.
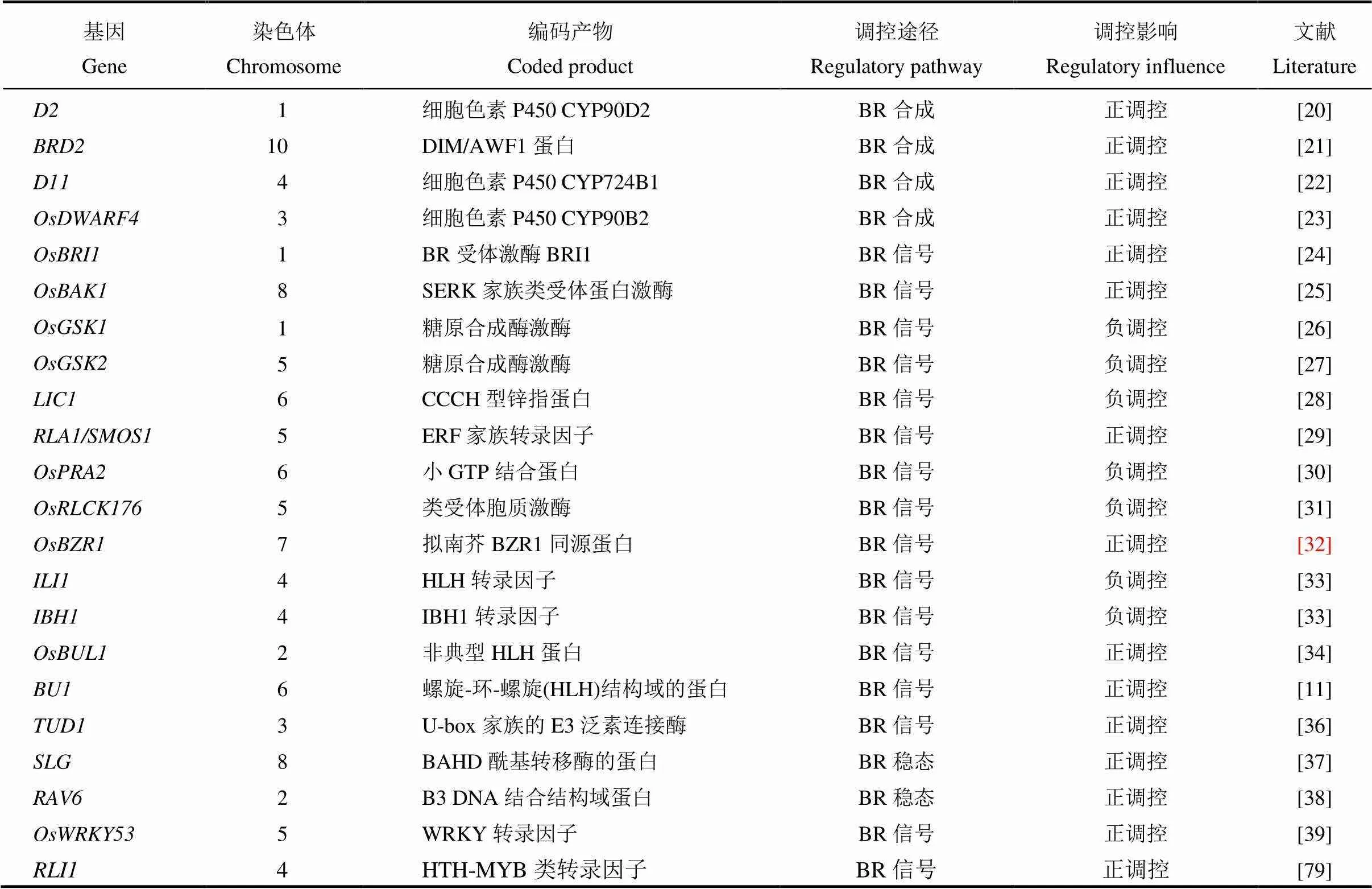
表1 油菜素内酯相关基因调控水稻叶倾角
油菜素内酯信号传导途径在拟南芥中已经被广泛研究,在水稻中也鉴定了大量编码BR信号通路成分的同源基因如[24]、[25]、[26]和[32]。某些其他BR信号组件,如、和似乎是水稻独有的,表明BR信号传导途径在水稻和拟南芥中存在差异[28-29]。油菜素内酯信号传导途径对水稻叶倾角调控非常重要,油菜素内酯信号途径调控叶倾角如图1-A所示。是拟南芥BR受体激酶的的同源基因,编码BR受体激酶BRI1,调控水稻节间的伸长,包括诱发居间分生组织的形成和节间细胞的纵向伸长,控制叶倾角的大小。功能缺陷,会导致对外施油菜素内酯不敏感,体内油菜素内酯信号传导受阻,出现叶倾角减小,叶片直立等性状[24]。是拟南芥BR受体激酶的同源基因,编码SERK家族类受体蛋白激酶,是的共受体,调控BR信号传导。通过简单地抑制的表达,可以获得直立叶的表型但又不影响植株的生长与繁殖[25]。与互作的还有其他基因如,、、、等[30-31]。编码小GTP结合蛋白,与相互作用导致与其共同受体解离,并消除介导的磷酸化。过表达株系表现为叶倾角变小,对外源油菜素内酯敏感性降低,而通过RNA干扰抑制表达会导致植株叶倾角增大,对外源施加的油菜素内酯更敏感[30]。、、和等编码类受体胞质激酶,与油菜素内酯受体互作,负调控油菜素内酯信号,影响叶倾角[31]。是拟南芥BR受体激酶的同源基因,RNA干扰抑制表达,会导致转基因水稻产生矮秆、直立叶的表型,BR敏感性降低且BR应答基因表达发生改变。与BR信号调节因子14-3-3蛋白互作使滞留在细胞质中,无法进入核内调控BR响应[32]。与相互拮抗,编码CCCH型锌指蛋白,具有转录激活活性,同时又具有RNA结合活性,是油菜素内酯响应途径中的负向调节子,抑制内源表达会导致叶倾角明显增加[28]。与相互作用以增强其转录活性,编码ERF(乙烯响应元件结合因子)家族转录因子,还可以与相互作用,作为直接下游转录复合体的整合因子发挥功能,在水稻BR信号和植物发育中发挥重要作用[29]。下游还有一对相互拮抗的转录因子,过表达时水稻叶倾角增大,RNA干扰抑制时水稻叶倾角减小[33]。水稻非典型HLH蛋白也与叶倾角的调控有关,编码属于PRE组的非典型HLH蛋白,敲除突变体的叶片直立;是一种bHLH转录激活因子,仅在的互作蛋白LO9-177存在下与相互作用,共同调控水稻叶倾角的大小[34]。除了主要的受体BZR1信号传导途径以外,还存在G蛋白介导的BR信号传导途径。编码一个U-box家族的E3泛素连接酶,编码的异源三聚体G蛋白α亚基与定位在质膜上的共同作用以介导BR信号传导途径[35-36]。位于和的下游,编码一个含有螺旋-环-螺旋(HLH)结构域的蛋白,同时受的调控,说明是两种BR信号途径的下游正调节物,控制水稻叶片结合处的弯曲。过量表达导致叶片结合处的弯曲增大,而抑制的表达,使叶片出现直立的表型[11]。
除了BR合成相关基因及信号传导途径相关基因,与BR稳态调节相关基因如、等也会影响水稻叶倾角的大小。编码BAHD酰基转移酶,是维持油菜素内酯平衡的一个重要调控因子,以同聚体形式发挥功能,调控水稻籽粒大小和叶倾角[37]。编码一个包含B3 DNA结合结构域蛋白,通过介导油菜素内酯稳态影响水稻叶倾角,半显性突变体叶倾角增大[38]。(一种参与防御反应的转录因子)是水稻BR信号传导的重要正调节因子,作用于的下游,与级联相互作用并被其磷酸化,过表达导致叶倾角增大与突变体中的直立叶形成对比[39]。
2.2 生长素
生长素(IAA)是最早被发现的植物激素,它的生理作用十分广泛,在促进细胞分裂、伸长和分化,营养器官和生殖器官的生长,成熟和衰老的调控等方面都起作用[40]。研究发现,IAA还可以调控叶枕近轴面、远轴面细胞的生长,抑制生长素信号传导,降低生长素水平,从而导致叶倾角增加,反之则使叶倾角减小、叶片直立[41-42]。所以生长素在叶倾角大小调控中也起着关键作用,目前已报道的生长素调控水稻叶倾角基因总结如表2所示。生长素受体TIR1、生长素响应基因和以及生长素响应因子等都参与了叶倾角的调控[43],生长素信号途径调控叶倾角如图1-B所示。和的过表达使叶倾角增加,水稻生长素响应因子功能丧失的突变体叶倾角减小。生长素受体TIR1和生长素响应基因结合,会导致的泛素化和降解,并释放的转录活性[46],与ARF结合以抑制其功能,并且作为多成员家族(水稻中有25种和31种蛋白),虽然每种IAA蛋白都可以与不同的ARF相互作用,并且每种ARF蛋白都可以被不同的IAA抑制,从而发挥多样性和特异性功能,但IAA-ARF相互作用如何调节叶倾角仍不清楚[47]。生长素早期反应基因和编码吲哚-3-乙酸酰氨基合成酶,作用是催化过量的IAA与多种氨基酸结合来维持植物体内生长素的平衡,功能获得水稻突变体及过表达株系叶倾角增加,过表达株系叶倾角也增加了[48-49]。MicroRNA介导的生长素信号组分在调控水稻叶倾角方面也起着重要的作用,如靶向和,负调控剑叶的叶倾角[50]。通过靶向F-box蛋白质LC4,调节生长素介导的正常薄壁细胞扩增,从而调节叶片角度[51]。最近报道了生长素信号传导和稳态调节叶片倾向的新因子,通过与含有HIT锌指结构域的转录因子相互作用,从而协同抑制和的表达,使叶枕近轴面细胞伸长过度,突变体出现叶倾角增加的表型[52]。这些研究结果表明,生长素稳态在叶倾角控制中也起着至关重要的作用。
IAA通常与BR互作共同调控叶倾角大小,研究发现至少存在两种IAA-BR机制共同调节叶倾角大小。第一种机制是IAA参与介导的经典BR信号通路,IAA信号传导途径下游的协调并控制BR-IAA互作下游基因。的启动子含有生长素-响应元件(AuxRE),和结合并激活启动子,OsBRI1是诱导BR反应和调控叶倾角大小的BR受体[51]。编码类EMF1蛋白,与相互作用以共同调节表达[52,53]。第二种机制是IAA不依赖而在C-22羟基化BR介导的途径中起作用,如编码一个植物特有的未知结构域转录抑制因子,通过抑制与C-22羟基化和6-脱氧油菜素内酯互作的生长素信号,进而决定叶倾角[54]。在第二种机制中,IAA与C-22-羟基化BRs(BL和CS的前体)协同作用,使叶倾角增加,尽管这种C-22-羟基化的BRs介导的途径不依赖于OsBRI、BL和CS的受体,但是会受到介导的途径的抑制[55]。
2.3 赤霉素
赤霉素(Gibberellin,GA)最早是由日本植物病理学家黑泽英一等研究水稻恶苗病时发现的,具有赤霉烷骨架,最显著的生理效应就是促进细胞的伸长[56]。赤霉素主要通过与油菜素内酯互作来调控水稻叶倾角,目前已报道的赤霉素调控水稻叶倾角基因总结如表3所示。水稻中存在两条GA信号通路,一条依赖G蛋白途径,另一条不依赖G蛋白途径,这两条GA信号通路都与油菜素内酯信号互作影响叶倾角的大小[57,58](图1-C)。编码GTP 结合蛋白的α亚基,该位点发生隐性突变会导致水稻矮化,并伴有叶片直立的表型[57]。对外源GA 不敏感,据此推论G蛋白可能与GA信号传导相关。Wang等的研究表明降低了水稻叶片对24-表油菜素内酯的敏感性,与油菜素内酯(BR)的信号传导也有关系。进一步研究发现与互作并诱导下游基因增加叶倾角[35,59]。GA的另一条通路为GA-GID1-DELLA途径,GID1是一种介导水稻GA信号传导的可溶性受体,水稻DELLA蛋白SLR1以GA依赖性方式直接与GID1蛋白相互作用[58];的敲除可导致GA-GID1-DELLA途径中的抑制减少和某些BR生物合成基因的表达增加[60]。编码赤霉素刺激转录基因,基因沉默植株出现类似于植株缺乏BR引起的表型,包括初生根变短、叶片直立以及育性降低,酵母双杂交结果表明可以与BR生物合成中催化2,4-亚甲基胆固醇转变成菜油甾醇的酶DIM/DWF1相互作用,说明在转录后水平直接调节BR合成的酶从而激活BR的合成[61]。由此可见,弄清赤霉素与油菜素内酯的相互作用对研究赤霉素调控水稻叶倾角大小有很大帮助。赤霉素生物合成基因编码赤霉素3β羟化酶,油菜素内酯能够诱导该基因表达,导致具有生物活性的赤霉素GA1水平增加。突变体对油菜素内酯敏感性降低,用外源油菜素内酯处理时,基因表达上调抑制赤霉素活性,同时抑制油菜素内酯生物合成,导致植物体内激素水平降低同时生长也会受到抑制[62]。赤霉素处理能够减小叶倾角,促进油菜素内酯生物合成和信号传导,说明赤霉素能够通过一种反馈调控机制来抑制油菜素内酯生物合成和信号传导。
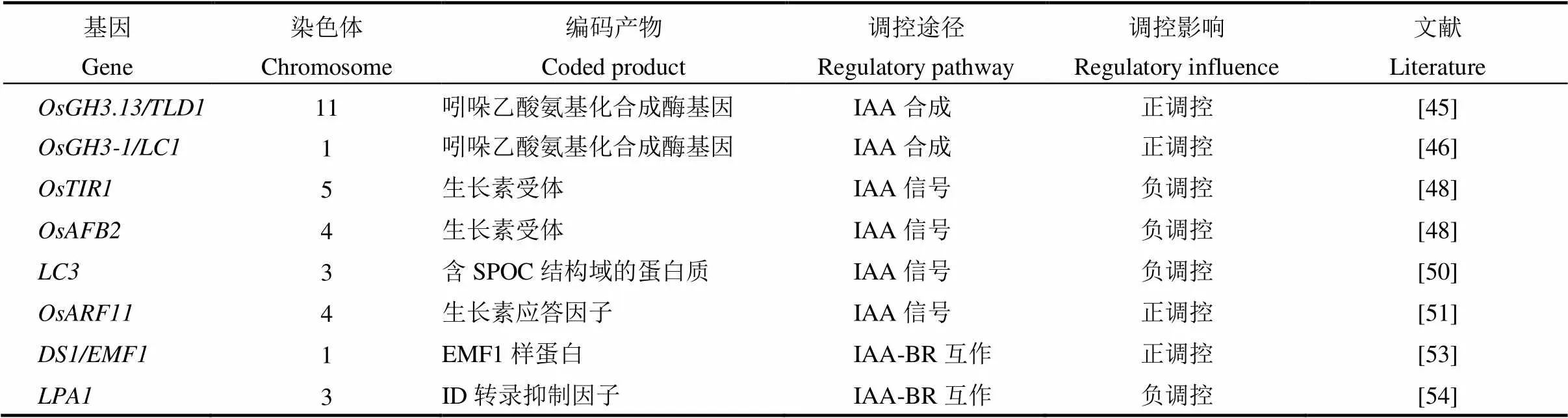
表2 生长素调控水稻叶倾角相关基因
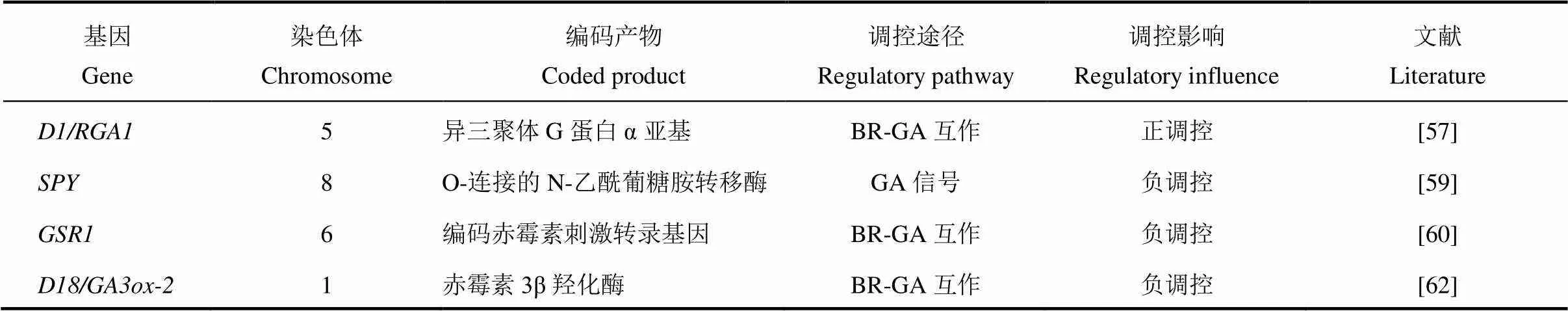
表3 赤霉素相关基因调控水稻叶倾角
2.4 其他激素
除了油菜素内酯、生长素和赤霉素之外,其他植物激素如茉莉酸、乙烯、独脚金内酯等也参与调节水稻的叶倾角。据报道,乙烯与BR互作调控水稻叶倾角[63];独脚金内酯(SLs)在幼苗期抑制叶片倾斜[64];茉莉酸甲酯处理后的水稻叶倾角减小。进一步的研究表明,MeJA通过抑制油菜素内酯的合成和信号通路,调控水稻叶倾角的大小,MeJA处理降低了BR信号和靶基因的mRNA水平,与其野生型对应物相比,突变体的叶枕对MeJA不太敏感,并且氯化锂诱导的GSK3样激酶(BR信号传导的负调节因子)失活,部分地恢复了MeJA导致的叶倾角减小[65]。编码茉莉酸氨基酸合成酶,过表达株系叶倾角增大,的表达受调控,在调节叶倾角方面与其他作用冗余[53]。因此,MeJA通过与油菜素内酯和生长素等共同作用,来调控水稻叶倾角的大小。
3 其他因素对叶倾角的影响
水稻叶倾角大小主要受到激素的调控,同时机械组织强度和向地性等也会影响叶倾角的大小,如等参与叶倾角大小的调控(表4)。编码丝裂原活化蛋白激酶,具有Ser/Thr 激酶活性的功能激酶,在叶枕维管束中表达,与一个核蛋白家族基因互作调节叶枕机械组织的形成;突变体叶倾角的增加是由于叶枕维管束形成和细胞壁组分的异常,这不同于油菜素内酯相关突变体[66]。编码纤维素合酶催化亚基,参与纤维素的合成;突变体脆秆和脆叶弯曲时易破,叶片和茎下垂[67]。编码一个类纤维素合酶OsCSLD4,是细胞壁多糖合成所必需的,卷叶矮秆突变体叶倾角增加[68]。披叶基因,属于基因家族,位点发生隐性突变的4个突变体,叶片均不能形成正常的中脉,表现出披叶的特性[69]。是叶枕、叶舌和耳廓形成的重要转录因子,参与泡状细胞的分裂与分化以及叶片发育时的侧向生长,RNA干涉植株矮化,形成褶皱叶片,伴随叶倾角增加[70,71]。通过控制分蘖节和叶枕的近轴面细胞生长来调控分蘖角度和叶倾角,也影响地上部的向重力性反应[72]。通过调节生长素的极性运输来调控水稻地上部的向重性,影响水稻分蘖角度和叶倾角的大小[73]。
除此之外,其他因素如根系分布、叶片大小、生长环境等也会对水稻叶倾角大小有一定的影响。凌启鸿等[74]在研究水稻根系分布与叶倾角关系中发现,水稻叶倾角的大小与水稻根的分布呈几何学相关,即根系分布较深且多纵向、少横向时叶倾角较小,叶片更容易保持直立的状态;根系分布较浅且多横向时叶倾角较大,叶片趋向于披垂。叶倾角的大小同时还受叶片大小的影响,较大的叶片更易披垂,叶倾角更大;较小的叶片更易直立,叶倾角更小。水稻生长的环境因素如温度、光照、纬度、养分等也会对水稻叶倾角有一定的影响。如籼稻多分布在低纬度或低海拔地区,寡照气候,剑叶叶倾角小;粳稻多分布在高纬度或高海拔地区,剑叶叶倾角偏大,研究数据表明粳稻亚群的剑叶叶倾角变异及平均值均大于籼稻亚群[75-76]。土壤中的氮和磷含量对水稻叶倾角的大小也有影响。Luo等[77]在研究水稻剑叶倾角与氮素利用效率的关系中发现,剑叶叶倾角随施氮量的增加而显著增加,剑叶角度与氮利用效率、氮收获指数、土壤氮生产力和植株氮生产力呈显著负相关。在无机磷酸盐不足的土壤中生长的水稻,叶枕的远轴侧和近轴侧的细胞很短,且叶枕和叶倾角变小[78]。Ruan等[79]发现磷缺乏诱导的蛋白质SPX1和SPX2在叶倾角的调控中起负面作用,SPX1与RLI1蛋白互作,阻止与下游基因和的启动子结合。所以,和可以通过形成一个水稻外源磷的响应来调节叶倾角大小。
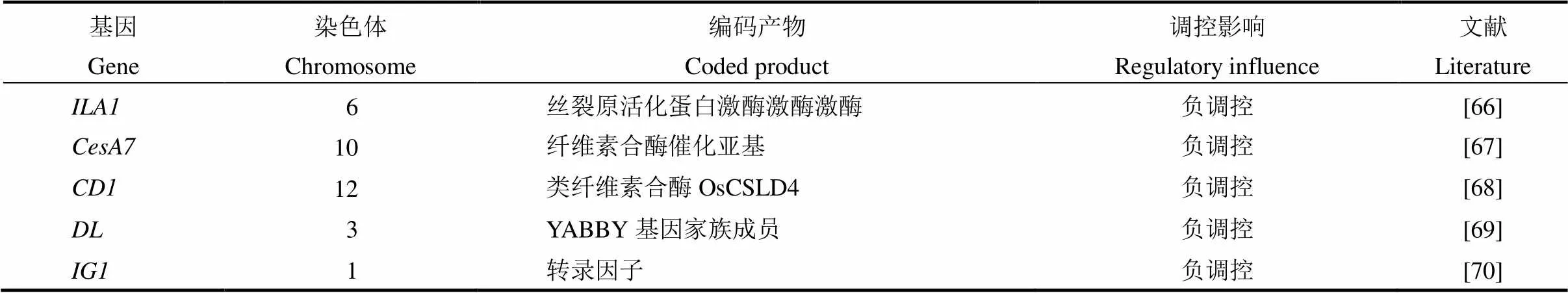
表4 其他因素调控水稻叶倾角相关基因
4 水稻叶倾角在理想株型中的应用
己有研究表明,叶倾角对于水稻群体的受光面积具有重要的影响,与产量密切相关[6,80]。很多育种专家对水稻理想株型叶片的定义均包括叶片的直立性,水稻的上部3叶(剑叶、倒2叶、倒3叶)是构成水稻后期冠层结构绿色面积的主要部分,这3片叶的叶倾角大小对于水稻籽粒是否饱满、能否高产具有十分重要的影响。通过塑造理想的上3部叶片的叶倾角,调节水稻个体和群体的几何构型和空间排列方式,进而改善群体结构和受光姿势,提高群体最适叶面积指数,协调源库关系,增加水稻抽穗后物质积累量,最终增加稻谷产量。在育种研究中,减小水稻叶倾角不但能够增大叶片的光合面积和提高光能利用率,并且不利于害虫的着落,从而有效防治病虫害[77]。由于大部分叶倾角调控基因都是多效的,在减小叶倾角的同时也会伴随着其他农艺性状的改变,但还是有很多基因在育种中成功地得到了应用。例如,与野生型植株相比,通过部分抑制内源,以高密度种植的直立叶的转基因植株使籽粒产量比预估的增加30%[81]。抑制表达引起水稻对BR敏感性下降,得到直立的叶片,且千粒重和生育力正常。
在水稻理想株型研究中发现,虽然小的叶倾角有有利的一面,但也有不利的一面,剑叶的叶倾角过小,叶片直立不利于田间不育系辅助授粉,影响杂交水稻制种的产量。培育大剑叶角(不小于90°)的不育系,既可以免去人工割叶、减少劳动力,又可以加快杂交水稻制种机械化进程[8]。研究水稻叶倾角,可为不同水稻株型、不同水稻叶片形态理想株型提供理论参考。对于大部分粳稻品种,都含有和等控制较直立叶片的单倍型和控制较大剑叶倾角的单倍型,因此可以通过培育位点具有控制大剑叶夹角的单倍型来改良品种;对于多数籼稻品种,都含有控制小剑叶倾角的的单倍型,目前可以优先考虑利用这个单倍型培育具有直立叶片的籼稻品种[76]。随着对水稻叶倾角分子机制研究的深入,越来越多的相关基因被克隆,各种激素调控机制逐步明确,对水稻理想株型的选择和塑造都有着十分重要的意义。
5 总结与展望
由上述可知,叶倾角的大小不仅受到基因水平的调控,激素水平在调控水稻叶倾角上也起着非常重要的作用,由于油菜素内酯、生长素、赤霉素、茉莉酸等各激素的合成及信号转导途径存在促进或拮抗作用,因此,在调控水稻叶倾角的大小时,不只是简单地通过一个激素起作用,通常是两个或两个以上的激素共同调节。通过调控油菜素内酯、生长素、赤霉素和茉莉酸等来改变水稻叶倾角的大小,得到理想株型,是提高水稻产量的可行方法之一。同时,其他因素如机械组织强度和向地性、根系分布、叶片大小、生长环境等对水稻叶倾角的调控也是不容忽略的。目前对于水稻叶倾角相关的研究还不够深入,叶倾角分子机制调控是一个十分复杂的过程,需要多层次、多角度的协调互作。
随着生物学技术水平的进步和对叶倾角分子机制的研究的深入,越来越多与叶倾角相关的基因被克隆,同时各种激素调控机制逐步明确,对水稻叶倾角的分子机制的研究也会越来越透彻。水稻理想株型的塑造并不是只针对某一个表型,对叶片的要求也不只是叶倾角小而叶片直立,还有叶宽、叶长、叶片卷曲度等,另外,穗、根、茎等的选择和塑造是在水稻理想株型时需要考虑的因素。对于叶倾角的分子机制还需要不断的探索研究,以期为未来研究培育出超级水稻株型提供一定的理论基础。
[1] 程式华, 陈温福, 谢华安, 武小金. 中国超级稻育种. 北京: 科学出版社, 2010.
Chen S H, Chen W F, Xie H A, Wu X J. Chinese Super Rice Breeding. Beijing: Science Press, 2010. (in Chinese)
[2] 吴比, 胡伟, 邢永忠. 中国水稻遗传育种历程与展望. 遗传, 2018, 40(10): 841-857.
Wu B, Hu W, Xing Y Z. History and prospect of rice genetics and breeding in China., 2018, 40(10): 841-857. (in Chinese with English abstract)
[3] Khush G S. What it will take to feed 5.0 billion rice consumers in 2030., 2005, 59(1): 1-6.
[4] Yang S R, Chen W F, Zhang L B. Trends in breeding rice forideotype., 1988.
[5] 袁隆平. 杂交水稻超高产育种. 杂交水稻, 1997(6): 1-6.
Yuan L P. Super high yield breeding of hybrid rice., 1997(6): 1-6. (in Chinese with English abstract)
[6] 徐静, 王莉, 钱前, 张光恒. 水稻叶片形态建成分子调控机制研究进展. 作物学报, 2013, 39(5): 767-774.
Xu J, Wang L, Qian Q, Zhang G H. Research advance in molecule regulation mechanism of leaf morphogenesis in rice (L.)., 2013, 39(5): 767-774. (in Chinese with English abstract)
[7] Mantilla-Perez M B, Salas Fernandez M G. Differential manipulation of leaf angle throughout the canopy: Current status and prospects., 2017, 68(21-22): 5699-5717.
[8] 朱长丰, 梁利君, 曾思远, 李天伟, 董冠杉, 洪德林. 水稻剑叶角度位点的精细定位. 中国水稻科学, 2016, 30(1): 27-34.
Zhu C F, Liang L J, Zeng S Y, Li T W, Dong G S, Hong D L. Fine mapping offor flag leaf angle in rice., 2016, 30(1): 27-34.(in Chinese with English abstract)
[9] 周行岳, 吴向东, 王奉斌, 王容. 高产水稻品种株型模式探讨. 新疆农垦科技, 1999(4): 30-31.
Zhou X Y, Wu X D, Wang F B, Wang R. Discussion on plant type pattern of high yield rice varieties., 1999(4): 30-31. (in Chinese with English abstract)
[10] Duan K, Li L, Hu P, Xu S P, Xu Z H, Xue H W. A brassinolide-suppressed rice MADS-box transcription factor,, has a negative regulatory role in BR signaling., 2010, 47(4): 519-531.
[11] Tanaka A, Nakagawa H, Tomita C, Shimatani Z, Ohtake M, Nomura T, Jiang C J, Dubouzet J G, Kikuchi S, Sekimoto H, Kamakura T, Mori M., encoding a helix-loop-helix protein, is a novel gene involved in brassinosteroid signaling and controls bending of the lamina joint in rice., 2009, 151(2): 669-680.
[12] Sun S Y, Chen D H, Li X M, Qiao S A, Li C X, Shen H Y, Wang X E. Brassinosteroid signaling regulates leaf erectness invia the control of a specific U-type cyclin and cell proliferation., 2015, 34(2): 220-228.
[13] Zhao S Q, Hu J, Guo L B, Qian Q, Xue H W. Rice leaf inclination2, a VIN3-like protein, regulates leaf angle through modulating cell division of the collar., 2010, 20(8): 935-947.
[14] Luo X Y, Zheng J S, Huang Y M, Huang H C, Wang L G, Fang X J. Phytohormones signaling and crosstalk regulating leaf angle in rice., 2016, 35(12): 2423-2433.
[15] Clouse S D, Sasse J M. BRASSINOSTEROIDS: Essential regulators of plant growth and development., 1998, 49: 427-451.
[16] Fabregas N, Cano-delgado A I. Turning on the microscope turret: A new view for the study of brassinosteroid signaling in plant development., 2014, 151(2): 172-183.
[17] Fujioka S, Yokota T. Biosynthesis and metabolism of brassinosteroids., 2003, 54: 137-64.
[18] Wada K, Marumo S, Abe H, Morishita T, Nakamura K, Uchiyama M, Mori M. A rice lamina inclination test: A micro-quantitative bioassay for brassinosteroids., 1984, 48(3): 719-726.
[19] Choe S. Brassinosteroid biosynthesis and inactivation., 2010, 126(4): 539-548.
[20] Hong Z, Ueguchi-Tanaka M, Umemura K, Uozu S, Fujioka S, Ashikari M, Kitano H, Matsuoka M. A rice brassinosteroid-deficient mutant, ebisu dwarf (), is caused by a loss of function of a new member of cytochrome P450., 2004, 15(12): 2900-2910.
[21] Zhi H, Miyako U T, Shozo F, Suguru T, Shigeo Y, Yasuko H, Motoyuki A, Hidemi K, Makoto M. The Rice brassinosteroid-deficientmutant, defective in the rice homolog of, is rescued by the endogenously accumulated alternative bioactive brassinosteroid, dolichosterone., 2005, 17(8): 2243-2254.
[22] Tanabe S, Ashikari M, Fujioka S, Takatsuto S, Yoshida S, Yano M, Yoshimura A, Kitano H, Matsuoka M, Fujisawa Y, Kato H, Iwasaki Y. A novel cytochrome P450 is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant,, with reduced seed length., 2005, 17(3): 776-790.
[23] Sakamoto T, Morinaka Y, Ohnishi T, Sunohara H, Fujioka S, Ueguchi-Tanaka M, Mizutani M, Sakata K, Takatsuto S, Yoshida S, Tanaka H, Kitano H, Matsuoka M. Erect leaves caused by brassinosteroid deficiency increase biomass production and grain yield in rice., 2006, 24(1): 105-109.
[24] Yamamuro C, Ihara Y, Wu X, Noguchi T, Fujioka S, Takatsuto S, Ashikari M, Kitano H, Matsuoka M. Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint., 2000, 12(9): 1591-1606.
[25] Li D, Wang L, Wang M, Xu Y Y, Luo W, Liu Y J, Xu Z H, Li J, Chong K. Engineeringgene as a molecular tool to improve rice architecture for high yield., 2009, 7(8): 791-806.
[26] Zhang C, Xu Y, Guo S, Zhu J, Huan Q, Liu H, Wang L, Luo G, Wang X, Chong K. Dynamics of brassinosteroid response modulated by negative regulatorin rice., 2012, 8(4): e1002686.
[27] Tong H, Liu L, Jin Y, Du L, Yin Y, Qian Q, Zhu L, Chu C.acts as a direct downstream target of a GSK3/SHAGGY-like kinaseto mediate brassinosteroid responses in rice., 2012, 24(6): 2562-2577.
[28] Wang L, Xu Y, Zhang C, Ma Q, Joo S H, Kim S K, Xu Z, Chong K., a novel CCCH-type zinc finger protein with transcription activation, mediates rice architecture via brassinosteroids signaling., 2008, 3(10): e3521.
[29] Qiao S L, Sun S Y, Wang L L, Wu Z H, Li C X, Li X M, Wang T, Leng L N, Tian W S, Lu T G, Wang X E. Thetranscription factor functions withto regulate brassinosteroid signaling and rice architecture,, 2017, 29(2): 292-309.
[30] Zhang G, Song X, Guo H, Wu Y, Chen X, Fang R. A small G protein as a novel component of the rice brassinosteroid signal transduction., 2016, 9(9): 1260-1271.
[31] Zhou X, Wang J, Peng C, Zhu X, Yin J, Li W, He M, Wang J, Chern M, Ronald P, Chen X. Four receptor-like cytoplasmic kinases regulate development and immunity in rice., 2016, 39(6): 1381-1392.
[32] Bai M Y, Zhang L Y, Gampala S S, Zhu S W, Song W Y, Chong K, Wang Z Y. Functions ofand 14-3-3 proteins in brassinosteroid signaling in rice., 2007, 104(34): 13839-13844.
[33] Zhang L Y, Bai M Y, Wu J, Zhu J Y, Wang H, Zhang Z, Wang W, Sun Y, Zhao J, Fujioka S, Lin W H, Chong K, Lu T, Wang Z Y. Antagonistictranscription factors mediate brassinosteroid regulation of cell elongation and plant development in rice and., 2009, 21(12): 3767-3780.
[34] Jang S, An G, Li H Y. Rice leaf angle and grain size are affected by thetranscriptional activator complex., 2017, 173(1): 688-702.
[35] Wang L, Xu Y Y, Ma Q B. Heterotrimeric G protein α subunit is involved in rice brassinosteroid response., 2006, 16(12): 916-922.
[36] Hu X, Qian Q, Xu T, Zhang Y, Dong G, Gao T, Xie Q, Xue Y. The U-box E3 ubiquitin ligasefunctions with a heterotrimeric G alpha subunit to regulate brassinosteroid-mediated growth in rice., 2013, 9(3): e1003391.
[37] Feng Z, Wu C, Wang C, Roh J, Zhang L, Chen J, Zhang S, Zhang H, Yang C, Hu J, You X, Liu X, Yang X, Guo X, Zhang X, Wu F, Terzaghi W, Kim S K, Jiang L, Wan J.controls grain size and leaf angle by modulating brassinosteroid homeostasis in rice., 2016, 67(14): 4241-4253.
[38] Zhao X Q, Sun J, Cao X F, Song X W. Epigenetic mutation ofaffects leaf angle and seed size in rice., 2015, 169(3): 2118-2128.
[39] Tian X, Li X, Zhou W, Ren Y, Wang Z, Liu Z, Tang J, Tong H, Fang J, Bu Q. Transcription factorpositively regulates brassinosteroid signaling and plant architecture., 2017, 175(3): 1337-1349.
[40] Davies P J. Plant hormones: Physiology, biochemistry and molecular biology., 1996, 66(3): 267-270.
[41] Li L C, Kang D M, Chen Z L, Qu L J. Hormonal regulation of leaf morphogenesis in Arabidopsis., 2010, 49(1): 75-80.
[42] Song Y, You J, Xiong L. Characterization ofgene, a member of ricefamily involved in auxin and brassinosteroid hormone responses and plant morphogenesis., 2009, 70(3): 297-309.
[43] Xia K F, Wang R, Ou X J, Fang Z M, Tian C J, Duan J, Wang Y Q, Zhang M Y.anddown regulation viaoverexpression leads to more tillers, early flowering and less tolerance to salt and drought in rice., 2012, 7(1): e30039.
[44] Peer W A. From perception to attenuation: Auxin signalling and responses., 2013, 16(5): 561-568.
[45] Luo J, Zhou J J, Zhang J Z.gene family in plants: Molecular structure, regulation, and function., 2018, 19(1): 259-276.
[46] Zhao S Q, Xiang J J, Xue H W. Studies on the rice LEAF INCLINATION1 (), an IAA-amido synthetase, reveal the effects of auxin in leaf inclination control., 2013, 6(1): 174-187.
[47] Du H, Wu N, Fu J, Wang S, Li X, Xiao J, Xiong L. Afamily member,, modulates auxin and abscisic acid levels and differentially affects drought and cold tolerance in rice., 2012, 63(18): 6467-6480.
[48] Bian H, Xie Y, Guo F, Han N, Ma S, Zeng Z, Wang J, Yang Y, Zhu M. Distinctive expression patterns and roles of thehomolog module in regulating flag leaf inclination and primary and crown root growth in rice ()., 2012, 196(1): 149-161.
[49] Qu L, Lin L B, Xue H W. Rice miR394 suppresses leaf inclination through targeting an F-box gene,., 2019, 61(4): 406-416.
[50] Chen S H, Zhou L J. SPOC domain-containing protein Leaf inclination3 interacts withto regulate rice leaf inclination through auxin signaling,, 2018, 14(11): e1007829.
[51] Zhang S, Wang S, Xu Y, Yu C, Shen C, Qian Q, Geisler M, Jiang De A, Qi Y. The auxin response factor,, controls rice leaf angles through positively regulatingand., 2015, 38(4): 638-654.
[52] Sakamoto T, Morinaka Y, Inukai Y, Kitano H, Fujioka S. Auxin signal transcription factor regulates expression of the brassinosteroid receptor gene in rice., 2013, 73(4): 676-688.
[53] Liu X, Yang C Y, Miao R, Zhou C L, Cao P H, Lan J, Zhu X J, Mou C L, Huang Y S, Liu S J, Tian Y L, Nguyen T L, Jiang L, Wan J M.interacts withto control rice architecture by regulation of brassinosteroid signaling., 2018, 11(1): 46-58.
[54] Liu J M, Park S J, Huang J, Lee E J, Xuan Y H, Je B I, Kumar V, Priatama R A, Raj K V, Kim S H, Min M K, Cho J H, Kim T H, Chandran A K, Jung K H, Takatsuto S, Fujioka S, Han C D. Loose Plant Architecture1 () determines lamina joint bending by suppressing auxin signaling that interacts with C-22-hydroxylated and 6-deoxo brassinosteroids in rice., 2016, 67(6): 1883-1895.
[55] Nakamura A, Fujioka S, Takatsuto S, Tsujimoto M, Kitano H, Yoshida S, Asami T, Nakano T. Involvement of C-22-hydroxylated brassinosteroids in auxin-induced lamina joint bending in rice., 2009, 50(9): 1627-1635.
[56] Hedden P, Sponsel V. A century of gibberellin research., 2015, 34(4): 740-760.
[57] Ferrero-Serrano A, Assmann S M. The a-subunit of the rice heterotrimeric G protein,, regulates drought tolerance during the vegetative phase in the dwarf rice mutant., 2016, 67(11): 3433-3443.
[58] Ueguchi-Tanaka M, Nakajima M, Katoh E, Ohmiya H, Asano K, Saji S, Hongyu X, Ashikari M, Kitano H, Yamaguchi I, Matsuoka M. Molecular interactions of a soluble gibberellin receptor,, with a rice DELLA protein,, and gibberellin., 2007, 19(7): 2140-2155.
[59] Ueguchi-Tanaka M, Fujisawa Y, Ashikari M, Iwasaki Y, Kitano H, Matsuoka M. Rice dwarf mutant, which is defective in the alpha subunit of the heterotrimeric G protein, affects gibberellin signal transduction., 2000, 97(21): 11 638-11 643.
[60] Shimada A, Ueguchi-Tanaka M, Sakamoto T, Fujioka S, Takatsuto S, Yoshida S, Sazuka T, Ashikari M, Matsuoka M. The ricegene functions as a negative regulator of gibberellin signaling by controlling the suppressive function of the DELLA protein,, and modulating brassinosteroid synthesis., 2006, 48(3): 390-402.
[61] Wang L, Wang Z, Xu Y, Joo S H, Kim S K, Xue Z, Xu Z, Wang Z, Chong K.is involved in crosstalk between gibberellins and brassinosteroids in rice., 2009, 57(3): 498-510.
[62] Tong H, Xiao Y, Liu D, Gao S, Liu L, Yin Y, Jin Y, Qian Q, Chu C. Brassinosteroid regulates cell elongation by modulating gibberellin metabolism in rice., 2014, 26(11): 4376-4393.
[63] Cao H, Chen S. Brassinosteroid-induced rice lamina joint inclination and its relation to indole-3-acetic acid and ethylene., 1995, 16(2): 189-196.
[64] Li X, Sun S, Li C, Qiao S, Wang T, Leng L, Shen H, Wang X. The Strigolactone-related mutants have enhanced lamina joint inclination phenotype at the seedling stage., 2014, 41(11): 605-608.
[65] Gan L, Wu H, Wu D, Zhang Z, Guo Z, Yang N, Xia K, Zhou X, Oh K, Matsuoka M, Ng D, Zhu C. Methyl jasmonate inhibits lamina joint inclination by repressing brassinosteroid biosynthesis and signaling in rice., 2015, 241: 238-245.
[66] Ning J, Zhang B, Wang N, Zhou Y, Xiong L., a-like MAPKKK that interacts with a nuclear protein family, regulates mechanical tissue formation in the lamina joint of rice., 2011, 23(12): 4334-4347.
[67] Wang D, Qin Y, Fang J, Yuan S, Peng L, Zhao J, Li X. A missense mutation in the Zinc finger domain ofdeleteriously affects cellulose biosynthesis and plant growth in rice., 2016, 11(4): e0153993.
[68] Luan W, Liu Y, Zhang F, Song Y, Wang Z, Peng Y, Sun Z.encodes a putative member of the cellulose synthase-like D sub-family and is essential for rice plant architecture and growth., 2011, 9(4): 513-524.
[69] Ohmori Y, Toriba T, Nakamura H, Ichikawa H, Hirano H Y. Temporal and spatial regulation ofgene expression that promotes midrib formation in rice., 2011, 65(1): 77-86.
[70] Zhang J, Tang W, Huang Y, Niu X, Zhao Y, Han Y, Liu Y. Down-regulation of a-like gene,, leads to occurrence of unusual double ovules and developmental abnormalities of various floral organs and megagametophyte in rice., 2015, 66(1): 99-112.
[71] Lee J, Park J J, Kim S L, Yim J, An G. Mutations in the rice liguleless gene result in a complete loss of the auricle, ligule, and laminar joint., 2007, 65(4): 487-499.
[72] Wu X, Tang D, Li M, Wang K, Cheng Z. Loose Plant Architecture1, an INDETERMINATE DOMAIN protein involved in shoot gravitropism, regulates plant architecture in rice., 2013, 161(1): 317-329.
[73] Li P, Wang Y, Qian Q, Fu Z, Wang M, Zeng D, Li B, Wang X, Li J.controls rice shoot gravitropism through regulating polar auxin transport., 2007, 17(5): 402-410.
[74] 凌启鸿, 陆卫平. 水稻根系分布与叶角关系的研究初报. 作物学报, 1989(2): 123-131.
Ling Q H, Lu W P. Preliminary report on the relationship between rice root distribution and leaf angle., 1989(2): 123-131. (in Chinese with English abstract)
[75] 王彤, 阙补超, 夏明, 郑英杰, 于亚辉, 王莹, 李林蔚, 陈广红, 王绍林. 水稻产量和品质的研究进展. 北方水稻, 2017, 47(2): 51-55.
Wang T, Que B C, Xia M, Zheng Y J, Yu Y H, Wang Y, Li L W, Chen G H, Wang S L. Research progress in rice yield and quality., 2017, 47(2): 51-55. (in Chinese with English abstract)
[76] 董海娇. 基于全基因组关联分析的水稻分蘖角度和剑叶夹角的遗传基础解析. 武汉: 华中农业大学, 2017.
Dong H J. Genetic basis analysis of rice tiller angle and flag leaf angle based on genome-wide association analysis. Wuhan: Huazhong Agricultural University, 2017. (in Chinese with English abstract)
[77] Luo Y F, Ma X M, Cheng J F. The relationship between flag leaf angle of various rice germplasms and their nitrogen nutrition efficiencies., 2014, 30(18): 29-34.
[78] Mach J. So inclined: Phosphate status and leaf angle in rice., 2018, 30(4): 743-744.
[79] Ruan W, Guo M, Xu L. Anmodule regulates leaf inclination in response to phosphate availability in rice.2018, 30(4): 853-870.
[80] 左科生, 李育, 钟平安. 水稻理想株型与超高产育种的研究进展. 江西农业学报, 2003, 15(1): 37-42.
Zuo K S, Li Y, Zhong P A. Research progress on ideal plant type and super high yield breeding of rice., 2003, 15(1): 37-42. (in Chinese with English abstract)
[81] Morinaka Y, Sakamoto T, Inukai Y, Agetsuma M, Kitano H, Ashikari M, Matsuoka M. Morphological alteration caused by brassinosteroid insensitivity increases the biomass and grain production of rice., 2006, 141(3): 924-931.
Advances in Molecular Mechanisms of Rice Leaf Inclination and Its Application in Breeding
HU Juan1, LIN Han1, XU Na1, JIAO Ran1, DAI Zhijun1, LU Caolin2, RAO Yuchun1,*, WANG Yuexing2,*
(,,,;,,,; Corresponding author,:;)
Rice leaf inclination refers to the degree of bending between leaves and stems, which is one of the most important factors affecting plant architecture and grain yield. Leaf inclination affects leaf photosynthesis rate. Upright leaves are one of the factors of the ideal plant type of rice. Leaf inclination is regulated by a variety of genes, and is the result of interactions between various plant hormones such as brassinosteroids, auxin, gibberellin, and jasmonic acid. Other factors such as root distribution, leaf size, and growth environment also have a certain impact on the leaf inclination. Based on the research progress of rice leaf inclination, this review summarizes and elaborates on the molecular mechanism of rice leaf inclination and the application of leaf inclination in breeding from the aspects of lamina joint development, hormone levels and other factors, so as to provide reference for ideal plant type breeding and lay a theoretical foundation for further improvement of rice yield.
rice; leaf inclination; molecular mechanism; breeding application
Q944.56; S511.032
A
1001-7216(2019)05-0391-10
10.16819/j.1001-7216.2019.9029
2019-03-18;
2019-05-17。
国家重大科技专项(2016ZX08009003-003-008);浙江省粮食新品种选育专项(2016C02050-1)。
