基于16S和COⅠ基因探讨岩扇贝在扇贝科中的分类地位
2019-09-17曹善茂朱丽洁聂鸿涛
曹善茂 朱丽洁 聂鸿涛
摘要:采用PCR扩增和序列测定等技术,对岩扇贝(Crassadoma gigantea)线粒体DNA 16S rRNA和CO Ⅰ基因片段进行初步研究,得到16S rRNA基因片段的大小在613.0~634.0 bp之间,A、T(U)、G、C的平均含量分別为26.5%、29.7%、24.5%、19.3%;CO Ⅰ基因片段的大小为660 bp,碱基A、T、G、C的平均含量分别为17.2%、40.3%、27.2%、15.3%。16S基因在岩扇贝中偏好使用GUU、UUG、AUU、ACG、UAU、CAA、GAG、UUU、UCU、GAU、GGU、GAG、AGG和GGA等25个密码子。COⅠ系统进化树表明,与岩扇贝亲缘关系最近的是柿孔扇贝(Azumapecten farreri),其次是冰岛扇贝(Chlamys islandica)。16S系统进化树亲缘关系由近到远依次是北美扇贝(Patinopecten caurinus)、虾夷扇贝(Mizuhopecten yessoensis)、Chlamys islandica。
关键词:岩扇贝;CO Ⅰ基因;16S rRNA;密码子偏好性;系统进化树分析
中图分类号: S917.4 文献标志码: A 文章编号:1002-1302(2019)07-0028-04
岩扇贝(Crassadoma gigantea)隶属于软体动物门、瓣鳃纲、珍珠贝目、扇贝科。原产于北美洲太平洋沿岸海域,广泛分布于美国的阿拉斯加,加利福尼亚半岛以及墨西哥湾附近。该贝具有闭壳肌大、肉质鲜美、风味独特、生长速度快、对环境适应能力强等优点,2013年大连海洋大学科研人员从加拿大温哥华岛引进岩扇贝成贝,在辽宁省沿海各地进行人工育苗和人工养殖,并对其进行了人工育苗技术和幼贝摄食生理等研究[1-3]。国外学者对岩扇贝的营养成分、口味、冷藏肉质的稳定性、野生种群的生长速率、排精产卵机制、幼贝的饵料配比、附着生理、胚胎发育等方面进行了研究[4-9]。日常岩扇贝通过岩扇贝壳型、颜色等形态特征进行分类,比较而言应用分子生物学的分析方法对岩扇贝的分类及鉴定较少。Bernard建立了包含必须以固着而生的岩扇贝的岩扇贝属(Crassadoma)[10]。Waller扩展了岩扇贝属的范围,包含其他固着和非固着的Hinnites种,并创造了包括Caribachlamys属在内的Crassadomini[11]。可见岩扇贝在扇贝科下的亲缘关系并不明确,Saavedra等研究了岩扇贝与太平洋部分扇贝和加勒比海扇贝的进化关系[12]。本研究在其基础上增加国内经济贝类,如栉孔扇贝、虾夷扇贝等,应用DNA条形码技术进行进一步的研究。DNA条形码是利用足够变异的标准化短基因片段构建物种的鉴别体系,具有对物种进行快速、准确鉴定的新生物身份识别的优势[13-15]。本研究采用PCR扩增和序列测定技术,对岩扇贝线粒体DNA 16S rRNA和CO Ⅰ基因片段进行初步研究,进一步证实岩扇贝在扇贝科中的分类地位及亲缘关系。
1 材料与方法
1.1 试验材料
岩扇贝于2016年11月取自辽宁省旅顺河口养殖基地,鉴定后活体解剖取扇贝闭壳肌于液氮冷冻后转-80 ℃超低温冰箱保存备用。
1.2 方法
1.2.1 基因组DNA提取和检测 随机选取岩扇贝2个,取大约30 mg闭壳肌组织,尽量剪碎,用DNA提取试剂盒提取基因组DNA,并溶解于100 μL Tris-EDTA缓冲buffer(TE溶液)中,用紫外分光光度计测定其浓度和纯度,然后将基因组DNA稀释至50 ng/μL,4 ℃ 下保存备用。
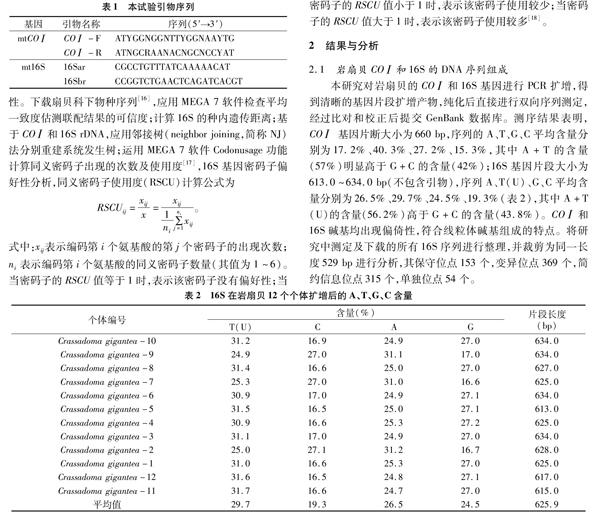
1.2.2 PCR扩增及测序 本试验使用CO Ⅰ和16S引物序列进行PCR扩增(表1),所有PCR反应均采用预混合酶试剂(premix),配制 10 μL 体系,在PTC-100型PCR仪上进行反应。PCR反应程序为94 ℃预变性3 min;94 ℃变性30 s,16S变性1 min,CO Ⅰ和16S分别48 ℃退火1 min,72 ℃延伸 1 min,共运行35个循环;最后1个循环结束后72 ℃再延伸 5 min。PCR产物用含有溴化乙锭的1%琼脂糖凝胶电泳检测,凝胶成像系统观察、照相。用UNIQ-10柱式PCR产物纯化试剂盒[生工生物工程(上海)股份有限公司生产]纯化后,进行双向测序。
1.2.4 数据处理 本试验选取2个岩扇贝个体进行测序,所获原始序列首先与其对应峰图对比检查,以确认序列质量;每个个体测得正反向序列并用BioEdit软件进行拼接,结合人工校正;在NCBI数据库中进行Blast比对分析,确定序列准确性。下载扇贝科下物种序列[16],应用MEGA 7软件检查平均一致度估测联配结果的可信度;计算16S的种内遗传距离;基于CO Ⅰ和16S rDNA,应用邻接树(neighbor joining,简称NJ)法分别重建系统发生树;运用MEGA 7软件Codonusage功能计算同义密码子出现的次数及使用度[17],16S基因密码子偏好性分析,同义密码子使用度(RSCU)计算公式为
RSCUij=xijx=xij1ni∑nij=1xij。
式中:xij表示编码第i个氨基酸的第j个密码子的出现次数;ni表示编码第i个氨基酸的同义密码子数量(其值为1~6)。当密码子的RSCU值等于1时,表示该密码子没有偏好性;当密码子的RSCU值小于1时,表示该密码子使用较少;当密码子的RSCU值大于1时,表示该密码子使用较多[18]。
2 结果与分析
2.1 岩扇贝CO Ⅰ和16S的DNA序列组成
本研究对岩扇贝的CO Ⅰ和16S基因进行PCR扩增,得到清晰的基因片段扩增产物,纯化后直接进行双向序列测定,经过比对和校正后提交GenBank数据库。测序结果表明,CO Ⅰ 基因片断大小为660 bp,序列的A、T、G、C平均含量分别为17.2%、40.3%、27.2%、15.3%,其中A+T的含量(57%)明显高于 G+C的含量(42%);16S基因片段大小为613.0~634.0 bp(不包含引物),序列A、T(U)、G、C平均含量分别为26.5%、297%、24.5%、19.3%(表2),其中A+T(U)的含量(56.2%)高于G+C的含量(43.8%)。CO Ⅰ和16S碱基均出现偏倚性,符合线粒体碱基组成的特点。将研究中测定及下载的所有16S序列进行整理,并裁剪为同一长度529 bp进行分析,其保守位点153个,变异位点369个,简约信息位点315个,单独位点54个。
2.2 系统发育树的物种鉴定
本试验选取珍珠贝科马氏珠母贝、牡蛎科长牡蛎、莺蛤科白斑珍珠蛤作为外群,在CO Ⅰ和16S进化树中C. gigantea单独聚为1支,马氏珠母贝(Pinctada martensi),白斑珍珠蛤(Pinctada maculata)聚為1支。CO Ⅰ进化树的p-distance<08,16S序列的Jukes-Cantor分析值为0.246,这2个值分别说明CO Ⅰ和16S所选序列适合构建NJ树。CO Ⅰ的NJ树表明,C. gigantea进化依次接近于栉孔扇贝(Azumapecten farreri),冰岛扇贝(Chlamys islandica),北美扇贝(Patinopecten caurinus),虾夷扇贝(Mizuhopecten yessoensis),其中后三者聚为1支(图1)。16S的NJ树表明,岩扇贝5个序列形成具有较高支持度的单分支且依次接近于北美扇贝(Patinopecten caurinus)、虾夷扇贝(Mizuhopecten yessoensis)、Chlamys islandica(图2)。扇贝科的5个属,其中类栉孔扇贝属的华贵栉孔扇贝(Mimachlamys nobilis)单独聚为1支;海湾扇贝属的海湾扇贝(Argopecten irradians)、紫扇贝(A. purpuratus)、A. ventricosus聚为1支;栉孔扇贝属的C. farreri、A. farreri和S. livida为1支;掌扇贝属的平濑掌扇贝(Volachlamys hirasei)、新加坡掌扇贝(V. singaporina)聚为1支;盘扇贝属的M. yessoensis、P. caurinus聚为1支,聚类结果基本与传统的分类结果一致。
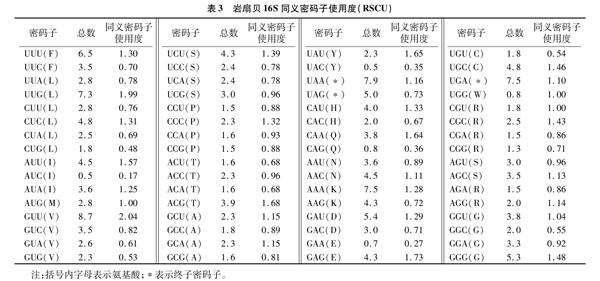
2.3 岩扇贝中16S基因的密码子偏好性
16S在岩扇贝中扩增偏向使用以U或G结尾的密码子,总使用度分别为12.76、8.02。其中GUU、UUG、AUU、ACG、UAU、CAA、GAG、UUU、UCU、GAU、GGU、GAG、AGG和GGA等25个密码子的RSCU值均大于1,其中GUU的RSCU值大于2,为16S在岩扇贝中偏好性使用次数最多的(表3)。
3 讨论
孔晓瑜等做了栉孔扇贝和海湾扇贝线粒体16S rRNA基因片段的比较研究,A+T的含量分别为54.73%、55.17%[18]。胡丽萍等在紫扇贝和海湾扇贝中扩增16S,获得基因片段长度均为542 bp,紫扇贝和海湾扇贝的碱基组成 A+T所占比例分别为54.2%、55.1%[19]。朱立静等对四角蛤蜊CO Ⅰ基因的研究表明,四角蛤蜊的G+C含量明显低于A+T含量[20];程汉良等对帘蛤目中6种贝类进行CO Ⅰ序列的扩增结果也表明,A+T含量明显高于G+C含量[21]。这与本研究中CO Ⅰ在岩扇贝中的扩增结果相似。一般认为,
在线粒体基因组中,16S rRNA基因进化速率低,比较保守,而CO Ⅰ基因为变异性较大的区域,在不少无脊椎动物中检测到了较大的变异[22-23]。从本试验结果可以看出,在剪裁为 529 bp 的16S rRNA片段中,其保守位点153个,变异位点369个,变异位点比例达到69.8%,即岩扇贝种内变异率较高,原因可能是16S存在较高的碱基转换和颠换,这部分有待后续进行进一步讨论。
Thompson等认为成对联配的氨基酸序列的平均一致性百分比太低时,多序列联配的结果准确性会下降,一致性百分比等于1减去p-distance[24]。 当p-distance﹤0.8,联配结果是可接受的;当p-distance≥0.8则是不可靠的。本试验CO Ⅰ的p-distance为0.746,对应的一致性为25.4%,介于20%和30%之间的临界区域,氨基酸残基的联配正确率在80%左右,另一项研究表明,氨基酸联配的精确性大于50%时,它对系统进化树准确性的影响就微乎其微了,即该COⅠ系统进化树是可信且可用的[25]。同理,16S序列的Jukes-Cantor分析值为0.246,说明16S的NJ树可信且可用。
Saavedr等分析表明,C. gigantea进化上接近C. islandica,其次是岩扇贝属的其他成员如Crassadoma multistriata、Mimachlamys varia[12]。在本试验16S的NJ树中,C. gigantea更接近P. caurinus和M. yessoensis,其次是C. islandica,在CO Ⅰ的NJ树中更接近于A. farreri,2个NJ树不一致的原因可能是2个基因片段剪裁序列的长度不同导致联配一致度不同。Feng 等研究表明,在CO Ⅰ进化树中芬香海扇蛤(D. plica)、大海扇蛤(P. maximus)、A. pleuronectes、A.irradians聚为1支,在16S进化树中Pecten maximus、Amusium pleuronectes、Argopecten irradians和其他扇贝聚为1支而Decatopecten plica单独聚为1支[16]。
参考文献:
[1]曹善茂,汪 健,王 谦,等. 岩扇贝人工育苗的初步研究[J]. 大连海洋大学学报,2017,32(1):1-6.
[2]曹善茂,王 昊,陈 炜,等. 岩扇贝闭壳肌营养成分的分析及与中国 3 种扇贝的比较[J]. 大连海洋大学学报,2016,31(5):544-550.
[3]曹善茂,梁伟锋,汪 健,等. 岩扇贝幼贝滤食率的基础研究[J]. 大连海洋大学学报,2016,31(6):612-617.
[4]Phleger C F,Holtz R B,Grimes P W,et al.Chemical and sensory analysis of the purple-hinge rock scallo Hinnites multirugosus Gale[J]. Journal of Food Science,1978,43(6):1793-1796.
[5]Maxwell-Miller G,Josephson R V,Spindler A A,et al.Chilled(5 ℃)and frozen(-18 ℃) storage stability of the purple-hinge rock scallop,Hinnites multirugosus Gale[J]. Journal of Food Science,1982,47(5):1654-1661.
[6]Monical James B. Comparative studies on growth of the purple-hinge rock scallop Hinnites multirugosus (Gale) in southern California[J]. Journal of the World Aquaculture Society,1979,10(1/2/3/4):648.
[7]Laurén D J.Oogenesis and protandry in the purple-hinge rock scallop,Hinnites giganteus,in upper Puget Sound,Washington,U.S.A.[J]. Canadian Journal of Zoology,1982,60(10):2333-2336.
[8]Cary S C,Leighton D L,Phleger C F.Food and feeding strategies in culture of larval and early juvenile purple -hinge rock scallops,Hinnites multirugosus (Gale)[J]. Journal of the World Aquaculture Society,1981,12(1):156-169.
[9]Culver C S,Richards J B,Page H M.Plasticity of attachment in the purple-hinge rock scallop,Crassadoma gigantea:implications for commercial culture[J]. Aquaculture,2006,254(1/2/3/4):361-369.
[10]Bernard F R. Crassadoma gen. nov. for “Hinnites”giganteus (Gray,1825) from the North-eastern Pacific Ocean (Bivalvia:Pectinidae)[J]. Venus 1986,45:70-74
[11]Waller T R. The evolution of “Chlamys” (Mollusca:Bivalvia:Pectinidae) in the tropical western Atlantic and eastern Pacific[J]. Am Malacol Bull,1993,10:195-249.
[12]Saavedra C,Pea J B. Phylogenetics of American scallops (Bivalvia:Pectinidae) based on partial 16S and 12S ribosomal RNA gene sequences[J]. Marine Biology,2006,150:111-119.
[13]Hebert P D N,Ratnasingham S,de Waard J R . Barcoding animal life:cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proceedings of the Royal Society B:Biological Sciences,2003,270(S1):96-99.
[14]Ball S L,Hebert P D N,Burian S K,et al. Biological identifications of mayflies (Ephemeroptera) using DNA barcodes[J]. Journal of the North American Benthological Society,2005,24(3):508-524.
[15]程希婷,王愛民,顾志峰,等. DNA条形码研究进展[J]. 基因组学与应用生物学,2011,30(6):748-758.
[16]Feng Y W,Li Q,Kong L F,et al. DNA barcoding and phylogenetic analysis of Pectinidae (Mollusca:Bivalvia) based on mitochondrial CO Ⅰ and 16S rRNA genes[J]. Molecular Biology Reports,2011,38(1):291-299.
[17]宋乔乔,柴志欣,钟金城. 禽流感病毒基因的密码子偏好性及聚类分析[J]. 生物技术,2014,24(2):48-53.
[18]孔晓瑜,刘亚军,喻子牛,等. 栉孔扇贝和海湾扇贝线粒体16S rRNA基因片段的比较研究[C]// 中国动物学会、中国海洋湖沼学会贝类学分会代表大会暨学术讨论会,1999.
[19]胡丽萍,姜黎明,黄晓婷,等. 基于16S rDNA基因序列探讨引进物种紫扇(Argopecten purpuratus)在海湾扇贝属(Argopecten)中的分类地位[J]. 海洋与湖沼,2016,47(6):1149-1157.
[20]朱立静,陈淑吟,许晓风,等. 四角蛤蜊江苏群体线粒体CO Ⅰ基因片段序列研究[J]. 江苏农业科学,2010,38(4):33-35.
[21]程汉良,夏德全,吴婷婷,等. 6种帘蛤科贝类及4个地理种群文蛤线粒体CO Ⅰ基因片段序列分析[J]. 海洋学报,2007,29(5):109-116.
[22]Howland D E,Hewitt G M. Phylogeny of the colepters based on mitochondrial cytochrome oxidase Ⅰ sequence data[J]. Insect Mol Bio,1995,4:203-205.
[23]Spicer G S . Phylogenetic utility of the mitochondrial cytochrome oxidase gene:molecular evolution of the Drosophila buzzatiispecies complex[J]. Journal of Molecular Evolution,1996,41(6):749-759.
[24]Thompson J D,Plewniak F,Poch O . A comprehensive comparison of multiple sequence alignment programs[J]. Nucleic Acids Research,1999,27(13):2682-2690.
[25]Ogdenw T H,Rosenberg M S. Multiple sequence alignment accuracy and phylogenetic inference[J]. Systematic Biology,2006,55(2):314-328.刘冬梅,娄喜艳,吴 狄,等. 基于棉花转录组测序的SSR分子标记的开发[J]. 江苏农业科学,2019,47(7):32-35.
