基于3-羟基-2-吡啶苯甲酸的铜(Ⅱ)配位聚合物的合成,晶体结构和光催化性能
2019-09-17谷兴业惠洋洋吴明慧佘世雄
谷兴业,惠洋洋,吕 薇,柳 笑,吴明慧,杨 燕,佘世雄
(青海大学化工学院,西宁 810016)
1 引 言
有色染料等有机污染物造成的水环境问题,引起了全世界的广泛关注[1]。由于难以进行自身降解,使这些具有高毒性和致癌性的染料长期暴露在水体中,严重影响人类健康,破坏生态环境。因此,许多物理和化学方法都被应用于降解水体中的有机染料等有害污染物,主要包括吸附[2],膜分离[3],化学氧化[4-5]和光催化[6-7]等方法。与其他废水处理方法相比,光催化氧化法不仅具有环境友好和使用方便等优点,而且还可以将有机染料分子降解成为小分子物质,甚至矿化成CO2和H2O分子,因此在材料和化学领域得到了广泛关注。金属有机骨架[8-9](MOFs)作为一种新型光催化材料,被用于降解有机污染物和染料,已在国内外引起了广泛的研究兴趣。MOFs是由多官能团有机配体和无机金属离子或金属簇通过强配位键构成的材料,通常具有较窄的带隙能,从而可以有效的吸收紫外和可见光,催化降解有机染料分子。Li等[10]团队设计了一种3D双核金属MOF-[Cd(NiL)(PTA)]·DMAC3[PTA=phthalic acid, L=1,2-cyclohexanediamine-N,N-bis(3-tert-Buty-5-(4-pyridyl))salicylidene],用作光催化剂降解甲基橙染料,在紫外光下照射90 min后,甲基橙的降解率可达85%。Abhinia[11]研究小组合成的一例三维铜配合物[Cu2(L1)·5DMF]n(H4L1=3,5-di(3,5-dicarboxyphenyl)nitrobenzene),光催化实验结果表明该配合物在紫外光条件下对甲基紫和罗丹明B都具有良好的催化降解效果,在光照45 min后对两种染料的降解效率分别为70%和41%。MOFs光催化剂不仅具有结构可调、孔道多变和易于改性的优点,而且其固有的异质性,使材料易于被重复使用[12-14]。Yang等[15]合成的多孔Cu配位聚合物[Cu(bpz)(SO4)0.5]n(bpz=3-(2-吡啶基吡唑))对MB具有良好的光催化活性,在重复使用5次后对亚甲基蓝的降解率仍然高达96.6%。Peng等[16]小组设计的一种三维铜配合物[Cu4(HPO4)(PO4)(H2O)2(PBI)][PW12O40]·H2O (PBI=2-(pyridine-2-2yl)-1H-benzo imidazole)表现出了在紫外光下对MB的高效光催化降解性能,重复使用5次之后,其催化效果基本保持不变。因此,设计构建基于不同结构特点的有机配体和金属离子的金属有机骨架材料,并研究它们的光吸收性能和催化性质,具有十分重要的意义。
本文以3-羟基-2-吡啶苯甲酸(H2L)和Cu(NO3)2·6H2O为原料,通过溶剂热反应得到了一个新的配合物[Cu(HL)2·C2H5OH]n(1)。光响应能力和光催化活性测试结果表明,配合物1具有半导体性质,在紫外光照射下能有效的催化降解MB染料,并对MO染料也具有一定的降解效果。此外,配合物1具有良好的循环再生性,重复使用5次后仍能保持对MB分子的光催化活性基本不变。
2 实 验
2.1 仪器与试剂
Nicolet Avatar 360型红外光谱仪(KBr压片);TGA 4000型热重分析仪;Perkin-Elmer 2400 型元素分析仪;Puxi, UV-1901型固体紫外分光光度计,以BaSO4为空白参比样;Bruker Smart APEXⅡ型单晶X射线衍射仪;通过Carry 60紫外分光光度计测试了配合物的紫外-可见吸收曲线。
所用试剂均为分析纯或化学纯。
2.2 配合物[Cu(HL)2·C2H5OH]n的制备
通过经典的水热合成法由3-羟基-2-吡啶苯甲酸和Cu(NO3)2·6H2O反应成功制备了一种新型的配合物[Cu(HL)2·C2H5OH]n。将Cu(NO3)2·6H2O(0.296 g, 0.1 mmol)与3-羟基-2-吡啶苯甲酸(0.014 g, 0.1 mmol)加入到6 mL EtOH溶液中,并在室温条件下搅拌30 min,得到无色液体。然后将混合溶液转移到25 mL的反应釜中,80 ℃条件下反应24 h,之后取出冷却至室温,乙醇洗涤3~4次,得到规整的蓝色小棒晶(产率为60%,基于Cu(NO3)2·6H2O)。元素分析理论值(%)C14H14CuN2O7:C, 43.55; H, 3.63; N, 7.26。实际测量值: C, 43.53; H, 3.62; N,7.26。
2.3 晶体结构的测定
通过Bruker Smart APexⅡ型单晶X-射线衍射仪对配合物1的晶体结构进行了测试,采用经石墨单色器单色化的Mo-Kα射线,T=293 K,以ω-2θ的扫描方式,利用SHELX-XL程序包[17],以直接法解出。利用差值函数法先确定全部的非氢原子坐标,氢原子经理论加氢后再经过各向同性修正确定位置,最后用最小二乘法对晶体结构精修。配合物1的CCDC号为1903041。配合物1的晶体学数据和精制参数列于表1中,其中配合物1的部分键长和键角如表2所示。

表1 配合物1的晶体学参数Table 1 Crystal parameters of complex 1
3 结果与讨论
3.1 配合物1的晶体结构
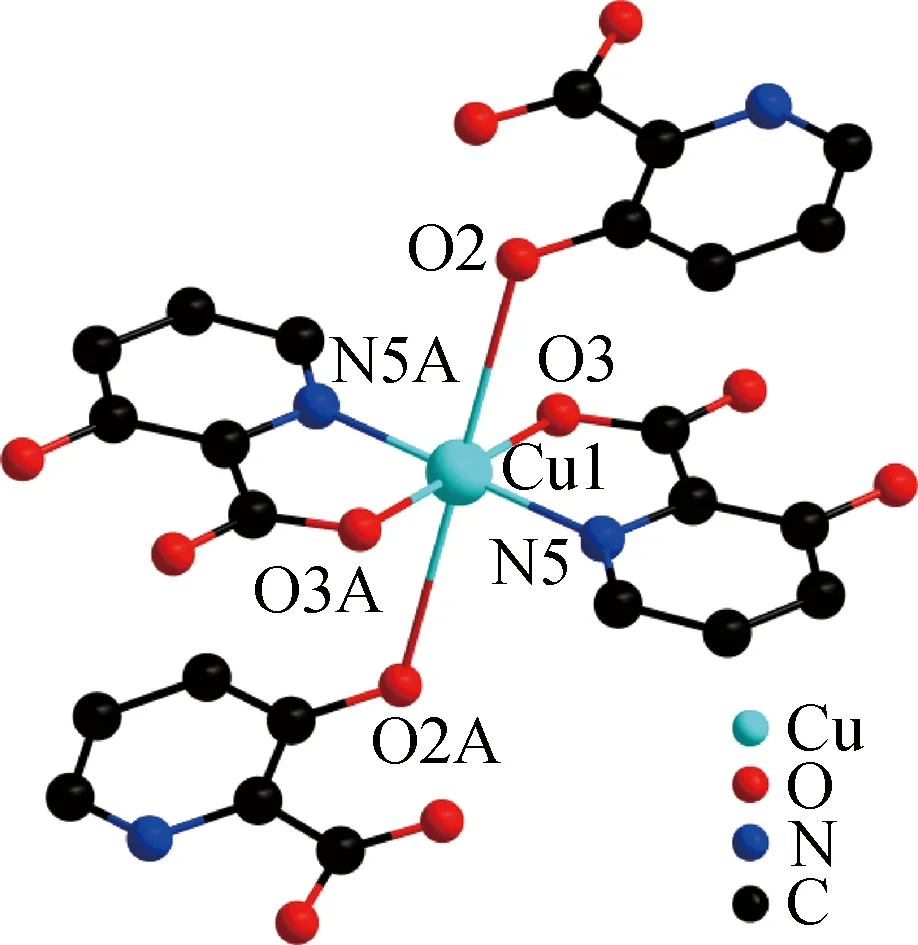
图1 配合物1的配位环境图Fig.1 Molecular structure of complex 1
X-射线单晶衍射测试结果如表1所示。结果表明,该配合物结晶于单斜晶系,P21/c空间群。配合物次级结构单元中包含一个铜离子和四个3-羟基-2-吡啶苯甲酸有机配体分子(图1)。CuⅡ与来自于四个有机配体中的两个羧酸氧原子(O3, O3A)、两个羟基氧原子(O2, O2A)以及吡啶环上的两个氮原子(N5, N5A)相配位,形成六配位模式。中心金属离子CuⅡ处于一个正八面体配位构型中。Cu-O键与Cu-N键的键长范围分别为1.279(4)~1.947(2) Å和1.967(2) Å。相邻的两个CuⅡ之间,通过周围有机配体的羧基和羟基基团进一步桥连,形成了二维平面结构(图2),其中Cu…Cu之间的距离均为6.9869 Å。另外,在配合物1中,由于苯环之间的相互叠加,两个配体之间相反位置的苯环可以形成有效的π-π相互作用(图2),面中心距离仅为4.4511 Å(图3),相比于其他超分子材料较短[18-20]。近年来,越来越多的研究结果表明,这些弱相互作用不仅有助于增强原始结构的稳定性[21-22],还能提高配合物的光吸收性能,从而进一步提高配合物对有机染料的催化降解性能[23-24]。

图2 配合物1的二维平面结构及π-π相互作用(虚线)Fig.2 2D framework and π-π stacking interactions (dash lines) of complex 1
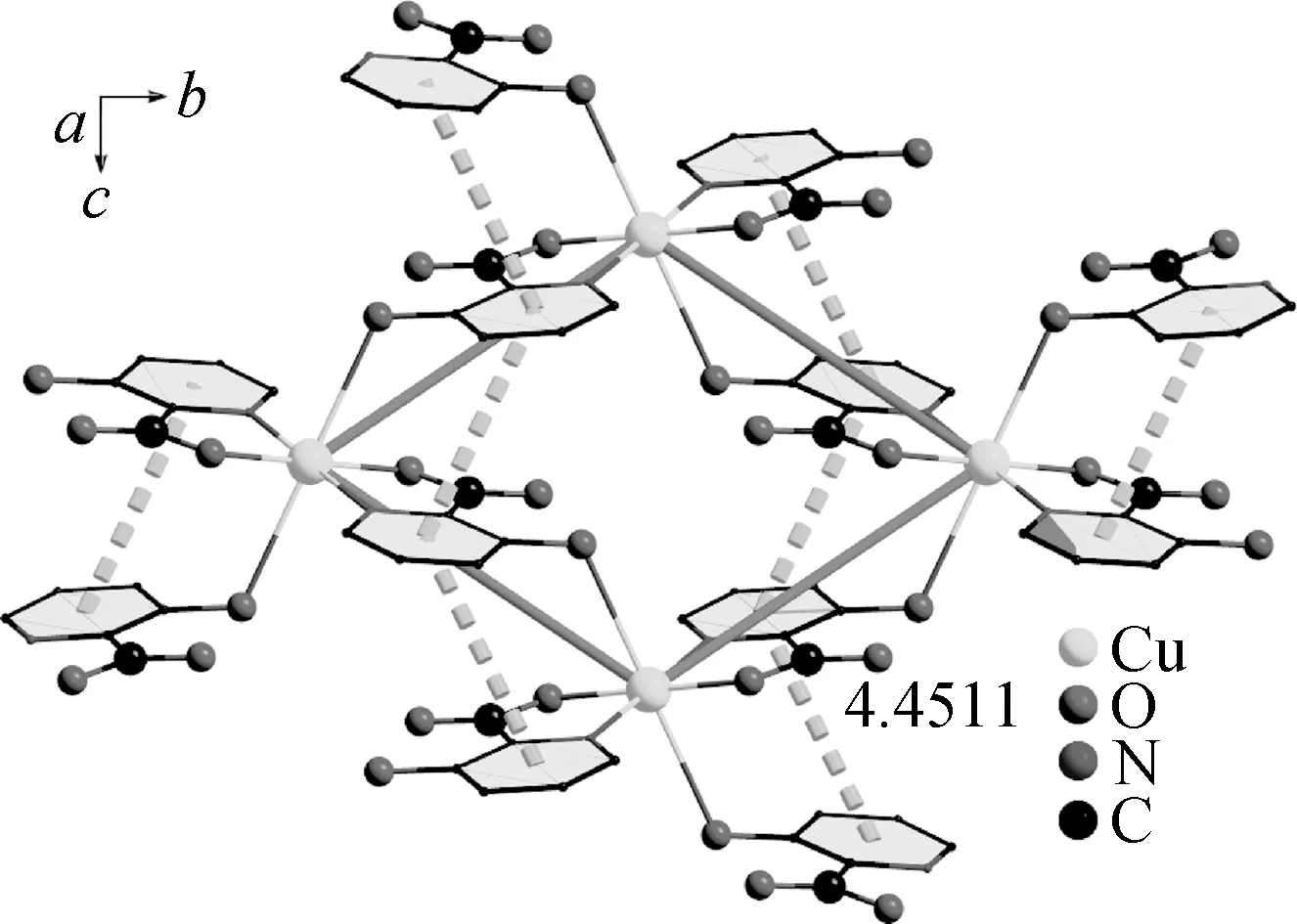
图3 配合物1中的π-π相互作用示意图Fig.3 The schematic diagram of the stacking interactions π-π interactions in complex 1

表2 配合物1的部分键长和键角Table 2 Partial bond lengths(nm) and bond angles(°)of complex 1
11-X,1-Y,1-Z
3.2 红外吸收光谱
配合物1的IR光谱如图4所示。可以看出,由于配体中的羧酸基团完全去质子化,所以在1675 cm-1处并未发现-COOH的特征吸收峰。在1605 cm-1和1375 cm-1处的吸收峰可归属于COO-的反对称收缩振动峰和对称收缩振动峰;1580 cm-1和1480 cm-1处的强吸收峰可归属于吡啶环中C=N与C=C的伸缩振动峰,由于配体吡啶环上的氮原子参与配位,使C=N发生了红移;1125 cm-1处出现的弱吸收峰可认为是羧基中的C-O伸缩振动峰;875 cm-1、695 cm-1处为对二取代苯的吸收峰;635 cm-1处的吸收峰归因于配合物中的Cu-O吸收峰。红外光谱测试结果与单晶结构测试结果一致。
3.3 X射线粉末衍射
为了检测配合物1的纯度,测定了样品的X射线粉末衍射(图5)。由图可见,衍射曲线与根据单晶数据模拟所得到的曲线高度吻合,衍射峰位置一一对应,并未发现有明显的杂峰,表明得到的化合物具有很高的结晶度并且无杂晶相。
3.4 热重分析
为了研究配合物1的热稳定性,在室温至1000 ℃的温度范围内测试了配合物1的热重分析曲线,测试条件是在氮气保护下以10 K/min的加热速率升温。如图6所示,配合物在220 ℃之前基本保持稳定存在,只出现一个很小的失重过程,失重率为1.21%,对应失去1个乙醇分子(理论值为1.19%)。随后,当温度高于220 ℃时,配合物开始大量失重,归属于配位键的断裂和主体骨架的分解所致。当加热到1000 ℃时,热分解几乎完成,残余重量为19.52%(以CuO计,计算值为:19.68%)。

图4 配合物1的红外光谱图Fig.4 IR spectrum of complex 1
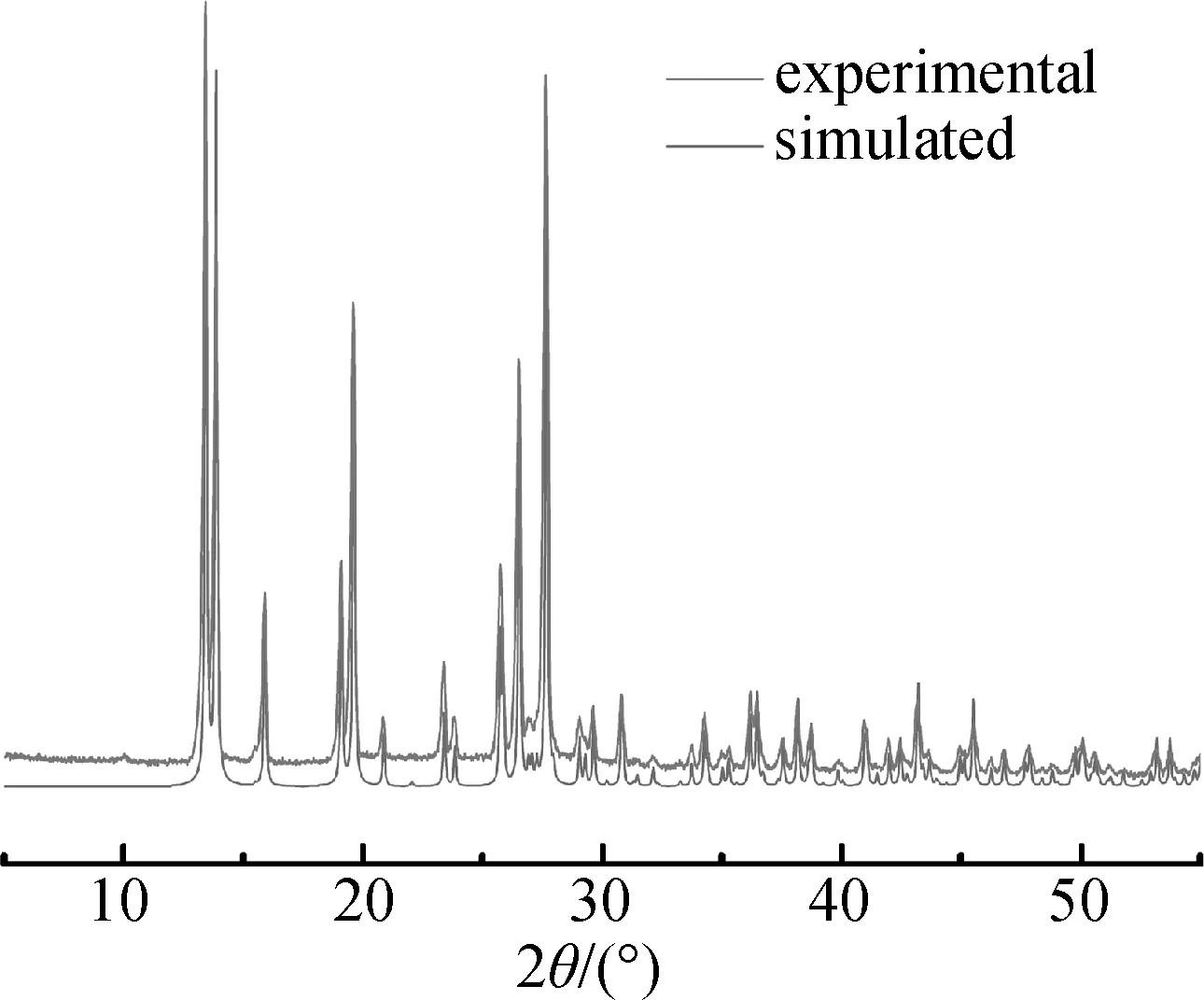
图5 配合物1的PXRD谱图Fig.5 PXRD patterns of complex 1
3.5 能带光谱分析
为了确定配合物1是否具有半导体性能,在室温条件下测试了固态漫反射UV/Vis光谱。如图7所示,在600 nm处出现的一个较强吸收峰,可认为是配体或金属-配体电荷转移的典型π-π*跃迁所致。根据Kubelka-Munk函数关系式计算出配合物1的能带隙(Eg)数值为3.01 eV,这表明该配合物具有半导体性质,能有效的吸收紫外光,从而表现出半导体光催化性能。

图6 配合物1的热重曲线图Fig.6 TGA curve of complex 1

图7 配合物1的固体漫反射光谱图 (插图:Kubelka-Munk转化示意图)Fig.7 UV-Vis diffuse-reflectance spectrum of complex 1 (Insert: Diffuse reflectance spectrum of Kubelka-Munk function vs. energy of complex 1)
3.6 配合物的催化性能分析
以亚甲基蓝(MB)染料溶液为研究对象,表征了配合物1的光催化活性。首先将100 mg配合物1加入到100 mL亚甲基蓝溶液(10 mg/L)中,在黑暗条件下搅拌0.5 h以使MB分子在配合物1表面达到吸附-脱附平衡。随后,向反应体系中补充加入浓度为30%的H2O2(0.1 mL),并在紫外灯的照射下进行光催化降解实验。如图8所示,暗吸附0.5 h后,亚甲基蓝的脱色率为19.25%。之后在紫外光照射下,随着反应时间的增加,亚甲基蓝溶液的吸收峰呈明显下降趋势。当反应时间为120 min时,配合物1对MB的降解率达到了92.6%。对比实验发现,当反应体系中只有光催化剂或H2O2存在的条件下,MB的降解率明显降低,分别为21.6%和32.4%(图9,10)。结果表明,配合物1和H2O2在紫外光照射下发生了协同作用,其反应机理遵循Fenton催化机理[25-26]。催化反应过程中,配合物1中的Cu(Ⅱ)离子同H2O2易于发生反应,产生高活性羟基自由基,并最终通过·OH进一步降解MB分子,完成了光催化过程[27]。图11是配合物1光催化降解MB的动力学曲线。如图所示,该物质的降解过程符合准一级动力学模型。由线性曲线的斜率计算的动力学速率常数k的值是5.969×10-2(min-1)。此外,为了评价光催化剂1的循环再生性,进行了染料MB的重复光催化降解实验。如图12所示,光催化剂在经历5次催化降解实验后,其催化降解效率稍微有所降低,其原因可能是在催化过程中催化剂发生了团聚现象[28],但其催化降解效率仍高达91.8%,表明该配合物具有优异的循环再生性。实验结果表明,配合物1是一种降解亚甲基蓝(MB)溶液的优异光催化剂。

图8 在紫外光照射,配合物1和H2O2存在 条件下,MB溶液的催化降解吸收光谱Fig.8 UV-vis absorption spectra of MB solution during photocatalytic degradation under the UV light irradiation with the presence of complex 1 and H2O2
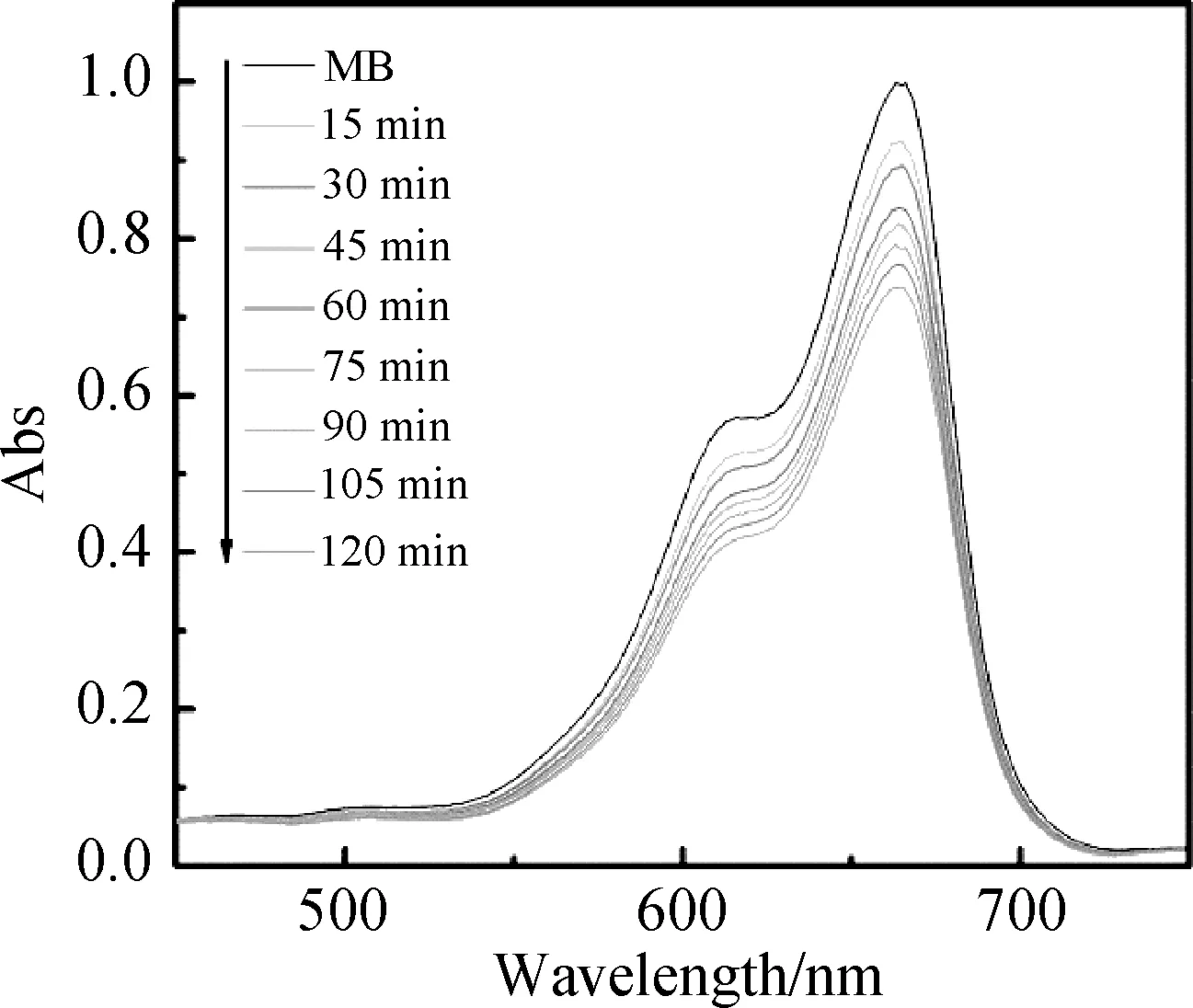
图9 在紫外光照射下,H2O2对MB溶液 的降解吸收光谱Fig.9 UV-vis absorption spectra of MB solution during photocatalytic degradation under the UV light irradiation with the presence of H2O2
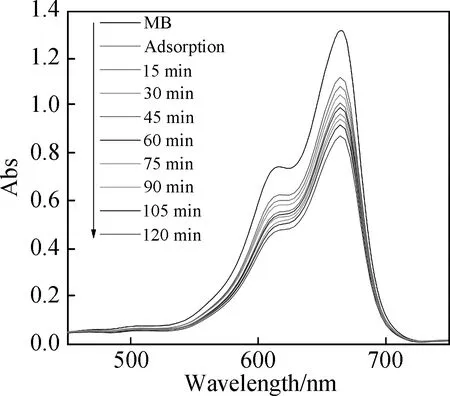
图10 在紫外光照射下,配合物1对MB溶液的 UV/Vis吸收光谱Fig.10 UV-vis absorption spectra of MB solution during photocatalytic degradation under the UV light irradiation with the presence of complex 1

图11 在紫外光照射下,配合物1对MB降解的 准一级动力学曲线Fig.11 Pseudo first-order kinetics curve of the MB degradation under UV irradiation in the presence of complex 1

图12 相同条件下配合物1对MB的 光催化降解循环实验Fig.12 Recycling experiments of complex 1 towards MB photodegradation at the same conditions

图13 在紫外光照射下,配合物1和H2O2对MO 溶液的催化降解吸收光谱Fig.13 UV-vis absorption spectra of MO solution during photocatalytic degradation under the UV light irradiation with the presence of complex 1 and H2O2
此外,为了能更好的了解配合物1的光催化性质,进一步探讨了其对甲基橙(MO)的催化降解效果。如图13所示,在配合物1和H2O2共同存在下,UV照射180 min后,MO降解率为45.4%。结果表明,光催化剂对甲基橙的降解效率明显低于亚甲基蓝,造成这种现象的原因可能是由于MB和MO染料分子的大小不同,从而具有不同的带隙尺寸,导致了光催化活性的差异[29]。而且,由于配合物分子和染料分子之间的静电相互作用不同,导致了不同的染料降解效果[30]。
4 结 论
(1)以3-羟基-2-吡啶苯甲酸(H2L)和Cu(NO3)2·6H2O为原料,通过溶剂热反应得到了一个新的配合物[Cu(HL)2·C2H5OH]n(1)。X射线单晶衍射结构分析表明该配合物结晶于单斜晶系,P21/c空间群。配合物最小结构单元由一个铜离子与四个有机配体相结合,形成六配位模式,并进一步通过有机配体的羧酸基团和羟基基团连接,形成了二维框架结构。
(2)固态漫反射UV/Vis光谱显示配合物1具有半导体性质,带隙能(Eg)为3.01 eV。
(3)光催化降解有机染料实验结果表明,该配合物在紫外光照射下120 min内对亚甲基蓝染料溶液的降解率为92.6%,并且在重复使用5次之后,配合物1的光催化活性基本不变。另外,材料对甲基橙(MO)也具有较好的降解能力,在光照180 min后降解率为45.4%。
