胎源性卵巢早衰及宫内编程机制的研究进展
2019-09-16龚肖涵汪晖徐丹
龚肖涵,汪晖,徐丹
卵巢是雌性个体的生殖器官,能周期性产生卵子和分泌类固醇激素,在维持机体内分泌系统平衡及正常生理代谢中发挥重要作用。近年来卵巢早衰(premature ovarian failure,POF)在女性中的患病率有上升趋势,不仅严重影响育龄妇女的生殖健康,还会增加代谢性疾病如骨质疏松和心血管疾病的发生风险。已有报道,女(雌)性卵巢发育不良及生殖功能异常存在宫内起源,胎源性卵巢疾病的发生与胎儿时期“宫内编程”改变有关[1]。大量流行病学调查和动物实验表明,孕期不良环境如母体外源毒物/药物暴露、不良生活习惯以及母体营养不良和疾病等,不仅影响母体健康,还会对子代的卵巢结构、功能发育及成年后生殖健康产生不利影响。本文就卵巢发育的生理调节机制、孕期不良环境对卵巢发育的影响及“宫内编程”机制进行综述,旨在加深孕期环境因素对女(雌)性子代卵巢发育及功能影响的认识,深刻理解卵巢发育毒性的宫内发育起源,对指导围生期生活习惯和临床用药均具有重要的现实意义。
1 卵巢发育与功能调节
1.1 卵巢的结构和生理功能发育 在胚胎发生期,原始生殖细胞(primordial germ cells,PGCs)从卵黄囊通过后肠的背侧肠系膜迁移到生殖嵴,而体细胞主要来源于生殖嵴的间质。生殖细胞和体细胞都能在生殖嵴迅速增殖。然后每个生殖细胞被一层体细胞包围形成原始卵泡。原始卵泡形成后聚集在卵巢皮质部位,形成原始卵泡库。卵巢中最主要的生殖内分泌单位即为卵泡,属于不可再生的组织结构。
卵巢的功能是产生雌性配子和分泌类固醇激素。卵巢合成及分泌激素需在多个酶的顺序催化下完成。类固醇生成需要将胆固醇转运到发生初始类固醇生成反应的线粒体,胆固醇由类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)介导进入线粒体,通过细胞色素P450胆固醇侧链裂解酶(cytochrome P450 cholesterol side-chain cleavageenzyme,P450scc)的联合作用转化成孕烯醇酮,进一步在系列类固醇合成酶的作用下最终合成性激素(图1)。
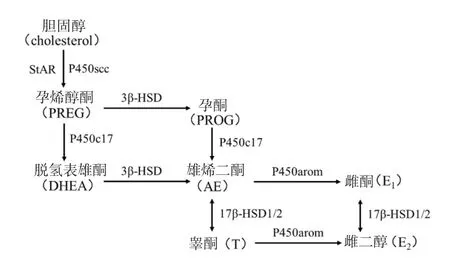
图1 卵巢类固醇合成酶顺序催化下的性激素合成
1.2 卵巢的生理功能调节
1.2.1 下丘脑-垂体-卵巢(hypothalamic-pituitaryovarian,HPO)轴的调节 下丘脑、垂体和卵巢三个器官组成HPO轴,能发挥促卵泡发育、刺激雌激素合成的效应,从而调节卵巢的功能发育[2]。生理情况下,下丘脑脉冲式分泌促性腺激素释放激素(gonadotropin-releasing hormone,GnRH),刺激垂体分泌卵泡刺激素(follicle-stimulating hormone,FSH)和黄体生成激素(luteinizing hormone,LH),后者分别作用于卵巢相应FSH受体(FSHR)和LH受体(LHR),并通过调节性激素的产生和释放,影响女(雌)性生殖系统的发育。在特定的卵泡发育期,FSHR和LHR在正确时间点的表达对促性腺激素(gonadotropins,Gn)成熟和类固醇生成至关重要,亦是卵巢功能正常发育和调节的关键步骤。卵巢内卵泡启动生长及始基卵泡池的耗竭过程主要依赖于旁分泌和自分泌的作用,并不依赖于Gn,而进入青春期后卵泡的发育、成熟及闭锁过程则主要依赖于Gn的刺激作用。FSH是卵泡发育的主要激素,其可刺激优势卵泡分泌E2。已证实,FSH可促进窦前卵泡及窦状卵泡的增殖与分化,分泌卵泡液,促进卵泡发育;激活P450arom系统,合成和分泌E2;促使优势卵泡的选择;诱导颗粒细胞表达LHR[3]。
1.2.2 卵巢局部因子的调节 卵巢功能调节是一个精密而有序的过程,受环境、家族遗传、神经内分泌、营养代谢等多种因素调控。卵巢局部调节因子对维持其正常功能有重要作用。这些因子由卵巢的卵母细胞、颗粒细胞和膜细胞产生,可在卵巢局部或通过反馈(即旁分泌)对卵巢功能发挥调节作用
转化生长因子β(transforming growth factorβ,TGF-β)超家族成员对卵巢具有广泛的影响。其中,由滤泡细胞表达并且涉及卵泡发育阶段的TGF-β超家族成员包括TGF-β、激活素(activin)、生长分化因子9/9B(growth differentiation factor 9/9B,GDF-9/9B)和几种骨形态发生蛋白(bonemorphogenetic protein,BMP),通过调节颗粒细胞的增殖与分化、各级卵泡的发育以及激素的合成,来调控卵巢的发育[4]。
表皮生长因子(epidermal growth factor,EGF)家族包括EGF、肝素结合EGF样生长因子(heparin binding EGF-like growth factor,HB-EGF)、TGF-α、表观蛋白 (epigen,EPGN)、神经调节蛋白1(neuregulins 1,NRG1)、双调蛋白(amphiregulin,AREG)、表皮调节蛋白(epiregulin,EREG)和β细胞素(beta cellulin,BTC),都具有高度相似的结构和功能特性。诸多研究证实,颗粒细胞和卵丘细胞中的EGF样肽信号传导对卵母细胞减数分裂成熟至关重要,协调卵母细胞的细胞质成熟从而影响卵母细胞发育能力[5]。
部分因子能通过修饰Gn对滤泡体细胞的作用来调节卵巢功能,如胰岛素样生长因子(insulin-like growth factor,IGF)。IGF分为IGF1和IGF2等多种亚型,其主要的卵巢合成部位为膜细胞。在膜细胞上合成的IGF1与颗粒细胞上的IGF1受体(IGF1R)结合,从而加强FSH对芳香化酶的激活,促进颗粒细胞增殖;还可通过加强LH诱导芳香化酶和3β-HSD表达从而产生雄激素;亦可通过增强FSH或LH对类固醇生成的影响,直接增加P450scc的转录,促进E2合成和颗粒细胞增殖。
此外,其他局部因子如激活素、抑制素B(inhibin B,INHB)和卵泡抑素(follistain)对垂体FSH、LH也具有反馈调节作用,参与卵巢细胞增殖、类固醇生成及其在卵泡内的活动调节等。
2 孕期不良环境与胎源性POF
POF是指月经初潮年龄正常或青春期延迟,第二性征发育正常的女性,在40岁以前因卵巢内卵泡耗竭或卵泡功能障碍而导致的闭经现象。临床表现为闭经、不孕、潮热多汗、性欲下降等低雌激素症状。POF对生殖、心理和身体健康会产生诸多不利影响。流行病学调查显示,POF在15~29岁女性中的发病率为0.1%,在30~39岁妇女中的发病率为1%[6],且POF综合征的广泛异质性使得其准确的人群患病率可能要远高于报道的数据水平。
人们日常生活中充斥着诸多自然和人造物质,这些物质随着空气、饮食进入人体。其中一部分有致畸作用的物质容易引起研究人员的重视,然而,另一部分可能会远期影响性成熟、受孕能力和生殖能力的摄入性物质,如尼古丁(烟草)、咖啡因、乙醇等物质的摄入以及部分药物的滥用等,往往容易被忽视。动物实验也表明,孕期不良母体环境会编程子代的生殖发育,引起子代出现低出生体质量和成年后生殖能力早衰等卵巢功能异常。卵巢的卵泡发生起源于宫内时期,因此子代卵巢卵泡的结构和功能发育与孕期所处环境密切相关。有些研究提示POF存在宫内起源。
2.1 孕期外源物暴露 越来越多的证据表明,孕妇暴露于多种外源物如乙醇、咖啡因、尼古丁和某些药物等会影响胎儿发育,其中胎儿卵巢发育也会受到影响。人群流行病学调查显示,孕期不良环境会引起子代胎儿生长受限(fetal growth restriction,FGR),在出生时表现为低出生体质量的女性新生儿,到成年时期表现为较正常人群子宫及卵巢体积明显减小、FSH分泌过多、排卵率降低或无排卵,提示其卵巢储备功能下降(diminished ovarian reserve,DOR)[7-8]。美国一项调查报道,在660名6~11岁的女孩中,分别有19%和39%的母亲存在产前吸烟或产前烟雾暴露的状况。母体产前烟雾暴露的女孩LH和INHB水平显著降低,证实产前烟雾暴露对LH和INHB有负面影响,并可能影响子代卵巢功能[9]。一项丹麦队列研究通过追踪436例在宫内暴露于有机氯污染物的女性子代发现,虽然月经初潮及月经周期均未受影响,但卵巢卵泡数量明显减少并可能影响成年时期生育力[10]。孕期尼古丁暴露是全球公共卫生中最重要的问题之一,可导致多种危害,如子代FGR、心血管疾病发生等[11]。在吸烟妇女的滤泡液中检测到尼古丁的代谢产物可替宁[12],表明尼古丁可以进入卵巢、卵泡和发育中的胚胎并可能产生不利影响。
诸多动物实验也表明,孕期外源物暴露可影响胎儿卵巢发育。有研究报道,母体高剂量咖啡因暴露,子代大鼠卵巢质量显著降低,出生后第7~120天的原始卵泡数和窦卵泡的直径也显著降低[13]。研究显示,孕期暴露于尼古丁的子代小鼠卵巢中卵泡和卵母细胞减少,卵母细胞氧化酶水平升高,排卵数量减少[14]。孕期邻苯二甲酸酯暴露通过介入卵泡发生的不同阶段破坏卵巢功能并影响卵巢储备,引起子代POF且具有跨代遗传的现象[15-16]。孕期地塞米松暴露致子代小鼠胎儿卵巢质量降低,各类别卵泡的数量减少[17],后期还可能影响子代的生殖能力。发育源性疾病湖北省重点实验室(我室)也证实,孕期地塞米松暴露不仅对大鼠胎鼠卵巢有发育毒性作用,此作用还能延续到成年后,出现POF易感甚至跨代遗传到子三代[18]。
环境污染物的孕期暴露对于子代卵巢的功能与发育也有一定影响。研究发现,小鼠孕期暴露于邻苯二甲酸二(2-乙基己基)酯(diethyl hexyl phthalate,DEHP)可致雌性子代卵泡数量降低,雌激素及孕酮水平下降,对其生殖功能具有一定的负面影响,且具有跨代遗传效应[15-16]。同时,DEHP显著增加大鼠和小鼠卵巢闭锁卵泡的数量,引起POF[19]。大鼠孕期暴露于环境污染物双酚A(bisphenol A,BPA)致雌性子代雌激素水平下调[20],原始卵泡数量减少,出现POF的症状并具有一定的跨代遗传效应[21]。多种其他环境污染物如植物雌激素、多氯联苯、大豆异黄酮、阻燃剂等的孕期暴露,均被报道可导致雌性子代出现POF的现象。
2.2 孕期母体营养与疾病 母体营养与胎儿健康问题密切相关,可从不同方面影响胎儿脏器发育与功能,并介导成年疾病的宫内起源。育龄妇女脂肪摄入过多是一个全球性的健康问题。研究显示,孕期母体高脂饮食诱导猪雌性胎儿卵巢氧化应激、凋亡抑制因子表达降低、卵泡数量减少和细胞凋亡增加,易导致子代卵泡池过早耗竭[22],子代成年后卵泡闭锁增多,引起POF[23]。同时有研究表明,孕期母体营养不良也会引起胎儿卵巢功能障碍,原始卵泡和颗粒细胞中的凋亡因子表达增加、卵母细胞凋亡增多,对子代成年后生殖功能产生不利影响,出现POF表型[24]。孕期母体低蛋白饮食会导致子代DOR[25]。孕期母体疾病对胎儿发育也会造成一定影响。有研究显示,母体妊娠期糖尿病可通过抑制胎儿生长、细胞周期停滞和诱导细胞凋亡来削弱子代减数分裂和卵巢发育,增加卵泡池过度激活和POF的风险[26]。
3 胎源性POF的宫内编程机制
3.1 神经内分泌编程 卵巢发育受卵巢局部因子的调控。卵巢局部的IGF1是调节卵泡发育和类固醇合成酶表达的重要因子。卵巢IGF1信号抑制会导致类固醇合成酶表达降低和卵巢发育异常。根据不同的细胞类型,IGF1通过作用于IGF1R,进而激活磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)和(或)丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)/细胞外信号调节激酶(extracellular signal regulated kinase,ERK)通路发挥促细胞增殖作用。有研究应用特异性PI3K或ERK抑制剂,发现IGF1/IGF1R主要通过PI3K/AKT通路(非MAPK/ERK通路)诱导绵羊卵巢颗粒细胞增殖、类固醇合成酶表达及E2合成[27]。我室的前期研究也证实,孕期地塞米松暴露可抑制雌性胎鼠卵巢IGF1/IGF1R/PI3K/AKT级联通路及细胞增殖,卵巢内卵泡发育不良,雌激素合成减少,且这些改变还可以持续到子三代[18]。
雌激素、糖皮质激素(glucocorticoid,GC)、HPO轴等神经内分泌激素或神经内分泌轴也在卵巢发育中发挥重要作用。通过使用灵长类动物狒狒模型进行人类繁殖的研究发现,胎盘雌激素水平能调节胎儿卵巢的卵泡发育[28]。影响HPO轴的调节功能可直接损伤卵巢颗粒细胞,干扰卵巢性激素分泌,从而导致动情周期和卵泡发育的异常。据报道,妊娠期高GC水平可能通过影响胎儿HPO轴发挥内分泌干扰作用,该作用可能通过影响3个层面进行:①卵巢性激素(E2、孕酮)的分泌与调节;②垂体Gn(FSH、LH)的分泌与调节;③下丘脑GnRH的分泌与调节。还有研究报道,孕期乙醇暴露致雌性子代HPO轴发育和功能受到干扰,动情周期和性激素分泌紊乱[29]。孕期母体营养不良也能通过改变HPO轴来编程后代的生殖潜力,出现POF表型。当母体暴露于内分泌干扰物时,可通过影响类固醇生成基因的表达,引起神经内分泌轴中的激素变化,从而导致子代卵泡闭锁增多[30]。提示母体通过影响子代的神经内分泌编程而影响子代卵巢内卵泡的发育,甚至出现卵泡闭锁增加,雌激素水平下调等POF的病理症状。我室研究也发现,孕期地塞米松暴露对子一代及子三代子代大鼠的血清雌激素水平、卵巢类固醇合成酶均有抑制作用,且FSH水平明显升高,提示地塞米松可能通过改变子代神经内分泌编程从而影响卵巢发育,最终导致POF的跨代遗传效应[18]。
3.2 表观遗传修饰异常 表观遗传是指DNA序列不发生改变而基因表达模式和生物表型却出现了可遗传的改变,主要涉及DNA甲基化、微小RNA(microRNA,miRNA)、染色质重塑等。已有证据表明,POF可能受表观遗传调控[31]。随着每个卵泡被招募到增长的卵泡池中,卵母细胞建立了相关的印记模式。若在印记建立过程中暴露于不良环境,就会破坏其印记模式,伴随胚胎及胎盘中相关基因表达改变和发育异常[32]。
胚胎早期发育的两个阶段,配子发生和胚胎发生时期均具有较高的DNA甲基化活性。哺乳动物的正常发育需要DNA甲基转移酶(DNA methyltansferases,DNMTs)的作用来重新建立和维持基因组内的DNA甲基化。DNMTs的表达水平受到高度调节,并在出生后卵巢发育的特定阶段达到峰值。因此,DNMTs的表达水平可用于评估卵巢的表观遗传状态。还有研究发现,孕期雄激素暴露会导致子代卵巢的异常发育,黄体数目减少。进一步研究发现与卵泡、女性生殖器和生殖细胞发育密切相关的基因呈现甲基化异常状态,如B细胞淋巴瘤因子2(B-cell lymphoma2,Bcl2)基因等。胎儿发育期间短暂暴露于杀虫剂甲氧滴滴涕(methoxychlor,MXC)会改变卵巢的甲基化状态[33]以及一些特定基因如IGF1的表达[34],引起卵巢功能紊乱。生命早期暴露于内分泌干扰物对HPO轴相关基因DNA甲基化和表达具有终身影响,同时引起生殖衰老[35]。
越来越多的证据表明,围生期及孕期生活方式因素,如肥胖或营养不良、吸烟、过量饮酒和摄入咖啡因以及在配子生产过程中使用软性毒品如摇头丸等会诱发子代表观遗传改变[36]。胚胎发育期暴露于不良环境导致卵巢长期且不可逆变化,卵巢功能基因表达的表观遗传异常可能是其潜在机制。卵巢含有卵母细胞和多种体细胞类型,如颗粒细胞、卵泡膜细胞和卵丘细胞,其miRNA的表达和功能与不同细胞类型相关,亦与卵巢的功能发育密切相关。miR-23a在POF患者血浆中上调,并且miR-23a过表达降低X连锁凋亡抑制蛋白和caspase-3水平,增加人颗粒细胞凋亡[37]。孕期暴露于BPA也可以调节女性胎儿卵巢中的miRNA表达[38]。已证实,Kit配体信号传导对于滤泡组装和原始卵泡储备库的正确建立非常重要[39]。羊暴露于BPA会导致SOX家族基因、kit配体和胰岛素相关基因的miRNA表达降低[40],Kit配体的miRNA沉默可能导致卵泡发生异常,并可以解释在暴露于环境雌激素动物中所观察到的生育力缺陷。我室发现,孕期尼古丁暴露导致子代卵巢P450arom的H3K9和H3K27乙酰化位点水平降低,出现E2水平下降伴随细胞凋亡增加、卵泡闭锁增多的POF表型[41]。
4 展望
卵巢发育是一个精密而复杂的过程,受遗传、外源物等多种因素的调控和影响。生活习惯、社会及心理等诸多因素均能引起POF,并存在多激素、多基因、多机制的调控模式。孕期不良环境不仅会影响母体的健康,更会对其子代卵巢发育带来诸多不利的影响。探索已知影响卵巢发育的调节因素与胎源性卵巢疾病的关系,深入阐明胎源性POF的宫内编程机制,将为解释胎源性卵巢疾病的发生提供确凿证据,对于深刻理解卵巢发育异常的宫内起源,探寻早期预警标志物和防治靶标,均具有一定的理论价值和现实意义。
