水产品中孔雀石绿BA-ELISA检测方法的建立及应用
2019-09-16杨光昕苏悦李冰莲孔聪黄宣运张璇于慧娟韩峰
杨光昕,苏悦,李冰莲,孔聪,黄宣运,张璇,于慧娟*,韩峰
(1.中国水产科学研究院东海水产研究所,上海 200090; 2.上海理工大学环境与建筑学院,上海 200093)
孔雀石绿(malachite green,MG)是一种人工合成的三苯甲烷类工业染料,在水产养殖中常被用作抗菌剂、杀虫剂和防腐剂。但MG可在生物体内蓄积,具有致癌、致畸、致突变作用,且其主要代谢物隐性孔雀石绿(leuco malachite green,LMG)在生物体内残留时间较长,毒性更强[1]。因此,包括中国在内的多个国家或地区均将其列为水产养殖中的禁用药,规定水产品中不得检出MG。但由于MG抗菌效果好、廉价易得,部分养殖户仍在违规使用,导致市场上在售的水产品中MG仍偶有检出,严重威胁了消费者的身体健康[2]。
目前用于检测水产品中MG的方法主要有液相色谱法[3-5]和液相色谱-质谱联用法[6-8],虽然这些方法灵敏度及准确度较高,但所需仪器价格昂贵,检测成本高、周期长,不适于快速高通量分析检测。免疫分析方法具有操作快速便捷、成本低、灵敏度高及高通量等优点,目前已广泛应用于食品中污染物的分析检测[9-12]。
生物素-亲和素放大酶联免疫方法(BA-ELISA)是将生物素-亲和素系统(BAS)与ELISA相结合的免疫分析方法,该方法将生物素标记在抗体上,由于每个亲和素可以和多个生物素化大分子结合,再结合酶的放大作用,双重信号放大作用有效提高了传统ELISA方法的灵敏度[13-16]。黄登宇等[17]建立了竞争BA-ELISA方法检测动物组织中的呋喃西林代谢物,该方法重现性好,灵敏度较ELISA方法提高了近一个数量级。Sun等[18]建立了检测饮料中邻苯二甲酸二异辛酯的BA-ELISA体系,最低检测限IC10可达0.007 4 μg/L,灵敏度较ELISA有了较大提高。Bu等[19]建立了检测水中溴代阻燃剂的BA-ELISA体系,该方法快速便捷,灵敏度可达0.006 7 ng/mL。较高的灵敏度和便捷性使得BA-ELISA在食品中污染物的快速分析筛查方面具有较好的应用前景。然而,目前该方法在水产品中污染物的分析检测中应用相对较少,因此,本研究在制备生物素化抗体的基础上,拟通过优化实验条件,建立检测水产品中MG含量的BA-ELISA方法,实现水产品中MG残留量的快速分析筛查。
1 实验部分
1.1 试剂材料与仪器
明胶、辣根过氧化物酶标记的链霉亲和素(SA-HRP)和96孔酶标板均购自生工生物工程(上海)股份有限公司;亲和素、链霉亲合素和N-羟基琥珀酰亚胺生物素(BNHS)购自sigma公司;3,3′,5,5′-四甲基联苯胺 (TMB)和H2O2购自国药集团化学试剂有限公司;MG、LMG、结晶紫、无色结晶紫、亚甲基蓝、灿烂绿和隐性灿烂绿等标准品购自德国Dr. Ehrenstorfer公司;抗MG单克隆抗体及其包被原购自上海药巢生物工程有限公司;实验室用水为超纯水;样品来自本实验室采样留存样品,均为鳜(Sinipercachuarsi)的阳性样品。
主要仪器:Mnitiskan MK3酶标仪、高效液相色谱三重四极杆质谱仪(赛默飞世尔(上海)仪器有限公司);高速离心机(湘仪公司)。
1.2 生物素化抗体制备
用碳酸盐缓冲液(CBS) (0.1 mol/L, pH 9.6)将抗MG单克隆抗体(3 mg/mL)稀释至1.5 mg/mL,取1 mL于锥形瓶中,加入210 μL 二甲亚砜(DMSO)溶解的BNHS溶液(1 mg/L),室温下缓慢搅拌4 h;将反应后的溶液转至透析袋中,用PBS作为透析液透析2 d,每天换水3~4次;透析后所得溶液即为生物素化抗体,置于-20 ℃冷冻保存,备用。
1.3 方法参数优化
本实验分别优化了包被原和抗体工作浓度、封闭液、温育时间、盐离子强度及pH等参数。其中,包被原和抗体的最佳工作浓度采用棋盘法优化,封闭液组成、温育时间、助溶剂浓度及盐离子强度等实验条件通过单因素实验优化。
用CBS将包被原稀释至5个浓度梯度,分别为1∶500、1∶1 000、1∶2 000、1∶4 000及1∶8 000,用PBS将抗体稀释至7个浓度梯度,分别为1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000及1∶32 000。在封闭液优化实验中,选择5%脱脂奶粉、0.5% PEG20 000、1% OVA、0.5%明胶、1%明胶和2%葡萄糖6种封闭液;在抗原与生物素化抗体反应阶段,37 ℃下分别温育15、30、45、60、75、90、105和120 min,优化温育时间;分别以盐离子强度为0.05、0.1、0.5、1.0、1.5和2.0 mol/L的PBS为抗原抗体反应缓冲液,优化最佳盐离子强度;此外,分别以pH值为6、7、8、9和10的PBS为抗原抗体反应缓冲液,优化最佳缓冲液pH值。所有的单因素实验均以IC50和A0max为判定指标进行优化,其中IC50为目标物对抗体的抑制率为50%时所对应的浓度,A0max为最大OD值。
1.4 BA-ELISA方法建立
BA-ELISA基本操作步骤如下:1)用CBS将包被原稀释至适当浓度,将稀释后的包被原加入酶标板(每孔100 μL)中,4 ℃下包被过夜;2)用PBST缓冲液洗涤后,每孔加入200 μL封闭液,37 ℃下温育1 h;3)用PBST缓冲液洗涤后,依次加入50 μL待测样品,50 μL适当浓度的生物素化抗体,37 ℃下温育适当的时间;4)PBST洗涤后,用PBST将SA-HRP 按1∶1 000比例稀释,取稀释后的SA-HRP加入酶标板(每孔100 μL)中,37 ℃下温育1 h;5)用PBST洗板5次后,分别向每孔中加入100 μL显色液 (TMB),室温下反应15 min;6)加入50 μL硫酸溶液(2 mol/L)终止反应,在酶标仪上测定各孔在450 nm处的吸光度。
由吸光值计算抑制率,进而反推计算样品中的MG含量。抑制率=(1-A/A0)×100%,其中A为有样品存在的孔对应的OD值,A0为没有样品存在的孔的OD值。
1.5 样品前处理
参照王宇等[20]的样品前处理方法,将样品匀浆后,取2 g肉糜于离心管中,加入4 mL对甲苯磺酸溶液,旋涡1 min后超声10 min,4 500 r/min离心6 min,取上清液,重复操作两次,合并上清液,加入2 mL正己烷,旋涡1 min后4 500 r/min离心6 min,下层溶液过0.2 μm滤膜后进行BA-ELISA测试。
1.6 方法特异性
利用交叉反应率(cross reactivity,CR)来考察方法的特异性,CR(%)=100×IC50(MG)/IC50(其他物质)。分别选取与MG结构相似的物质LMG、结晶紫、无色结晶紫、亚甲基蓝、灿烂绿和隐性灿烂绿为交叉反应对象,计算交叉反应率,分析方法的特异性。
2 结果与讨论
2.1 实验条件的优化
2.1.1 抗原抗体浓度优化
抗原抗体反应要遵循一定的量比关系,只有两者比例相当或抗原稍过剩的情况下,反应才能彻底进行。采用棋盘法优化包被原和生物素化抗体的浓度,并选取OD值接近1.00的孔所对应抗原抗体浓度为最佳工作浓度。包被原的初始质量浓度均为1 mg/mL,稀释比例和结果如表1所示。基于节约抗原抗体的原则,包被原的最佳稀释比例是1∶2 000,生物素化抗体的最佳稀释比例为1∶2 000。
表1 包被原和生物素化抗体浓度(稀释倍数)优化
Tab.1 The optimization of coating antigen and biotinylated antibody concentrations
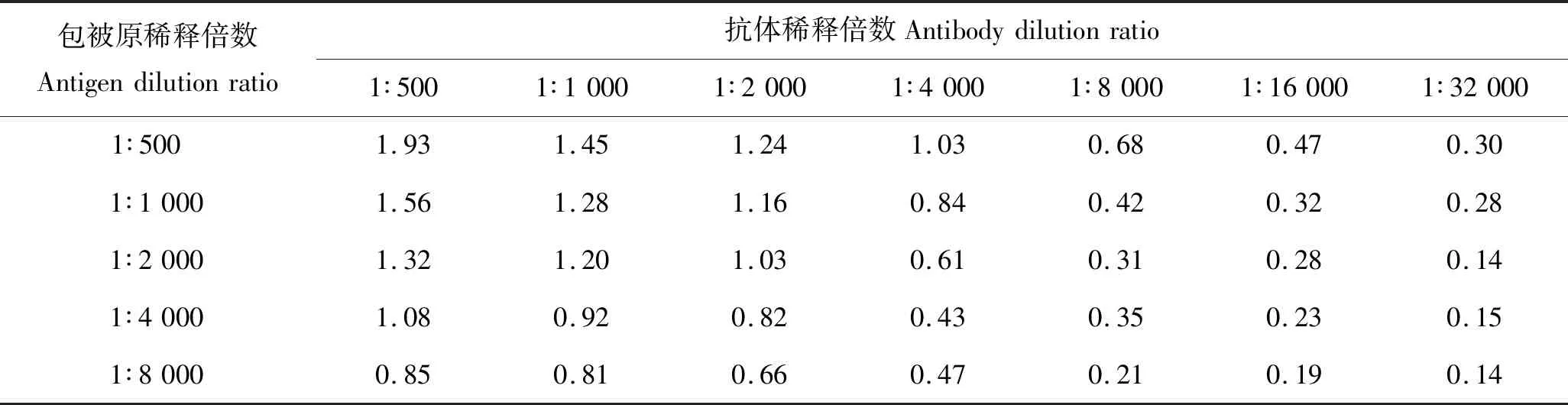
包被原稀释倍数Antigendilutionratio抗体稀释倍数Antibodydilutionratio1∶5001∶10001∶20001∶40001∶80001∶160001∶320001∶500 1.931.451.241.030.680.470.301∶10001.561.281.160.840.420.320.281∶20001.321.201.030.610.310.280.141∶40001.080.920.820.430.350.230.151∶80000.850.810.660.470.210.190.14
2.1.2 封闭液组成优化
封闭液能够有效地降低免疫分析检测中的非特异性吸附和背景值。本实验分别选用5%脱脂奶粉、0.5% PEG20 000、1% OVA、0.5%明胶、1%明胶和2%葡萄糖作为封闭液,通过比较不同封闭液处理后的阴性对照孔的OD值,以 OD值最低时所对应的封闭液为最佳封闭液。结果如图1所示,以1%的明胶为封闭液时阴性对照孔的OD值最低,表明采用该封闭液时,反应中非特异性吸附产生的OD值最小,有效地减少实验中的误差,因此选择该封闭液为最佳封闭夜。
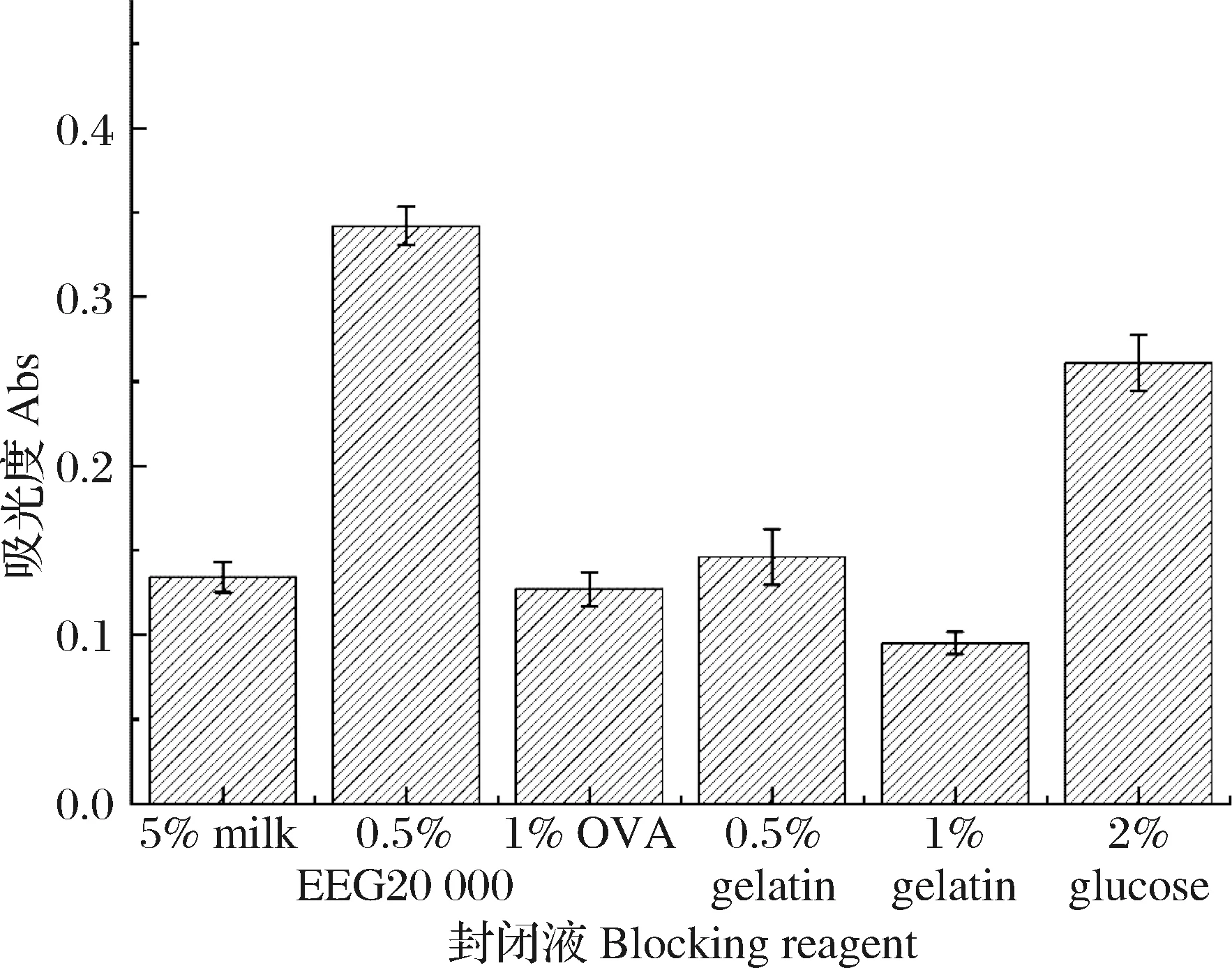
图1 封闭液的优化(n=3)Fig.1 The optimization of blocking reagents(n=3)
2.1.3 抗原抗体反应时间的优化
在抗原与生物素化抗体反应阶段,分别在37 ℃下温育15、30、45、60、75、90、105和120 min,观察抗原抗体反应时间对实验的影响。通过比较不同温育时间所得的IC50和A0max值,IC50值最小且A0max值接近1.00时所对应的温育时间为最佳温育时间[21],结果如图2所示,最佳温育时间为60 min。
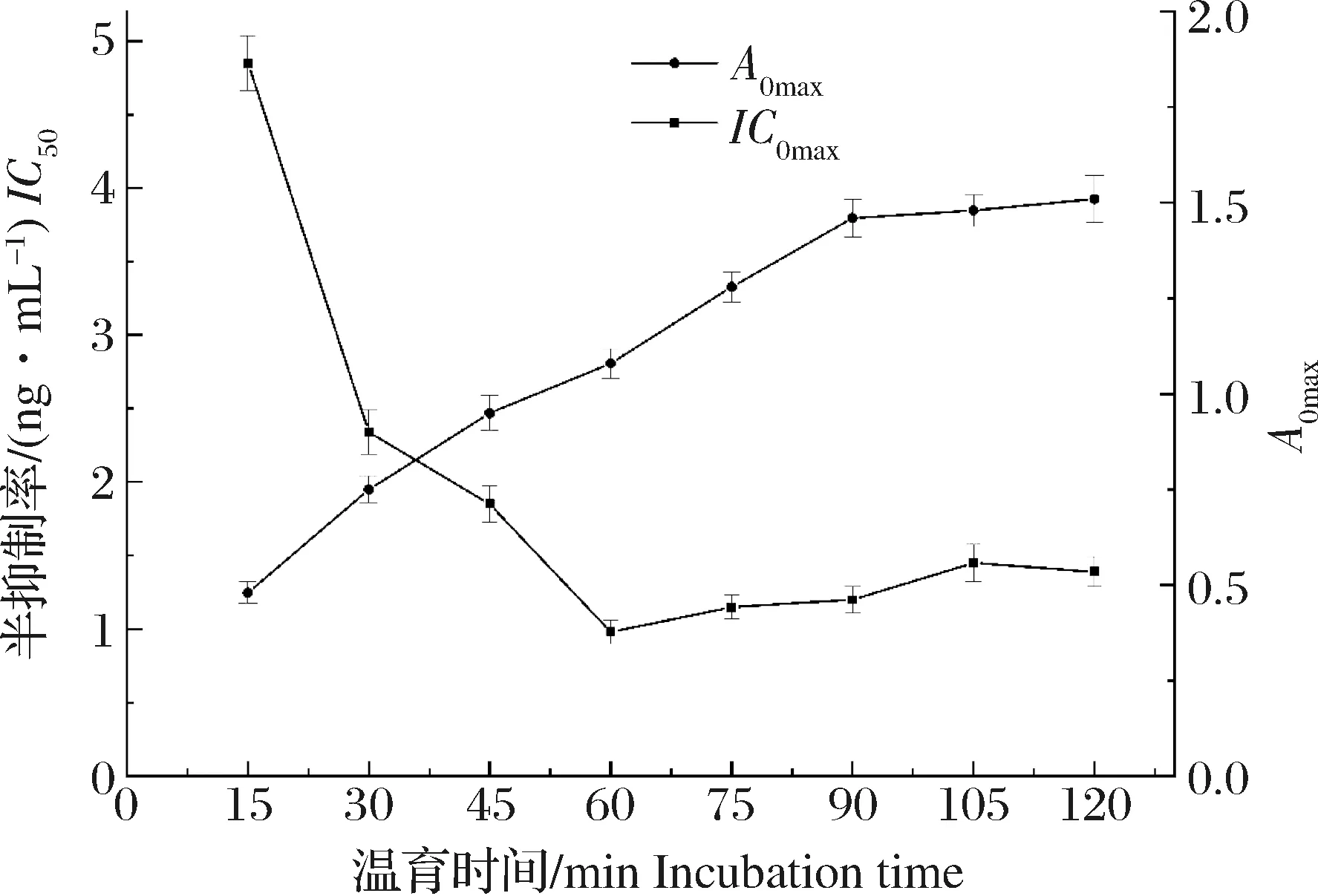
图2 温育时间的优化(n=3)Fig.2 The optimization of incubation time(n=3)
2.1.4 盐离子强度的影响
如图3所示,随着盐离子强度的增加,A0max值逐渐变小,IC50值在盐离子强度为0.1 mol/L时最小,随后逐渐升高。这表明在该离子强度下,方法的灵敏度最高,其原因可能是在此条件下,抗原抗体反应更加充分。因此,本实验选择盐离子强度为0.1 mol/L的PBS为抗体稀释液。
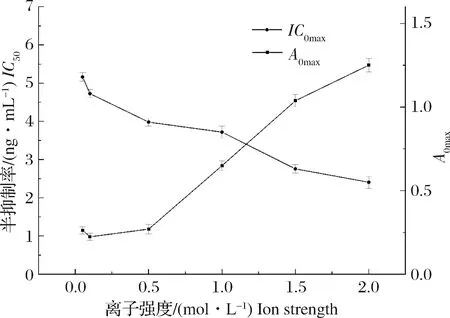
图3 盐离子强度的优化(n=3)Fig.3 The optimization of salt ions intensity in buffers (n=3)
2.1.5 pH的影响
在抗原抗体反应阶段,分别考察了不同pH值的缓冲液对实验的影响,结果如图4所示,当缓冲液pH为7.0时,IC50值最小,为0.98 ng/mL,A0max值为1.08,参照李冰莲等[21]等方法,选择IC50值最小所对应的的pH值为最佳实验条件,因此,本研究选择该pH为7.0的PBS为反应体系缓冲溶液。
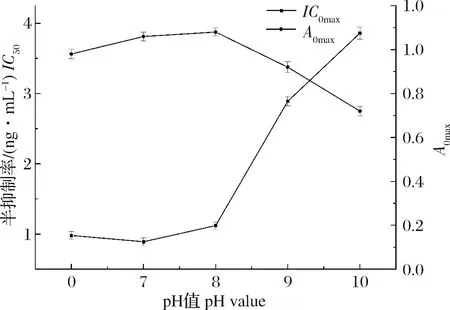
图4 pH的优化(n=3)Fig.4 The optimization of pH values(n=3)
2.2 方法的建立
在最佳实验条件下,即包被原、抗体稀释倍数为1∶2 000,封闭液为1%的明胶,温育时间60 min,盐离子强度为0.1 mol/L,pH值为7.0时,建立检测MG的BA-ELISA方法。将MG标准品稀释为0.01、0.05、0.10、0.50、1.00、5.00、10.00、20.00和50.00 ng/mL,各浓度的标准溶液均参照1.4参与样品前处理。以MG质量浓度的对数值为横坐标x,以抑制率为纵坐标y,制作标准曲线。结果如图5所示,该方法的线性范围为0.05~20.00 ng/mL,标准曲线为y=30.02x+53.98(R2=0.99),以IC20(目标物对抗体抑制率为20% 时对应的浓度)为本方法的最低检测限,IC20为0.074 ng/mL,即0.037 μg/kg。该方法与ic-ELSA相比[22],灵敏度提高了一个数量级,与现行国家标准方法相比较(GB/T 19857—2005),灵敏度提高了近10倍。
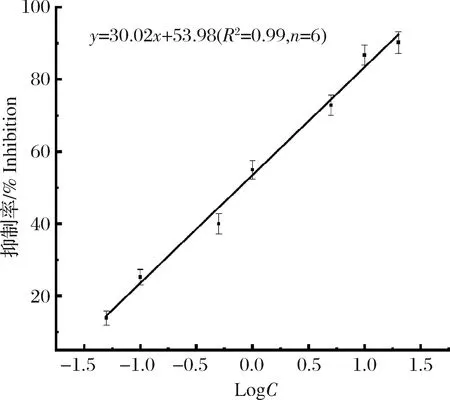
图5 BA-ELISA检测MG的标准曲线Fig.5 Standard curve of BA-ELISA for MG determination
为了检验该方法的稳定性,重复8次独立的实验,在每个独立的实验中,每个浓度重复6次,由此计算每个浓度的板内变异系数和板间变异系数。该方法的板内变异系数为4.22%~9.39%,板间变异系数为4.58%~10.15%,说明该方法具有较好的稳定性。
2.3 样品检测
分别用建立的BA-ELISA和国家标准方法GB/T 19857—2005 中的液质联用法检测实际样品中的MG,样品为本实验室采样留存的8个鳜阳性样品,每个样品同时做6个平行样,结果如表2所示。经比较,BA-ELISA可以准确地筛选出含有MG残留的阳性样品,这也表明该方法具有较好的准确性,可以用于实际样品中MG的快速筛选检测。
表2 BA-ELISA法和LC/MS法检测实际样品中的MG含量
Tab.2Content of MG detected by BA-ELISAand LC/MS methods in actual samplesn=6
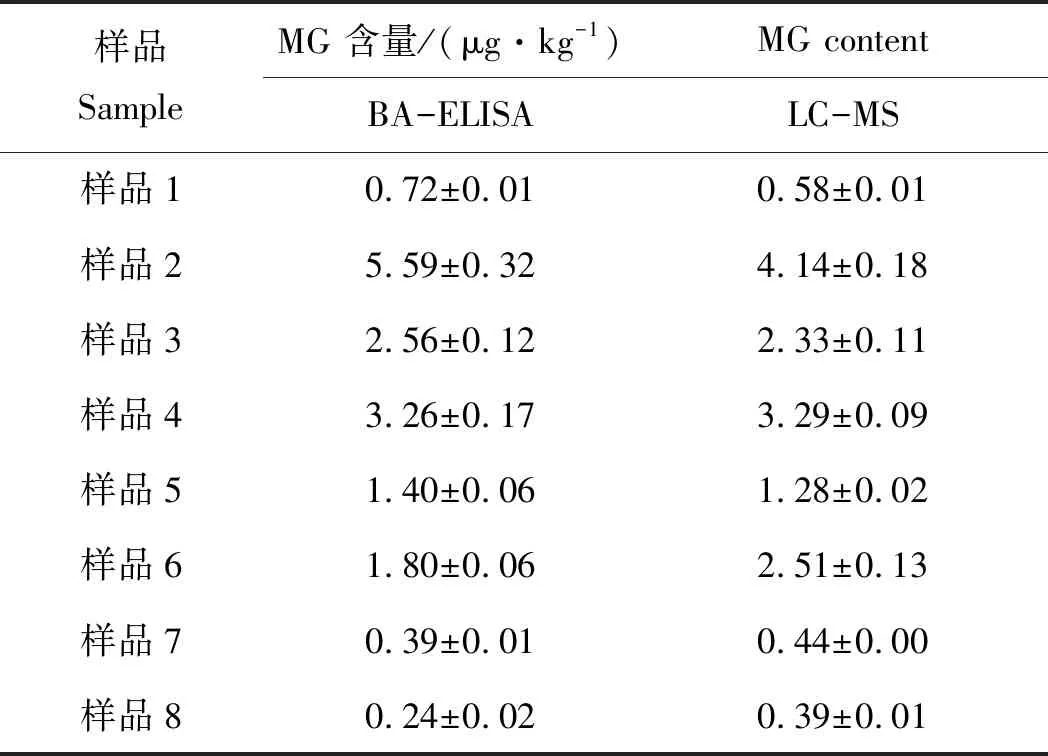
样品SampleMG 含量/(μg·kg-1)MG contentBA-ELISALC-MS样品10.72±0.010.58±0.01样品25.59±0.324.14±0.18样品32.56±0.122.33±0.11样品43.26±0.173.29±0.09样品51.40±0.061.28±0.02样品61.80±0.062.51±0.13样品70.39±0.010.44±0.00样品80.24±0.020.39±0.01
2.4 回收率
在已知MG浓度的样品(样品2、5和8)中分别加入系列浓度的MG标准溶液,经前处理后,用建立的新方法测定样品中MG的加标回收率。结果如表3所示,样品中添加0.1-10.0 μg/kg含量水平时,回收率为83.5%~115.0%,变异系数CV为4.53%~13.80%,这表明该方法准确度和精密度较高。
表3 基于BA-ELISA检测加标样品中MG的回收率
Tab.3 Recoveries of MG detected by BA-ELISA spiked sediment samples
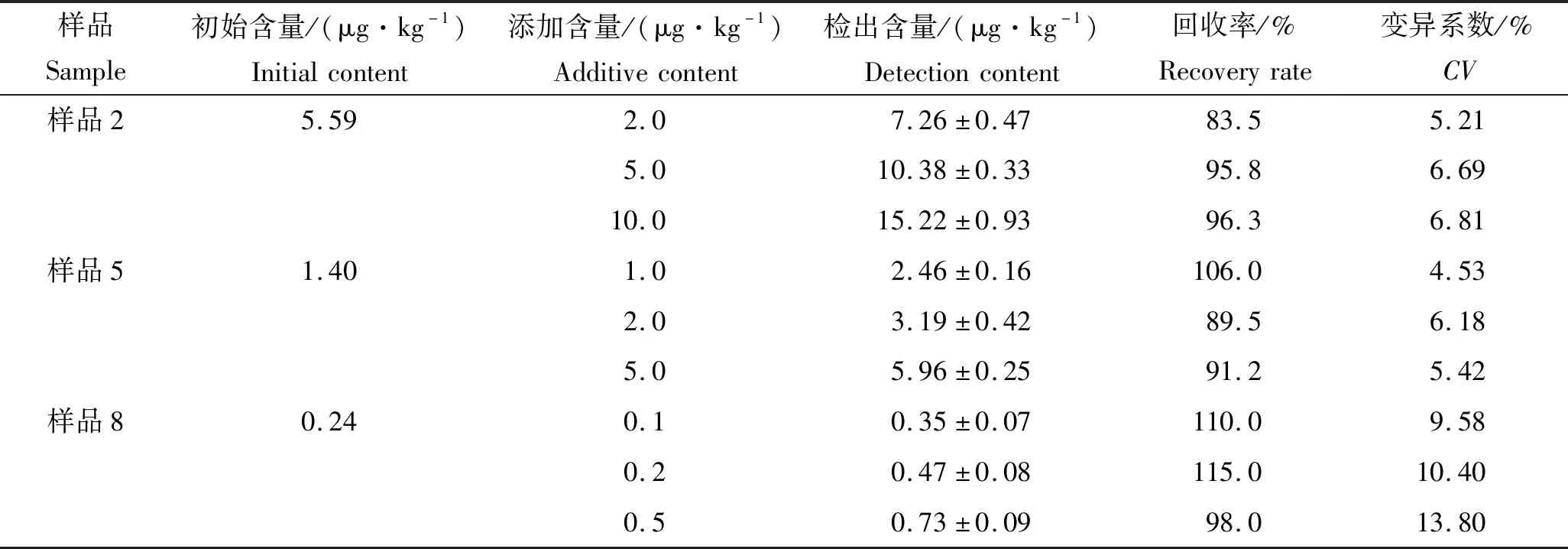
样品Sample初始含量/(μg·kg-1)Initialcontent添加含量/(μg·kg-1)Additivecontent检出含量/(μg·kg-1)Detectioncontent回收率/%Recoveryrate变异系数/%CV样品25.592.07.26±0.4783.55.215.010.38±0.3395.86.6910.015.22±0.9396.36.81样品51.401.02.46±0.16106.04.532.03.19±0.4289.56.185.05.96±0.2591.25.42样品80.240.10.35±0.07110.09.580.20.47±0.08115.010.400.50.73±0.0998.013.80
注:CV中数值为6组平均数。
2.5 特异性分析
分别选取与MG结构相似的物质LMG、结晶紫、无色结晶紫、亚甲基蓝、灿烂绿和隐性灿烂绿为交叉反应对象,分析方法的特异性,交叉反应率越低,方法特异性越好。该方法对LMG、无色结晶紫、亚甲基蓝、灿烂绿和隐性灿烂绿的交叉反应率均小于5%,对结晶紫的交叉反应率为115.0%,这表明该方法对MG和结晶紫均有较好的选择性,可以用来检测和筛选样品中的MG和结晶紫。
3 结论
本研究建立了基于生物素和链霉亲和素放大系统的酶联免疫吸附法检测水产品中MG含量的方法,优化了包被原和抗体工作浓度、封闭液、温育时间、盐离子强度和pH值等实验条件,并选择包被原、抗体稀释倍数1∶2 000,封闭液为1%的明胶,温育时间60 min,盐离子强度为0.1 mol/L,pH值为7.0为最佳实验条件。在此条件下,建立的BA-ELISA方法可有效检测水产品中的MG含量,其线性范围为0.05~20.00 ng/mL,最低检出限为0.037 μg/kg,回收率为83.5%~115.0%,CV为4.53%~13.80%。特异性实验表明,该方法对结晶紫的交叉反应率为115.0%,对LMG、无色结晶紫、亚甲基蓝、灿烂绿和隐性灿烂绿的交叉反应率均小于5%。综上所述,该方法具有较高的灵敏度和准确度,特异性良好,且96孔酶标板的使用更加提高了检测效率,可以用于水产品中痕量MG的快速高通量分析筛查。
