基于胃肠组织cAMP/PKA信号转导通路变化研究大鼠脾气虚证模型与线粒体损伤模型的相关性
2019-09-13王莹贾连群宋囡马艺鑫具星杨关林
王莹 , 贾连群 , 宋囡 , 马艺鑫 , 具星 , 杨关林
(1.辽宁中医药大学中医脏象理论及应用教育部重点实验室,辽宁沈阳 110847;2.辽宁省中医转化医学研究中心,辽宁沈阳 110847)
本课题组前期研究发现,脾气虚模型大鼠胃肠组织环磷酸腺苷——蛋白激酶A(cyclic adenosine monophosphate-protein kinase A,cAMP-PKA)信号转导通路发生变化[1,2]。cAMP-PKA途径是参与物质能量代谢的主要细胞传导通路[3],而线粒体是细胞能量生成的主要场所,是机体进行能量代谢的主要部位。中医脾为“气血生化之源”,可见,其“主运化”与线粒体能量代谢功能密切相关。研究表明,鱼藤酮处理可导致细胞线粒体产生氧化功能损伤,能量供给不足[4,5],是线粒体呼吸链上复合体I的经典抑制剂之一。故本研究将继续以cAMP-PKA信号转导通路作为切入点,通过比较脾气虚证模型与不同剂量鱼藤酮线粒体损伤模型大鼠胃肠线粒体cAMP-PKA通路相关基因及蛋白表达变化之相关性,来探讨脾气虚模型成模及其相关线粒体的可能机制,以期为临床脾气虚证的治疗提供理论基础,现将研究结果报道如下。
1 材料与方法
1.1动物SPF级雄性SD大鼠30只,体质量(200±10)g,购于本溪实验动物中心,动物质量合格证号:SCXK(辽)-2010-0001。SD大鼠饲养于辽宁中医药大学实验动物中心SPF级环境中,饲养条件符合国家二级标准,饲养室内的温度保持在(22±2)℃,相对湿度维持在(55±15)%,噪音<60 dB,昼夜明暗交替时间为12 h/12 h,每天经紫外灯照30 min杀菌。
1.2药物、试剂与仪器鱼藤酮油溶液(美国Sigma公司,批号:R8875-1G),由高压灭菌葵花油溶解鱼藤酮至2 mg/kg,配制成2.0、1.5、1.0 mL/kg等3个剂量[6]。抗β-actin抗体(北京中杉金桥公司);抗PKA抗体、抗磷酸化酶激酶(PHK)抗体、抗糖原磷酸化酶(Gp)抗体(美国ABcam公司);实时逆转录聚合酶链反应(RT-PCR)试剂盒(日本TaKaRa公司,code:DRR047A,DRR820A);cAMP酶联免疫吸附分析(ELISA)试剂盒(上海酶联生物科技有限公司,批号:ml002907)。实验所需引物由日本TaKaRa公司设计合成。低速冷冻离心机(美国Thermo公司);BioSpec-nano型紫外可见分光光度计(日本岛津公司);Veriti 96 well Thermal Cycler(美国Applied Biosystems公司);7500 Real Time PCR仪(美国Applied Biosystems公司);多功能酶标仪(德国伯托公司)。
1.3分组与模型复制将30只大鼠随机分为正常组,脾气虚组,鱼藤酮高、中、低剂量组,每组6只。脾气虚证模型的造模方法[7]:采用饮食不节加力竭游泳法,即先饱食1 d,再禁食2 d,3 d为1个循环,期间自由饮水,并每日游泳至力竭,水温35~37℃,连续15 d。若出现食少、神疲乏力、消瘦、毛色枯槁无光泽、便软或溏则表明造模成功。线粒体损伤模型的造模方法[6]:分别给予鱼藤酮高、中、低剂量组大鼠腹腔注射剂量为2.0、1.5、1.0 mL/kg(体质量)的无菌鱼藤酮油溶液,每日1次,连续4周,不限饮食。
1.4指标检测与方法
1.4.1 取材 造模结束后处死大鼠,取整个胃窦、5 cm空肠组织放入EP管中,-80℃保存。
1.4.2 采用ELISA法测定胃肠组织cAMP含量 分别称取大鼠胃窦、空肠组织,匀浆,2 500 r/min离心20 min,取上清。根据试剂盒说明,绘制标准曲线,计算cAMP含量。
1.4.3 蛋白免疫印迹(Western blot)方法测定胃肠组织PKA、PHK、Gp蛋白表达 分别称取大鼠胃窦、空肠组织100 mg,仔细剥离附着肌肉、结缔组织等,加入1 mL预冷裂解液(含1%PMSF)充分匀浆,匀浆液于4℃12 000 r/min离心10 min。BCA法测定上清蛋白含量后,上样,进行十二烷基硫酸钠——聚丙烯酰胺凝胶电泳(SDS-PAGE)1 h,转膜1 h,封闭1 h,一抗(稀释1∶1 000)孵育4℃过夜。次日二抗(稀释1∶2 000)孵育1 h后,于暗室中加入ECL发光液,后曝光30 min,扫描图像后进行分析。数据结果以目的蛋白PKA、PHK、Gp与内参β-actin条带的光密度比值(p)表示。
1.4.4 实时RT-PCR法测定胃肠组织PKA、PHK、Gp mRNA表达 分别称取大鼠胃窦、空肠组织100 mg,仔细剥离附着肌肉、结缔组织等,Trizol法提取其总RNA,其光密度(D)(260 nm)/D(280 nm)均在1.8~2.2。反转录反应体系:总RNA 4 μL, 5×PrimeScript Buffer(for real time)2 μL, PrimeScript RT Enzyme Mix Ⅰ 1 μL, RT Primer Mix 1 μL,RNase Free dH2O 4 μL。反应条件:37℃15 min,85℃5 s。cDNA扩增反应体系。RNase Free dH2O 9.5 μL,上、下游引物(序列见表 1)各 0.5 μL,SYBR Premix Ex TaqⅡ 12.5 μL,cDNA 2 μL。反应条件:95 ℃ 2 min,95 ℃30 s,60℃30 s,40个循环。根据NTC反应有无荧光信号检出并结合熔解曲线,确认反应体系是否有污染。标准曲线的相关系数(R2)>0.98,扩增效率(E)应在0.8~1.2范围。采用2-△△Ct法对PKA、PHK、Gp基因表达进行相对定量(p),以β-actin为内参。

表1 PCR引物序列Table 1 PCR primer sequences
1.5统计方法采用SPSS 19.0统计软件进行数据分析。数据类型属于计量资料,均以均数±标准差(-x±s)表示,多组比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠胃、肠组织cAMP含量比较表2结果显示:与正常组比较,脾气虚组及鱼藤酮高、中、低剂量组大鼠胃、肠组织cAMP含量均明显降低(P<0.01);与脾气虚组比较,鱼藤酮高剂量组肠组织cAMP含量及鱼藤酮中剂量组胃、肠组织cAMP含量的差异均无统计学意义(P>0.05)。
2.2各组大鼠胃、肠组织PKA、PHK、Gp蛋白表达比较图1、2,表3、4结果显示:与正常组比较,脾气虚组及鱼藤酮高、中、低剂量组大鼠胃、肠组织PKA、PHK蛋白表达水平均降低,除鱼藤酮低剂量组PHK蛋白表达差异无统计学意义(P>0.05)外,其他差异均有统计学意义(P<0.05),Gp蛋白有降低趋势,但差异均无统计学意义(P>0.05);与脾气虚组比较,鱼藤酮中、低剂量组胃、肠组织PHK,鱼藤酮低剂量组胃组织PKA,鱼藤酮中剂量组肠组织PKA及鱼藤酮高、中、低剂量组大鼠胃、肠组织Gp蛋白表达水平的差异均无统计学意义(P>0.05)。
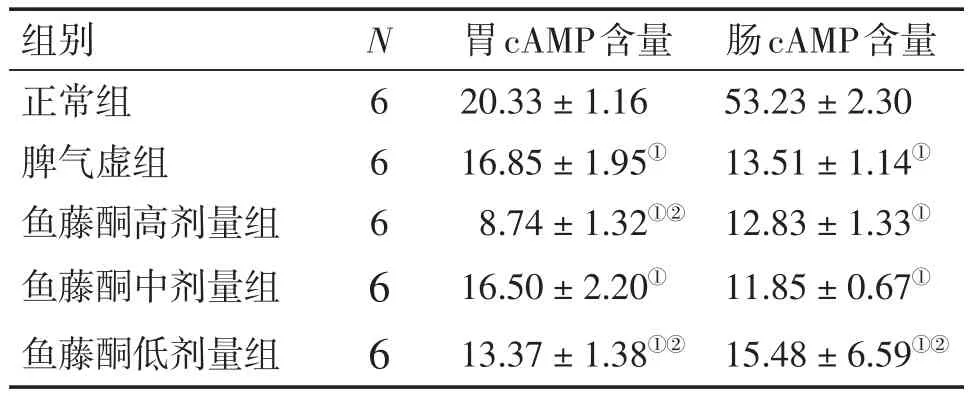
表2 各组大鼠胃、肠组织cAMP含量比较Table 2 Comparison of cAMP content in gastrointestinal tissues of various groups[-x±s,c/(pmol·mL-1)]
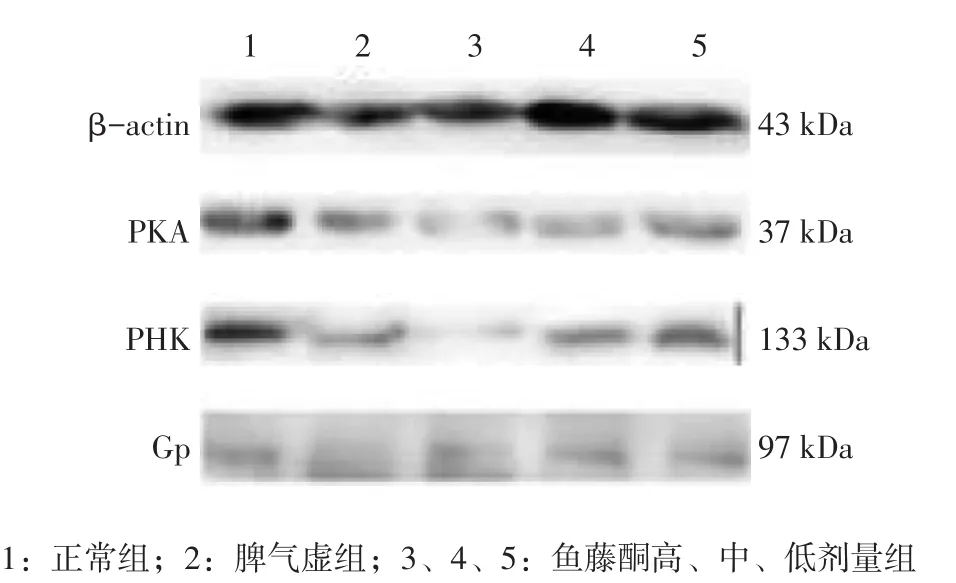
图1 各组大鼠胃组织PKA、PHK、Gp蛋白的Western blot电泳条带Figure 1 The Western blot strips of PKA,PHK and Gp proteins in gastric tissues of various groups
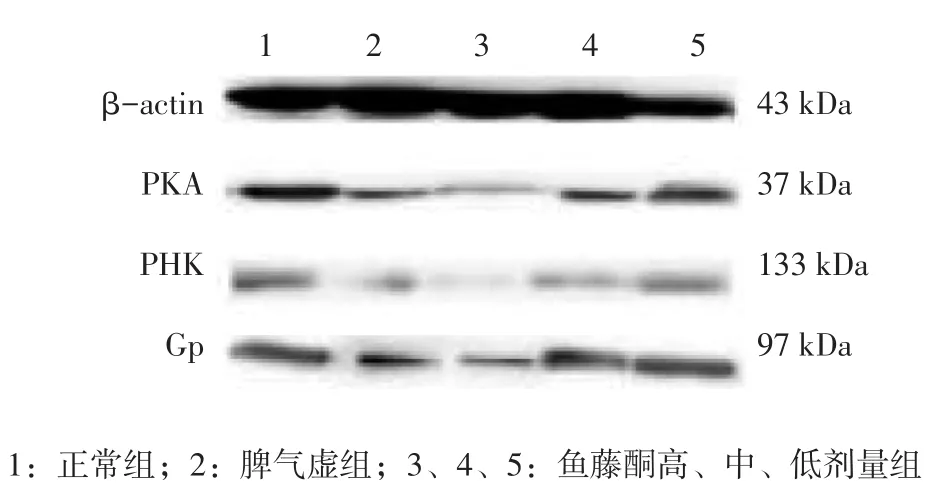
图2 各组大鼠肠组织PKA、PHK、Gp蛋白的Western blot电泳条带Figure 2 The Western blot strips of PKA,PHK and Gp proteins in intestinal tissues of various groups

表3 各组大鼠胃组织PKA、PHK、Gp蛋白的表达比较Table 3 Comparison of the protein expression levels of PKA,PHK and Gp in gastric tissues of various groups (-x±s,p)
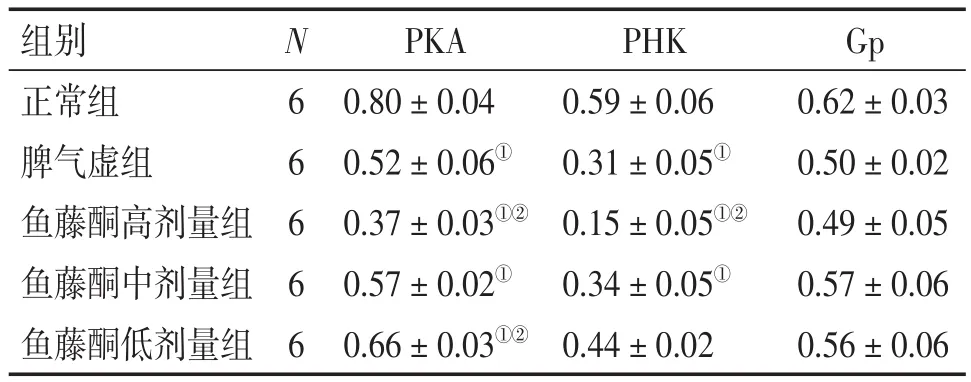
表4 各组大鼠肠组织PKA、PHK、Gp蛋白的表达比较Table 4 Comparison of the protein expression levels of PKA,PHK and Gp in intestinal tissues of various groups (-x±s,p)
2.3各组大鼠胃、肠组织PKA、PHK、Gp mRNA表达比较表5、6结果显示:与正常组比较,脾气虚组及鱼藤酮高、中、低剂量组大鼠胃、肠组织PKA、PHK、Gp mRNA表达水平均降低,除脾气虚组肠组织Gp mRNA,鱼藤酮低剂量组胃组织PKA mRNA及肠组织PHK、Gp mRNA表达差异无统计学意义(P>0.05)外,其他差异均有统计学意义(P<0.05);与脾气虚组比较,鱼藤酮高、中剂量组大鼠胃组织及鱼藤酮高、中、低剂量组肠组织PKA、PHK、Gp mRNA表达水平的差异均无统计学意义(P>0.05)。
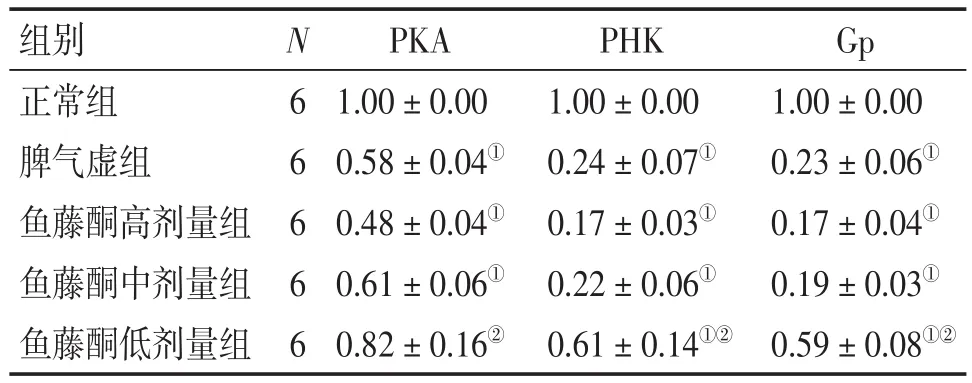
表5 各组大鼠胃组织PKA、PHK、Gp mRNA表达比较Table 5 Comparison of the mRNA expression levels of PKA,PHK and Gp in gastric tissues of various groups (-x±s,p)

表6 各组大鼠肠组织PKA、PHK、Gp mRNA表达比较Table 6 Comparison of the mRNA expression levels of PKA,PHK and Gp in intestinal tissues of various groups (-x±s,p)
3 讨论
本研究对造模后脾气虚模型大鼠进行评估,大鼠出现明显消瘦、神疲乏力、反应迟钝、行动缓慢、被毛蓬起无光泽、便软等症状,表明其符合脾气虚动物模型标准。利用线粒体呼吸链酶抑制剂——鱼藤酮复制线粒体损伤大鼠模型与脾气虚模型大鼠相比,也不同程度地出现行动缓慢、消瘦、便软等脾气虚症状。尽管线粒体损伤大鼠模型与脾气虚组组间个别也有差异,但与正常组比较,2组指标变化趋势一致并且差异显著。
“脾主运化”的内涵涵盖了“运”和“化”两方面,其功能的完成主要在胃肠部。脾主运侧重脾对水谷精微的消化、吸收和转运;脾主化则是指脾将吸收的水谷精微,化生精、气、血、津液等营养物质,即物质间的转化及物质转变为能量的过程[8]。本课题组前期已经发现脾虚证大鼠胃组织与cAMP/PKA信号通路有关[1,2]。本研究在本课题组前期研究基础上侧重通过cAMP/PKA信号通路调控作用比较线粒体损伤大鼠与脾气虚证大鼠的胃肠组织中是否存在相关性。
鱼藤酮(rotenone),又称毒鱼藤,是一种没有颜色和味道的酮类结晶化合物[9]。鱼藤酮具有高度脂溶性,不需要依赖多巴胺转运体就可以直接进入胞质内,并选择性地抑制线粒体的呼吸链复合物Ⅰ,使线粒体功能发生障碍,导致细胞氧化应激增强,启动线粒体介导的信号转导通路,诱导细胞凋亡[10]。本研究应用不同剂量鱼藤酮干预,使线粒体能量代谢受碍,复制线粒体损伤模型。
cAMP是细胞内重要的第二信使,发挥着将细胞外刺激信号转化为细胞内各种生理活动的媒介作用,它可与cAMP依赖性的PKA的结合亚基结合,使其激活。激活后的PKA既可以使细胞内多种蛋白质磷酸化而发挥生物学作用,还可以作用于cAMP反应元件结合蛋白,调节基因表达。因此,cAMP/PKA信号转导途径在细胞内机制中占有非常重要的地位[11]。PKA是广泛存在于动物体内的一种蛋白激酶[12],其调节亚基上的2个cAMP结合位点,PKA与cAMP结合后,激活催化亚基,使靶蛋白中的丝氨基酸或苏氨酸磷酸化,从而调节细胞功能[13]。PKA是第二信使cAMP依赖的蛋白激酶,参与调节细胞的分化和增殖、离子转运、新陈代谢的调节、基因转录等过程[14]。Gp是糖原分解代谢中的关键酶,可以促进糖原分解为葡萄糖为机体提供必需的能量,而Gp的活化需要PHK的激活。PHK是一种多亚基蛋白激酶,它是唯一可以使Gp从非活化型转化成活化型的一种酶,所以它对糖原的分解也发挥着重要的作用,同时,PHK的活化需要由PKA来完成[15,16]。近年来,国内外学者对cAMP与中医证型的关系进行了大量的研究,结果表明cAMP在虚证、寒证、热证、血瘀、气滞等不同中医证型中具有不同的变化规律[17-21]。
本研究主要检测了cAMP/PKA-PHK-Gp信号传导通路的各分子表达情况,结果显示:与正常组比较,脾气虚组和不同浓度的鱼藤酮组胃、肠cAMP含量,PHK、PKA、Gp蛋白和mRNA表达均有所下降;与脾气虚组比较,鱼藤酮组中胃、肠组织与脾气虚组胃、肠cAMP含量,PHK、PKA、Gp蛋白和mRNA表达水平均无显著性差异。提示以cAMP/PKA-PHK-Gp信号传导通路为切入点,应用鱼藤酮干预造成线粒体损伤模型与脾气虚证模型信号转导通路的改变具有一定的相似性,二者进行对比可进一步促进脾虚证候研究,这也为中医脏象的生物学机制研究提供了新的方向。下一步我们将继续以线粒体为靶点,对脾藏象开展“微观”与“宏观”相结合的研究,为深入挖掘脾藏象的科学内涵提供依据,从而指导临床诊断和治疗。
