聚乙烯醇双酶降解工艺条件优化
2019-09-13赵一凡李江华堵国成
赵一凡 , 刘 松 , 李江华 *, 堵国成 , 陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
聚乙烯醇(Polyvinyl alcohol,简称 PVA)是一种主要以1,3-二醇键的化学结构存在的、人工合成的高分子化合物,一般无味且呈粉末状。由于PVA具有许多优良特性,如乳化性、成膜性、高粘度、热稳定性等,被广泛应用于纺织、造纸等行业[1-5]。PVA作为纺织工业中织物上浆的浆料,能够使织物不易发生腐蚀和化学变化,同时可以增强织物的韧性。但为了加强棉织物对水的吸收[6],经过上浆工艺的织物在成品前必须经过退浆处理以去除PVA。此外,退浆废水中的PVA亦对环境造成严重的污染[7]。因此,开发PVA高效降解技术成为研究热点。
目前PVA的降解方法主要包括:物理法、化学法和生物法[8]。物理法有泡沫分离、超滤、光催化、微波辐射等技术。尽管这些技术会产生一定的处理效果,但它们操作起来较复杂,投资费用和运行费用都较高,因此工业化应用难度较大[8]。化学法是采用酸、碱或氧化剂在高温条件下破坏PVA的长链结构使其降解,但易对棉纤维造成较大损伤,且能耗高。PVA是为数不多的生物可降解的水溶性材料[9],采用生物方法降解PVA具有运行费用低、二次污染少等优点,具有良好的发展前景。
PVA生物降解包括微生物法和酶法[3]。目前,研究者们得到的可以降解PVA的微生物包括单菌[10-12]、共生菌[13-15]和混合菌[16-17]。一般情况下,对于0.1%~0.5%质量分数的PVA,大多数细菌将其降解90%以上需要3~12 d[9],降解速率较低。就PVA的降解过程而言,其本质上是酶的作用。主要有以下3种已报道的 PVA 降解酶:PVA 氧化酶(SAO,EC1.1.3.30)、PVA 脱氢酶 (PVADH,EC1.1.99.23)和氧化型PVA水解酶 (OPH,EC3.7.1.7)。生物降解PVA过程如下(图1)。第一步:PVA在SAO(以 O2作为电子受体)或PVADH(以 PQQ作为电子受体)的作用下,脱氢氧化生成对应的酮基化合物;第二步:酮基化合物被 OPH水解[18]。其中,对SAO的研究还没有深入到基因水平[19],只停留在野生酶的纯化和性质研究等方面。
在前期工作中,研究室实现了Sphingopyxissp.113P3 PVADH基因[20]和OPH基因[21]的异源高效表达。在此基础上,研究对PVADH和OPH双酶降解PVA的工艺条件进行了优化,实现PVA酶法高效降解。

图1 推测的PVA降解途径Fig.1 Conjectural PVA degradation pathways
1 材料与方法
1.1 材料
1.1.1 菌株 PVA脱氢酶 (PVADH)产生菌P.pastorisGS115/pPIC9K/tPVADH[20]及氧化型PVA水解酶(OPH)产生菌E.coliBL21(DE3)/pET20b(+)/soph[21]为本实验室构建所得。
1.1.2 培养基 YPD液体培养基:葡萄糖20 g/L,蛋白胨 20 g/L,酵母提取物 10 g/L;
YPD固体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母提取物 10 g/L,琼脂 20 g/L;
BMGY液体培养基:甘油10 g/L,蛋白胨 20 g/L,酵母粉 10 g/L,YNB 13.4 g/L,100 mmol/L 磷酸钾缓冲液 pH 6.0,生物素 4×10-3g/L;
BMMY液体培养基:蛋白胨 20 g/L,酵母粉 10 g/L,YNB 13.4 g/L,100 mmol/L 磷酸钾缓冲液 pH 6.0,生物素 4×10-3g/L,甲醇体积分数1%;
LB培养基:酵母粉 5 g/L,蛋白胨 10 g/L,NaCl 10 g/L;
固体LB培养基:酵母粉 5 g/L,蛋白胨 10 g/L,NaCl 10 g/L,琼脂 20 g/L;
TB培养基:酵母粉 24 g/L,蛋白胨 12 g/L,磷酸二氢钾2.3 g/L,磷酸氢二钾12.5 g/L,甘油 5 g/L。
1.2 方法
1.2.1 培养方法 将P.pastorisGS115/pPIC9K/tPVADH活化培养后,以体积分数3%的接种量接入BMGY培养基中,于30℃、200 r/min转速下进行培养。在培养24 h后收集菌体并重悬到BMMY培养基中,以体积分数1%甲醇为唯一碳源,于28℃、200 r/min转速下进行诱导表达。甲醇每24 h补加体积分数1%,在上述条件下诱导120 h。
将重组菌E.coliBL21(DE3)/pET20b(+)/soph接种在LB培养基(含100 μg/mL氨苄青霉素)中,于37℃、200 r/min转速下进行种子发酵。在培养12 h后菌液的OD600达到 4.5~5,以体积分数3%的接种量接种入 TB培养基 (含100 μg/mL氨苄青霉素),进行诱导,于25℃、200 r/min转速下恒温发酵108 h。
1.2.2 响应面实验设计 根据单因素实验和爬坡实验,选择 PVADH 酶量(100~150 U/mL)、pH(7~8)、温度(39~43℃)为自变量,PVA降解率为响应值,应用Design-Expert V 8.0.6软件设计三因素三水平Box-Behnken试验(表1)。
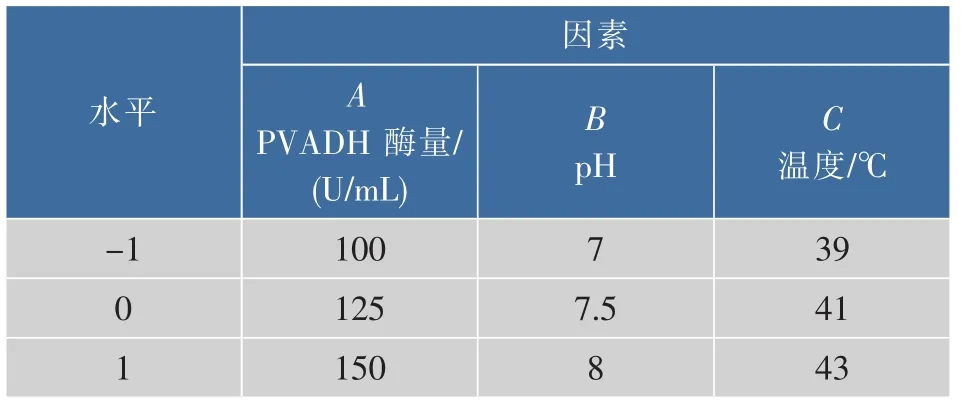
表1 响应面实验因素水平表Table 1 Factors and levels of response surface experiments
自变量与响应变量之间的关系可由一个拟合的二阶多项式方程描述[23]:
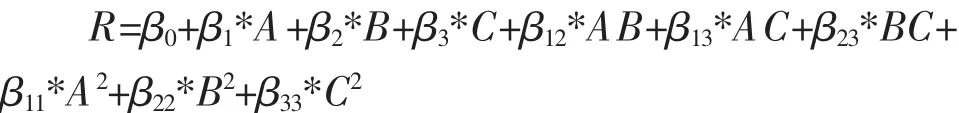
式中,R为PVA降解率(%);A为PVADH酶量的编码值;B为pH的编码值;C为酶反应温度的编码值;β0为常数项系数;β1、β2、β3为线性系数;β11、β22、β33为二次项系数;β12、β13、β23为交互系数。
1.2.3 PVA浓度检测方法 PVA浓度的测定(用改良的Finley法[22]):在10 mL比色管中分别加入待测样品400 μL,25 g/L的硼酸3 mL和0.1 mol/L I2-KI 0.3 mL,用去离子水定容到10 mL,混匀后放于室温下避光静置10 min,在690 nm处测定其吸光值。PVA降解率计算如下式(1):
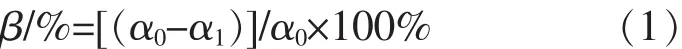
式(1)中,β为PVA降解率,α0为反应前的 PVA质量浓度(g/L),α1为反应后的 PVA 质量浓度(g/L)。
2 结果与分析
2.1 单因素实验
为优化PVA的降解条件,研究了PVADH酶量、OPH酶量、酶反应温度、pH、Ca2+浓度和底物质量浓度对PVA降解率的影响。单因素实验的初始条件为:PVADH 150 U/mL、OPH 10 U/mL、酶反应温度37℃、pH 7、Ca2+浓度1 mmol/L、 底物PVA质量浓度 1 g/L,PQQ 浓度 6 μmol/L,反应 1 h。
初始条件下,研究PVADH酶量和OPH酶量对PVA降解的影响。结果显示,PVADH酶量在0~200 U/mL的范围时,PVA的降解率随着PVADH酶量的增加而提高;进一步提高PVADH酶量,PVA降解率略有降低;故确定PVADH酶量为200 U/mL(图2(a))。在0~8 U/mL的范围内,PVA降解率随着OPH酶量的增加而增加;当OPH酶量在8~14 U/mL的范围时,降解率变化不显著(图2(b))。由于OPH催化的底物是PVADH的产物,OPH对降解率的影响依赖于PVADH的催化速率。基于此,选择OPH酶量为12 U/mL。
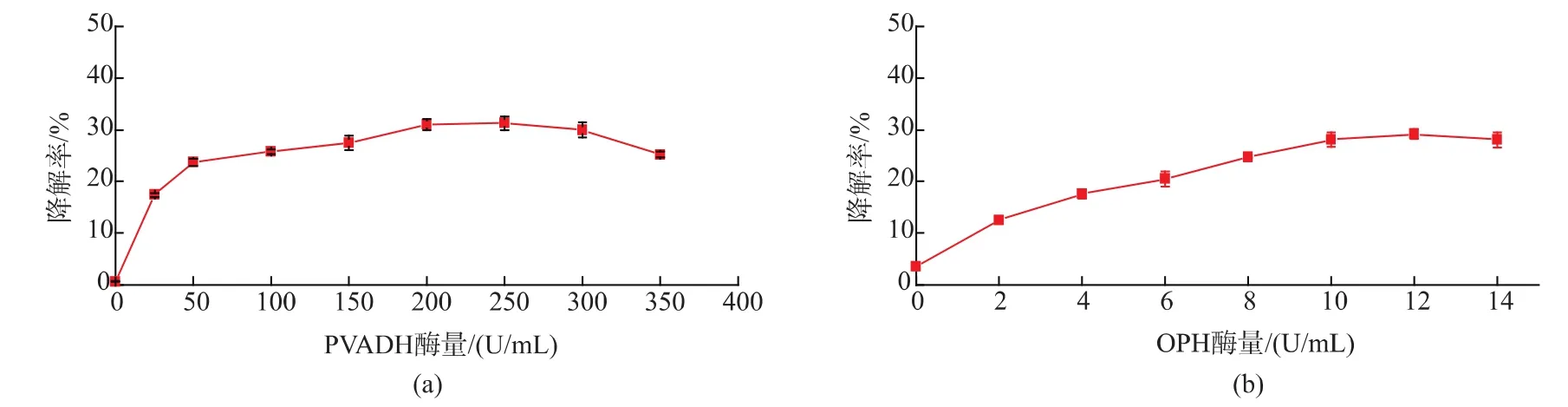

图2 PVADH酶量、OPH酶量、酶反应温度、pH、Ca2+浓度和底物质量浓度对PVA降解率的影响Fig.2 Effect of PVADH concentration,OPH concentration,enzymatic temperature,pH ,Ca2+concentration and substrate concentration on PVA degradation efficiency
如图2(c)所示,当温度升高至47℃时PVA降解率达到了最大值,更高的温度可能使PVA降解率下降。由图2(d)可知,PVA最适酶解pH 为9。Ca2+可以作为酶促反应的激活剂和稳定剂,0~1 mmol/L的Ca2+提高了PVA的酶促降解率,进一步提高Ca2+使 PVA 降解率明显下降(图 2(e)),故最适 Ca2+浓度为1 mmol/L。在以上初始酶反应条件下,PVADH和OPH能有效降解1 g/L PVA,提高PVA质量浓度导致降解率下降(图 2(f))。
2.2 爬坡实验
基于以上单因素实验,选择PVADH酶量、pH、酶反应温度3个影响显著的因素进行最陡爬坡实验,从表2来看,爬坡实验第3组PVA降解率最高,因此响应面的中心点应该在其附近产生。故以第3组条件为后续实验的中心点进行分析。
2.3 响应面优化
通过爬坡实验确定了Box-Behnken实验的中心点为PVADH酶量 125 U/mL、pH 7.5、酶反应温度41℃。根据中心点,Box-Behnken试验设计及结果见表3。利用Design-Expert V 8.0.6软件对表3的试验数据进行多元回归拟合,PVA降解率 (R)对PVADH 酶量(A)、pH(B)、酶反应温度(C)的二次多项回归方程为:
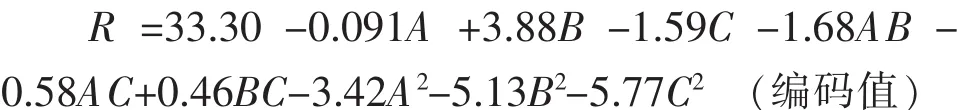

表2 爬坡实验安排表Table 2 Design and results of path of steepest ascent experiment
对模型进行方差分析。由表4可得出,试验设计模型P<0.0001,即该模型具有高度的显著性;模型中,单个因素中的B、C对PVA降解率的影响显著,交互项AB对PVA降解率的影响较显著,二次项A2、B2及C2对PVA降解率的影响显著。由F值可知,单因素对PVA降解率的影响顺序为B(pH)>C(温度)>A(PVADH酶量)。模型的失拟概率仅为0.0711,说明拟合的回归方程符合实际情况。相关系数R2=0.9841,校正系数RAdj=0.9638,即不能由此模型进行解释的降解率总变异只有3.62%,这表明模型与实际情况拟和较好,可用此模型对PVA降解率进行分析和预测。

表3 Box-Behnken设计试验方案及响应值Table 3 Box-Behnken design and the correspondingresults
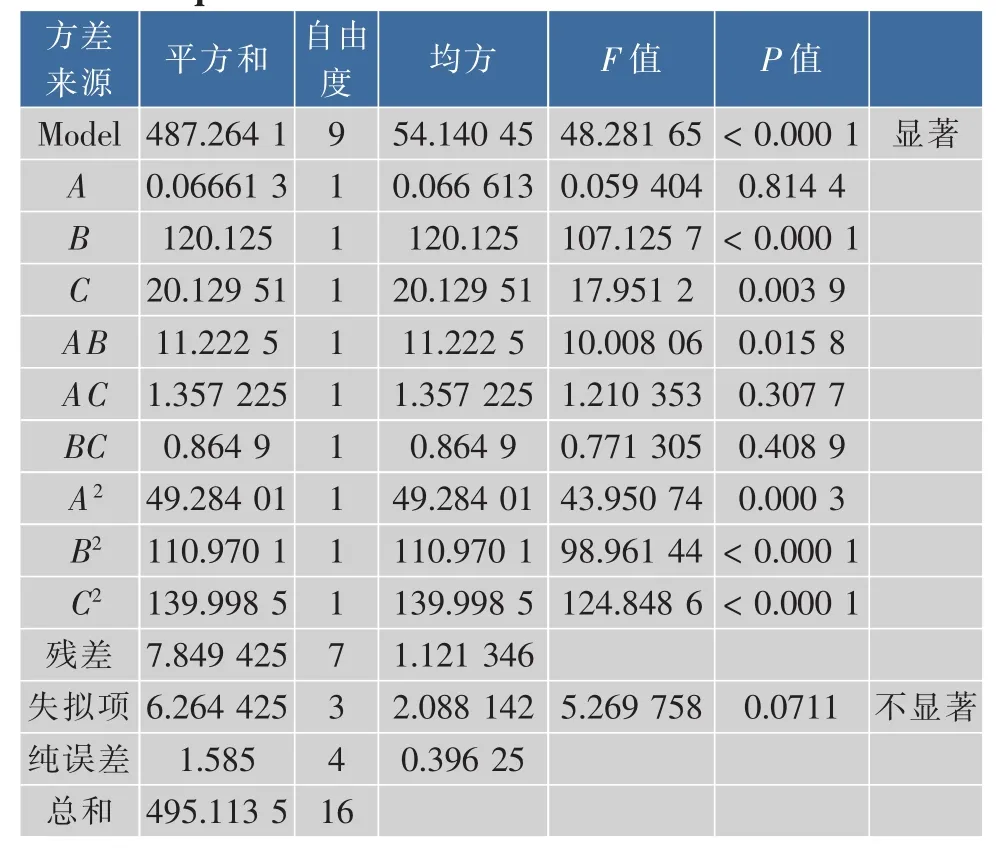
表4 回归模型的方差分析Table 4 Analysis of variance results for response surface quadratic model
为更直观地理解实验因素对PVA降解率的影响,利用Design-Expert V 8.0.6软件得到了二次方程的三维响应面图,如图3所示。呈马鞍形或椭圆形的等高线表示参数与参数之间交互作用显著,呈圆形的等高线则表示参数与参数之间交互作用不显著。由此,交互项AB影响较显著,AC、BC次之。

图3PVADH酶量与pH、PVADH酶量与温度及pH与温度交互作用的响应面图Fig.3 Response surface showing the effects of AB、AC and BC on PVA degradation efficiency
利用Design-Expert V 8.0.6软件预测出双酶酶法降解PVA的最佳降解工艺:PVADH 122.54 U/mL,pH 7.69,酶反应温度40.77℃。在此条件下,PVA的降解率为34.15%。根据实际情况,对该预测的工艺条件进行修正:PVADH 123 U/mL,pH 7.7,酶解温度41℃。在此条件下,独立进行3次实验,反应1 h,得到的PVA降解率的平均值为34.07%,与理论值相符,说明该工艺可靠。
2.4 PVA酶促降解机制分析
目前,大多数研究者大都采用自己筛选的菌种,不同的菌种涉及到的PVA降解酶组合也都不尽相同。一般认为PVA酶促降解经由PVADH脱氢得到酮基化合物 (氧化型PVA),OPH再将氧化型PVA水解为小分子。但也有学者认为氧化型PVA的结构并不稳定,它的降解也可以自发进行[7]。基于此,有必要对PVA酶促降解过程进一步验证。结果分析显示,PAVDH和OPH双酶共同降解PVA 4 h后,PVA接近完全降解;而PVADH单独降解PVA时,PVA质量浓度总体上在下降,但经过大约12 h,PVA才基本降解完全。上述结果表明,PVADH可以单独降解PVA,但降解速率较慢,而OPH可以加速氧化型PVA这种不稳定结构的进一步降解,从而提高降解速率。

图4 降解效果对比Fig.4 Comparison of degradation effects
3 结 语
生物法是一种“绿色环保”的处理技术,它将微生物或PVA降解酶应用于纺织退浆工艺或下游的废水处理中,具有对织物损伤小、排污少、废水处理简单、处理能耗低、对设备要求低等优势。本研究应用响应面法和多项式数学模型对PVADH和OPH双酶降解PVA的工艺条件进行优化。得到的优化条件为:PVADH 123 U/mL,OPH 12 U/mL,pH 7.7,酶解温度 41 ℃,Ca2+浓度 1 mmol/L,PQQ 浓度 6 μmol/L,反应1 h,对1 g/L PVA降解率的平均值为34.07%,与响应面的预测值(34.15%)基本一致。当酶解反应经过4 h,降解率达到了95%以上。大多数细菌将0.1%~0.5%质量分数的PVA降解90%以上,一般情况下需要3~12 d[9],与微生物法相比该双酶降解工艺可实现PVA的快速降解。研究结果为进一步酶法生物降解PVA的放大和应用奠定了基础。
但该双酶降解工艺需要外加微量PQQ,PVADH只有结合辅助因子PQQ才具有催化活性,而PQQ的添加提高了使用成本。因此为尽快实现酶法降解PVA的应用,提高酶法降解PVA的竞争力,今后应积极开展对可替代PQQ的廉价辅因子的研究以及对PQQ体外再生系统的探索。
