地黄饮子汤对rt-PA溶栓后急性脑梗死大鼠神经细胞凋亡及Bcl-2、Caspase-3表达的影响*
2019-09-13刘王波方志成
刘王波 彭 禹 马 瑞 方志成
(湖北省十堰市太和医院,湖北医药学院附属医院,湖北 十堰 442000)
急性脑梗死(ACI)发病率和死亡率很高,严重威 胁人类健康[1]。ACI的病理基础为急性局灶脑缺血,脑血管内皮细胞受损,血脑屏障功能丧失,缺血性脑组织发生细胞凋亡和坏死[2]。脑梗死急性期,缺血区中央带神经元在数分钟内发生不可逆坏死,出现相应的神经功能缺损症状,导致神经元凋亡和生物功能丧失[3]。细胞凋亡是基因调控细胞程序性死亡的过程[4]。B细胞淋巴瘤-2(Bcl-2)的主要功能是抑制细胞凋亡。研究表明,Bcl-2基因表达和蛋白质水平降低将显著增加细胞凋亡水平和加重神经功能障碍[5-6]。Caspase是凋亡通路的中心环节,Caspase-3参与受体和线粒体凋亡通路,可在细胞表面相互作用,介导细胞凋亡[7]。因此,抑制脑梗死半暗区细胞凋亡可保护神经功能。ACI唯一被认可的治疗方法是在症状出现后的前4~5 h内用重组组织纤溶酶原激活剂(rt-PA)溶栓,然而,溶栓后再灌注可加重缺血区神经细胞凋亡和坏死,引起继发性损伤[8]。地黄饮子汤具有滋肾阴、补肾阳、开窍化痰的功效,在治疗缺血性脑血管疾病方面取得了一定疗效,但其作用机制研究较少[9]。因此,本研究通过检测地黄饮子汤对rt-PA溶栓后急性脑梗死大鼠神经细胞凋亡及Bcl-2、Caspase-3表达的影响,探讨其治疗ACI的机制。现报告如下。
1 材料与方法
1.1 实验动物 选取体质量200~240 g的雄性8周龄SD大鼠40只,由北京大学医学部实验动物科学部提供,许可证号:SZXK(京)2011-00120。在SPF环境中适应性喂养1周后进行实验,动物相关处置均符合《中华人民共和国实验动物管理条例》要求。
1.2 试药与仪器 地黄饮子汤(熟地黄、山茱萸肉、石斛、巴戟天、肉苁蓉、白茯苓、炮附子、肉桂、五味子各30 g,麦冬、菖蒲、远志各15 g,生姜3片和大枣2枚为配伍,用12倍水煎煮2次,合并滤液,用旋转仪蒸发浓缩成生药量为2.5 g/mL的汤剂,冰箱贮存备用);rt-PA(德国勃林格殷格翰制药有限公司);冻干人凝血酶(上海太阳生物技术有限公司生产);戊巴比妥(上海上药新亚药业有限公司);三苯基四氮唑(TTC)(美国Biosharp公司);白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)ELISA试剂盒(上海酶联生物科技有限公司);TUNEL细胞凋亡检测试剂盒(碧云天生物技术公司);TRIzol(天根生化科技有限公司,中国);RNA反转录试剂盒(大连TaKaRa公司,中国);荧光定量PCR试剂盒(大连TaKaRa公司,中国);Bcl-2、Bax、Caspase-3引物由大连TaKaRa公司设计并合成:Bcl-2上游引物为5′-CCCGTTGCTTTTCCTCTGG-3′,下游引物为 5′-ATCCCACTCGTAGCCCCTCT-3′;Bax上游引物为 5′-GACGAACTGGACAGTAACATGGA-3′,下游引物为5′-GCAAAGTAGAAAAGGGCGACA-3′;Caspase-3上游引物为5′-GACTCTGGAATATCCCTGGACAACA-3′,下游引物为 5′-AGGTTTGCTGCATCGACATCTG-3′;GAPDH 引物序列:上游引物为 5′-TCCCATCACCATCTTCCAG-3′,下游引物为:5′-GGTATCCATCGCCATGCTC-3′;激光多普勒血流检测仪(PE-5001,Sweden)(上海永州实验设备有限公司);光学显微镜(日本Nikon公司);HBS-1096B酶标仪(南京德铁实验设备有限公司);病理切片机、包埋机、脱水机(德国Leica公司);NanoDrop2000c型蛋白核酸检测仪(美国Thermo公司);实时荧光定量PCR仪(美国BD公司)。
1.3 分组及造模 将40只大鼠用随机数字表法均分为4组:假手术组、模型组、rt-PA组和地黄饮子汤组。每组用5只大鼠进行血液采集和TTC染色、5只进行细胞凋亡和mRNA检测。大鼠术前12 h禁食,用戊巴比妥钠(35 mg/kg)麻醉后沿进行开颅,切除了硬脑膜,暴露了大脑中动脉(MCA)。模型组、rt-PA和地黄饮子汤组将含有1 mL纯化鼠凝血酶(1.5 UI)的微管插入MCA分叉的管腔内,仔细注射,诱导原位血栓形成。注射10 min后移除了移液管,此时血块已经稳定。用激光多普勒血流检测仪检测左侧大脑血流变化,当凝血酶注射时,脑血流速度从基线下降到至少60%,并且在至少20 min内保持稳定时,血凝块被定义为成功。假手术组只开颅不进行相关操作。
1.4 给药方法 造模结束20 min后rt-PA组和地黄饮子汤组大鼠尾静脉注射rt-PA(10 mg/kg),地黄饮子汤组同时灌胃给予地黄饮子汤(5 g/kg),其余组给予等量0.9%氯化钠注射液。2 h后半夏泻心汤组以5 g/kg进行灌胃,对照组和模型组给予等量0.9%氯化钠注射液。24 h后处死大鼠进行相关检测。
1.5 标本采集与检测 1)TTC染色。大鼠心脏取血后分离完整脑组织,行冠状位切片,厚度2 mm,置于2%的TTC染液中孵育30 min,用磷酸盐缓冲液终止染色。用Image Pro Plus 6.0软件计算梗死体积。2)ELISA法检测血清中IL-6和TNF-α水平。对血液进行离心,分离血清,按照ELISA试剂盒说明书进行IL-6和TNF-α水平测定。3)TUNEL法检测细胞凋亡。脑组织进行石蜡包埋,切片(2.0 μm),经脱蜡、酒精梯度脱水后,按TUNEL法检测细胞凋亡说明书进行细胞凋亡检测。使用荧光显微镜检测凋亡细胞(绿色荧光染色),最后用碘化丙啶(PI)反染细胞核,计数绿色和红色荧光细胞,计数阳性细胞率。4)RT-PCR法检测Bcl-2、Bax和Caspase-3 mRNA表达。取约0.1 g脑组织,用液氮充分研磨后加入1 mL TRIzol进行总RNA提取,然后合成cDNA,制备20 μL反应体系进行扩增。以 GADPH 作为内参,采用 2-ΔΔCt法计算Bcl-2、Bax和Caspase-3 mRNA的相对表达量。
1.6 统计学处理 应用IBM SPSS19.0统计软件。计量资料以()表示,采用单因素方差分析进行判断,组间两两比较用SNK-q检验。P<0.05差异有统计学意义。
2结果
2.1 各组大鼠脑梗死体积和细胞凋亡率的比较 见表1,图1~2。与假手术组比较,其余各组大鼠脑梗死体积和细胞凋亡率增高(P<0.05);与模型组比较,rt-PA组和地黄饮子汤组大鼠脑梗死体积和细胞凋亡率降低(P<0.05);与rt-PA组比较,地黄饮子汤组大鼠脑梗死体积和细胞凋亡率降低(P<0.05)。
表1 各组大鼠脑梗死体积和细胞凋亡率比较(%,±s)

表1 各组大鼠脑梗死体积和细胞凋亡率比较(%,±s)
与假手术组相比较,#P<0.05;与模型组相比较,*P<0.05;与rt-PA组相较,△P<0.05。下同
细胞凋亡率0.42±0.06 4.81±0.23#2.94±0.26#*1.85±0.20#*△组别假手术组模型组rt-PA组地黄饮子汤组n 5 5 5 5大鼠脑梗死体积0.00±0.00 37.51±5.43#29.97±3.14#*18.64±2.07#*△
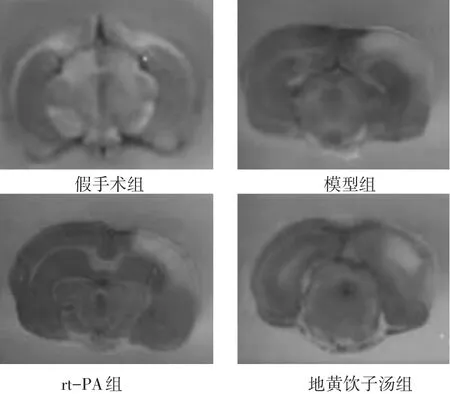
图1 各组大鼠脑梗死体积

图2 各组大鼠细胞凋亡情况
2.2 各组大鼠血清中IL-6和TNF-α水平的比较 见表2。与假手术组比较,其余各组大鼠血清中IL-6和TNF-α水平均增高(P<0.05);与模型组比较,rt-PA组和地黄饮子汤组大鼠血清中IL-6和TNF-α水平降低(P<0.05);与rt-PA组比较,地黄饮子汤组大鼠血清中IL-6和TNF-α水平降低(P<0.05)。
表2 各组大鼠血清中IL-6和TNF-α水平比较(ng/L,±s)

表2 各组大鼠血清中IL-6和TNF-α水平比较(ng/L,±s)
组别假手术组模型组rt-PA组地黄饮子汤组n 5 5 5 5 IL-6 123.19±15.02 463.57±26.26 281.49±30.09#*198.34±22.04#*△TNF-α 31.57±4.38 201.84±26.19#136.46±15.41#*75.54±9.20#*△
2.3 各组大鼠脑组织中Bcl-2、Bax和Caspase-3 mRNA表达水平的比较 见表3。与假手术组比较,其余各组大鼠脑组织中Bcl-2 mRNA表达降低,Bax和Caspase-3 mRNA表达水平增高(P<0.05);与模型组比较,rt-PA组和地黄饮子汤组大鼠脑组织中Bcl-2 mRNA表达增高,Bax和Caspase-3 mRNA表达水平降低(P<0.05);与rt-PA组比较,地黄饮子汤组大鼠Bcl-2 mRNA表达增高,Bax和Caspase-3 mRNA表达水平降低(P<0.05)。
表3 各组大鼠脑组织中Bcl-2、Bax和Caspase-3 mRNA表达水平比较(±s)

表3 各组大鼠脑组织中Bcl-2、Bax和Caspase-3 mRNA表达水平比较(±s)
组别假手术组模型组rt-PA组地黄饮子汤组n5 5 5 5 Bcl-2 1.00±0.06 0.57±0.06 0.69±0.09#*0.84±0.04#*△Bax 1.00±0.04 2.84±0.19#1.98±0.21#*1.54±0.20#*△Caspase-3 1.00±0.07 3.05±0.26#2.71±0.35#*1.94±0.28#*△
3讨论
脑梗死属中医学“中风”“卒中”范畴,其病因多为痰浊上泛,下元虚衰,阻塞窍道所致,祛瘀通络、化痰泻浊的方剂可切中其病机[10]。地黄饮子汤具有开窍化痰的功效,在临床对于风痰瘀阻证患者,取得了满意的疗效。现代药理学研究也表明,地黄饮子汤具有清除自由基、抗脂质氧化的作用[11]。临床研究表明,地黄饮子汤能显著清除急性脑梗死患者的自由基,改善血液流变学指标,保护神经系统[12]。本研究也显示,地黄饮子汤可以降低rt-PA溶栓后ACI大鼠的脑梗死体积。笔者推测,其作用机制可能与抑制神经细胞的凋亡有关,因为再本研究中笔者也检测到地黄饮子汤组大鼠细胞凋亡明显受到抑制。
rt-PA治疗后最严重的并发症是出血和血脑屏障破裂。一些实验研究已经证明,rt-PA溶栓治疗可能抵消对微循环的有益影响,这可能与rt-PA介导了血脑屏障(BBB)通透性的增加有关[13]。脑缺血/再灌注导致促炎介质(TNF-α和IL-6)的释放,进而导致驻留细胞和浸润细胞产生基质金属蛋白酶(MMP),从而增加BBB的通透性,促进脑水肿的形成,并导致脑卒中的急性死亡[14]。地黄饮子汤显著降低了IL-6和TNF-α水平,从而发挥脑保护作用。
在ACI中,视缺血缺氧程度,细胞可能发生坏死和凋亡。缺血核心区的细胞由于长期严重缺氧缺血而死亡,这是一个不可逆的过程。在缺血半暗区,位于缺血灶周围,缺血程度较低,及时建立侧支循环,可在一定程度上改善脑功能[15]。近期发现急性脑梗死后半暗区细胞凋亡是治疗急性脑梗死的关键,这一过程是可逆的,可抑制细胞功能的恢复[16]。因此,有效抑制该区域的凋亡对减少脑细胞凋亡和神经功能损伤具有重要意义。细胞凋亡是细胞维持自身稳定的重要机制,如果药物的保护作用及时生效,细胞的凋亡会减少,但细胞死亡的过程也会延迟。
Bcl-2家族在调节细胞死亡信号通路中起主要作用。Bcl-2是调节细胞凋亡的主要抑制蛋白。对急性脑梗死患者的研究表明,血清中Bcl-2的表达明显下降,提示患者抗凋亡功能下降[17]。正常情况下,Bcl-2和Bax的表达水平相对稳定。然而,当Bax过表达时,Bax二聚体数量显著增加,刺激细胞,引起细胞凋亡。当Bcl-2高表达时,Bax二聚体解离形成更稳定的Bcl-2和Bax复合物,从而延长细胞寿命[18]。因此,Bcl-2/Bax的比例在维持细胞存活过程中起着重要作用。Caspase-3是半胱氨酸蛋白酶家族的成员,是参与细胞凋亡的关键酶,通过降解细胞内底物激活细胞凋亡通路,导致细胞凋亡。因此,它被称为“分子开关”,但其活化依赖于细胞色素C的释放,而Bcl-2家族,包括Bcl-2,可以通过线粒体介导细胞色素C的释放[19]。本研究结果也证实了地黄饮子汤能抑制Caspase-3和Bax的表达,促进Bcl-2的表达。
综上所述,地黄饮子汤可降低缺血性病变体积,降低rt-PA溶栓后急性脑梗死大鼠神经细胞凋亡,从而为地黄饮子汤防治急性脑梗死溶栓后再灌注损伤提供理论依据。
