丹红注射液对糖尿病合并脑缺血大鼠的神经保护作用及Nrf2/HO-1通路的影响*
2019-09-13郝宏铮王爱平孙海波
郝宏铮 王爱平 王 丽 孙海波
(辽宁中医药大学附属医院,辽宁 沈阳 110032)
脑缺血导致神经元死亡,主要发生在尾状核,壳核背外侧区,海马CA1区和脊髓区。糖尿病患者卒中发生率高于正常人群[1-2]。活性氧(ROS)通过激活转录因子红细胞2相关因子2(Nrf2)在增强炎症中起重要作用。研究表明,神经细胞对氧化应激的反应涉及Nrf2,Nrf2在调节Ⅱ期基因中起重要作用[3]。在基础条件下,由于单个Nrf2蛋白和Keap1之间的相互作用,Nrf2与细胞质中的Keap1结合[4-5]。暴露于许多应激物和诱导剂导致Nrf2从Keap1解离,从而从蛋白酶体降解中拯救Nrf2并允许进入细胞核。因此,Nrf2的激活被认为是细胞保护剂的重要分子靶标[6]。血红素加氧酶-1(HO-1)是Nrf2的下游调控因子,也被认为是氧化应激的重要调控酶[7]。丹红注射液由丹参、红花、注射用水组成,具有活血化瘀,通脉舒络的功能,用于瘀血闭阻所致的胸痹及中风,对缺血性脑病、脑血栓均有较好疗效;丹红注射液广泛应用于创伤性颅内血肿,肝静脉闭塞性疾病和心肌再灌注损伤,其通过抗凝血,抗血栓形成,抗纤维蛋白溶解和抗氧化活性证明了对脑缺血的保护作用[8-9]。本研究拟观察丹红注射液对糖尿病合并脑缺血大鼠的神经保护作用及Nrf2/HO-1通路的影响,为糖尿病合并脑缺血的治疗提供理论及临床依据。
1 材料与方法
1.1 实验动物 辽宁中医药大学实验动物中心提供体质量250~300 g的健康成年Sprague-Dawley大鼠100只[许可证号:SCXK(辽)2018-0013]。 动物饲养室适应22~26℃,湿度40%~70%,光暗周期12/12 h。在整个实验期间自由摄取饲料、自由饮水。
1.2 分组与造模 根据随机数字表法随机分成5组:对照组、模型组、丹红注射液低(10.0 mg/kg)、中(20.0 mg/kg)、高剂量组(40.0 mg/kg),每组20只,雌雄各半。通过单次腹膜内(i.p.)注射新鲜溶解于pH4.5的0.1 mol/L柠檬酸盐缓冲液中的55 mg/kg链脲佐菌素(STZ,S0130,Sigma,USA)诱导糖尿病。72 h后测量血糖水平。
1.3 试药与仪器 丹红注射液(国药准字Z20026866,山东丹红制药有限公司)、链脲佐菌素(STZ,S0130,Sigma,USA)、戊巴比妥钠(99.9%,Sigma)、Trizol试剂(美国赛默飞世公司)、一步法RT-PCR扩增试剂盒(上海生工)、NRF2、HO-1、β-肌动蛋白引物由上海生工科技有限公司合成、NRF2一抗(1∶100,Abcam,UK,ab119339,批次:GR264335-1)、HO-1(冯维勒布兰德因子)二抗(1∶100,Abcam,UK,ab6994批次:GR223933-3)、NRF2标记抗小鼠二抗(1∶100,中国金杉,中国,ZF-0312,批次:112242)、HO-1标记抗兔二抗(1∶100,中国杉木,中国,oZF-0317,批次116128)、DAP(I1 ng/μL;Sigma-Aldrich,Poole,UK,批号D9542)、CFX96实时荧光定量PCR仪(美国伯乐公司)。
1.4 给药方法 糖尿病组包括血糖水平超过18 mmol/L的大鼠(模型组及丹红注射液各剂量组)。注射等体积柠檬酸盐缓冲液的年龄匹配的非糖尿病大鼠用作非糖尿病对照[血糖(4.22±1.25)mmol/L]。大鼠在缺血诱导前一晚禁食,但可自由饮水。在模型组及丹红注射液各剂量组中诱导持续15 min的前脑缺血。麻醉由3%戊巴比妥钠注射诱导15 min瞬时前脑缺血通过夹住双侧颈总动脉与45~50 mmHg出血性低血压(通过放血诱导)相结合诱导。通过重新灌注流出的血液并释放放置在颈动脉周围的结扎线来恢复循环。丹红注射液各剂量建模成功后第1天开始给予相应药物灌胃,持续给予18周,对照组和模型组给予等体积生理盐水。对大鼠神经缺失症状进行评分。
1.5 标本采集与检测 1)制作大鼠脊髓HE切片,计算神经细胞存活率,即正常细胞占细胞总数的百分比,以5个视野的平均值作为最终的神经细胞存活率。2)大鼠脊髓组织中NRF2、HO-1 mRNA水平的测定。RT-qPCR测量NRF2、HO-1 mRNA水平。提取各组大鼠脑mRNA。mRNA逆转录成cDNA。以合成的cDNA为模板,NRF2(上游 5′-AGTATGTGGCGGGCTGCTT CG-3′,下游5′-GGAAATAATGAGAGGGAGGA T-3′),HO-1引物(上游5′-AACTTTGCCTGTTACCT TC-3′,下游5′-CAGTCACAATCTGACCTCC-3′),β-肌动蛋白引 物(上 游 5′-CGGCAGTCGCCTTGGACGTT-3′,下游 5′-GCCCTTTCCCATCTCAGCAGCC-3′)(Primer Express,Applied Biosystems;Life Technologies,Carlsbad,CA,USA)用于qPCR,β-肌动蛋白用作内参基因。使用2-ΔΔCT方法进行定量。3)NRF2、HO-1蛋白在大鼠海马组织的表达水平测定。取大鼠脑脊髓组织,常规甲醛固定,乙醇脱水,二甲苯透明。将切片在10%正常山羊血清(溶于PBS中)中在室温下封闭1 h。用PBS洗涤5 min。然后将NRF2抗体(1∶100,Abcam,UK,ab119339,批号 GR264335-1)和 HO-1抗体(1∶100,Abcam,UK,ab6994,批号GR223933-3)混合并添加至组织中。在4℃过夜。切片用PBS洗涤3次,每次5 min。抗小鼠二抗(1∶100,中国金杉,中国,ZF-0312,批号112242)和抗兔二抗(1∶100,中国杉木,中国,oZF-0317,批号116128)混合并加入组织中,37℃孵育1 h。用PBS洗涤3次,每次5 min。将切片与室温下染细胞核2 min,然后用PBS洗涤5 min。以高放大倍数(400倍)观察500个细胞。4)ELISA测定大鼠脊髓组织中蛋白水平。ELISA法测定MDA、NO、SOD蛋白水平。
1.6 统计学处理 应用SPSS23.0统计软件。计量资料以()表示,行单因素方差分析,随后两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2结果
2.1 各组大鼠神经缺失症状评分、神经细胞存活率比较 见表1。与对照组比较,丹红注射液各剂量组神经缺失症状评分升高(P<0.05),神经细胞存活率降低(P<0.05);与模型组比较,丹红注射液各剂量组神经缺失症状评分降低(P<0.05),神经细胞存活率升高(P<0.05)。
表1 各组大鼠神经缺失症状评分、神经细胞存活率比较(±s)
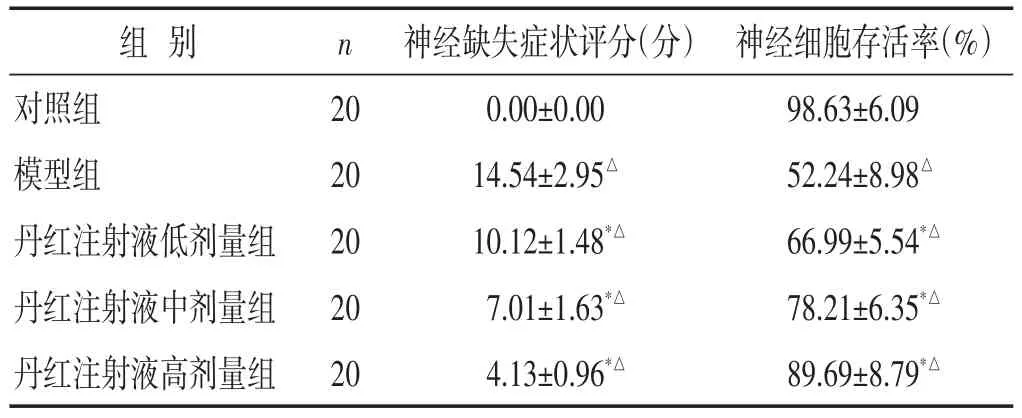
表1 各组大鼠神经缺失症状评分、神经细胞存活率比较(±s)
与模型组比较,*P<0.05;与对照组治疗后比较,△P<0.05。下同
组别对照组模型组丹红注射液低剂量组丹红注射液中剂量组丹红注射液高剂量组n 20 20 20 20 20神经缺失症状评分(分)0.00±0.00 14.54±2.95△10.12±1.48*△7.01±1.63*△4.13±0.96*△神经细胞存活率(%)98.63±6.09 52.24±8.98△66.99±5.54*△78.21±6.35*△89.69±8.79*△
2.2 各组大鼠脊髓神经元结构的比较 见图1。对照组脊髓区神经元细胞完整,神经纤维结构紧密、分布均匀、排列整齐、髓鞘薄厚均匀、结构正常,染色清晰,核呈卵圆形位于中央;模型组脊髓区可见神经纤维排列疏松、多处发生变性及断裂、大量坏死神经元、细胞核固缩;丹红注射液高剂量组脊髓区见少量坏死神经元细胞,变性与断裂显著减少、髓鞘着色不均匀,局部仍有炎症反应发生;丹红注射液中、低剂量组较模型组而言,坏死神经元细胞减少,但经元疏松紊乱,细胞核固缩,脱失现象明显,具有明显的剂量依赖效应。
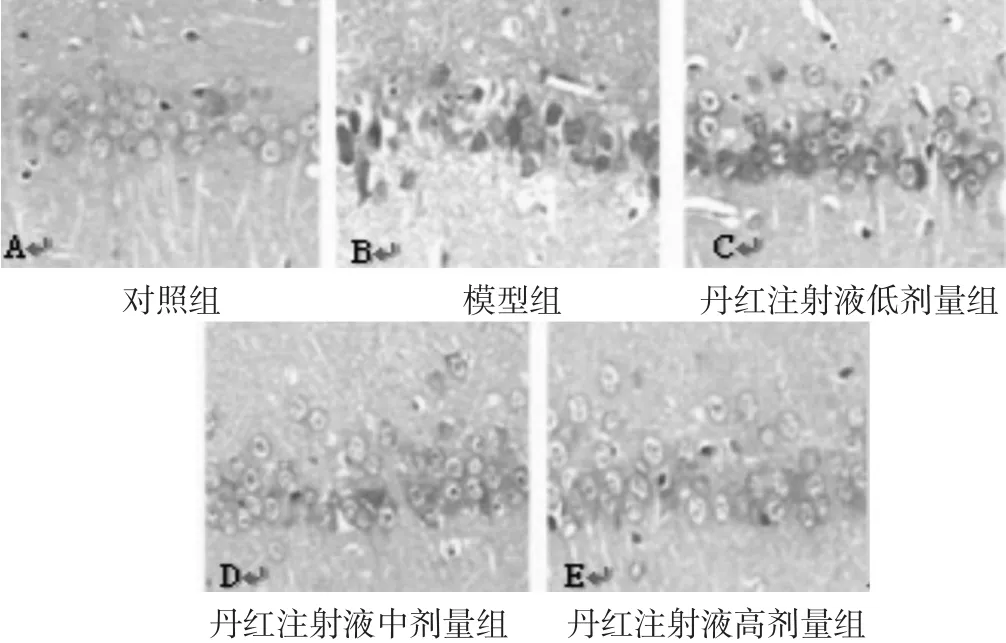
图1 各组大鼠脊髓神经元结构(400倍)
2.3 各组大鼠脊髓组织Nrf2、HO-1 mRNA表达比较 见表2。与对照组比较,模型组、丹红注射液低、中剂量组脊髓组织Nrf2、HO-1 mRNA表达水平明显升高(P<0.05);与模型组比较,丹红注射液各剂量组Nrf2、HO-1 mRNA表达水平明显降低(P<0.05)。
2.4 各组大鼠脊髓组织Nrf2、HO-1蛋白表达比较见表3、图2~图3。与对照组比较,模型组、丹红注射液低、中剂量组脊髓组织Nrf2、HO-1蛋白表达水平明显升高(P<0.05);与模型组比较,丹红注射液各剂量组Nrf2、HO-1蛋白表达水平明显降低(P<0.05)。免疫组化法下,Nrf2、HO-1阳性表达为棕褐色,Nrf2、HO-1阳性表达情况与各蛋白表达水平符合。
表2 各组大鼠脊髓组织Nrf2、HO-1 mRNA表达水平比较(±s)
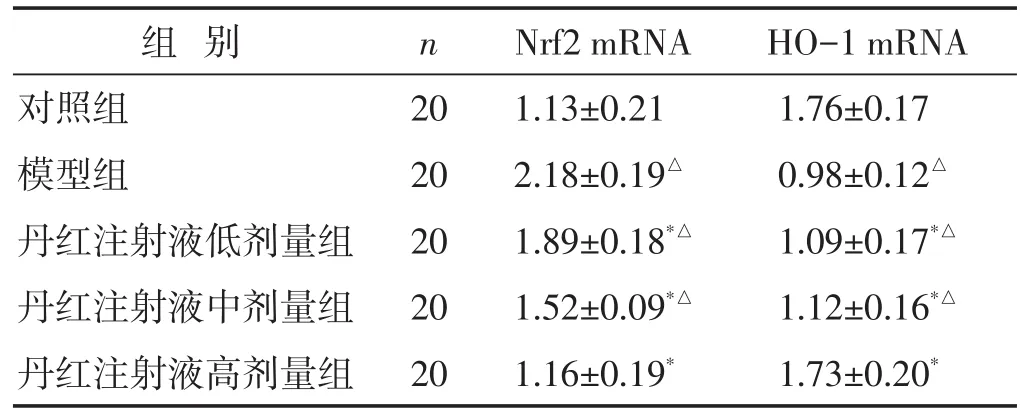
表2 各组大鼠脊髓组织Nrf2、HO-1 mRNA表达水平比较(±s)
组别对照组模型组丹红注射液低剂量组丹红注射液中剂量组丹红注射液高剂量组n 20 20 20 20 20 Nrf2 mRNA 1.13±0.21 2.18±0.19△1.89±0.18*△1.52±0.09*△1.16±0.19*HO-1 mRNA 1.76±0.17 0.98±0.12△1.09±0.17*△1.12±0.16*△1.73±0.20*
表3 各组大鼠脊髓组织Nrf2、HO-1蛋白表达水平比较(±s)
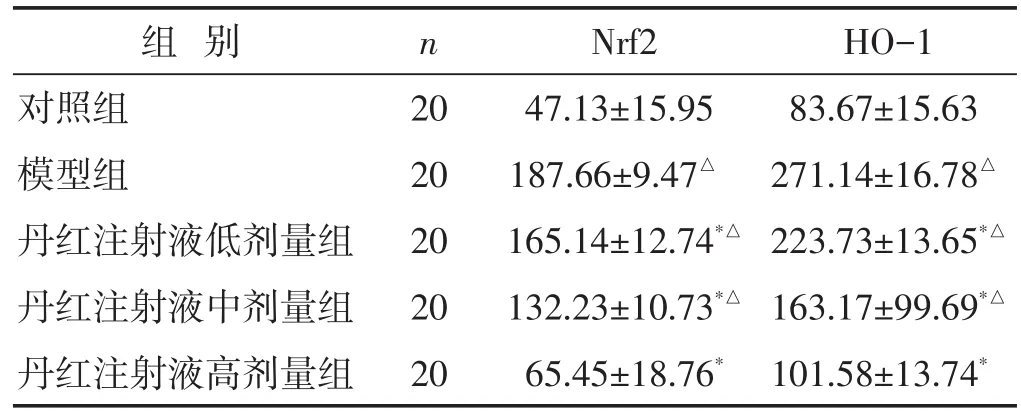
表3 各组大鼠脊髓组织Nrf2、HO-1蛋白表达水平比较(±s)
组别对照组模型组丹红注射液低剂量组丹红注射液中剂量组丹红注射液高剂量组n 20 20 20 20 20 Nrf2 47.13±15.95 187.66±9.47△165.14±12.74*△132.23±10.73*△65.45±18.76*HO-1 83.67±15.63 271.14±16.78△223.73±13.65*△163.17±99.69*△101.58±13.74*
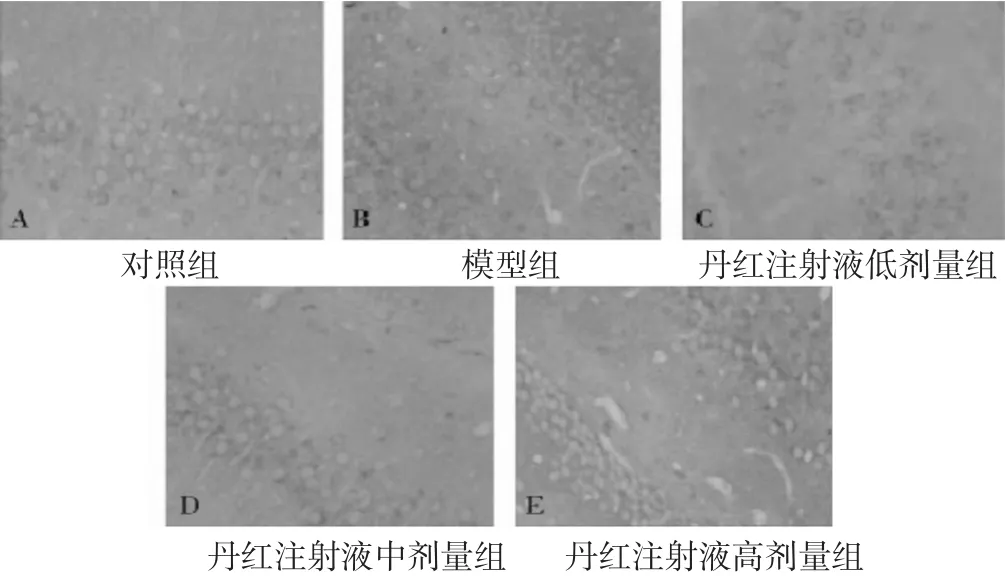
图2 各组大鼠脊髓区NRF2蛋白表达水平(HE染色,400倍)
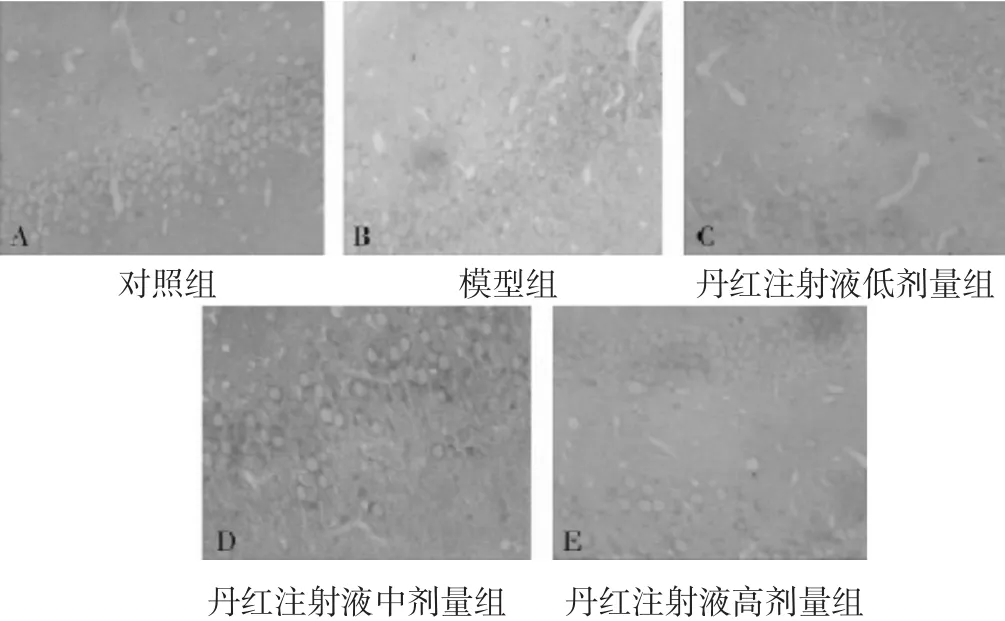
图3 各组大鼠脊髓区HO-1蛋白表达水平(HE染色,400倍)
2.5 各组大鼠脊髓组织MDA、NO、SOD蛋白表达比较 见表4。与对照组比较,模型组、丹红注射液低、中剂量组脊髓组织MDA、NO蛋白表达水平明显升高,SOD蛋白表达水平明显降低(P<0.05);与模型组比较,丹红注射液各剂量组MDA、NO蛋白表达水平明显降低,SOD蛋白表达水平明显升高(P<0.05)。
表4 各组大鼠脊髓组织MDA、NO、SOD蛋白表达水平比较(ng/g,±s)
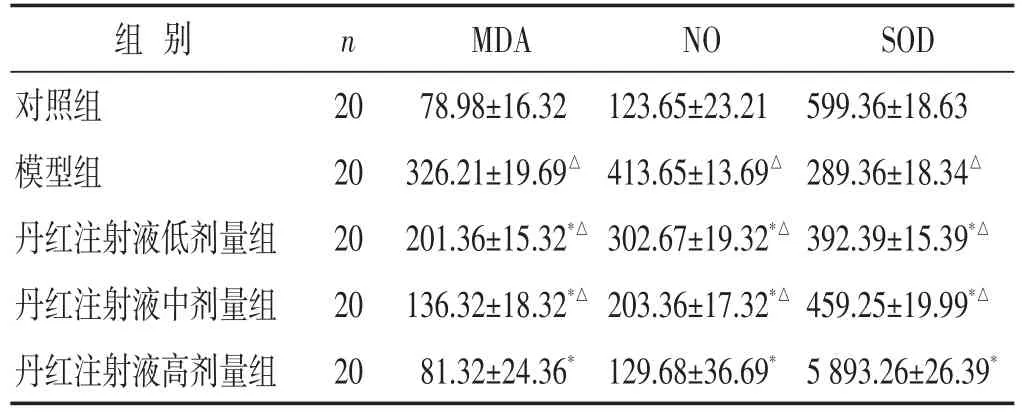
表4 各组大鼠脊髓组织MDA、NO、SOD蛋白表达水平比较(ng/g,±s)
组别对照组模型组丹红注射液低剂量组丹红注射液中剂量组丹红注射液高剂量组n 20 20 20 20 20 MDA 78.98±16.32 326.21±19.69△201.36±15.32*△136.32±18.32*△81.32±24.36*NO 123.65±23.21 413.65±13.69△302.67±19.32*△203.36±17.32*△129.68±36.69*SOD 599.36±18.63 289.36±18.34△392.39±15.39*△459.25±19.99*△5 893.26±26.39*
3讨论
丹红注射液是一种标准化的水溶性产品,采用现代技术从中草药丹参和红花中提取。丹参、红花是名贵中草药,广泛用于治疗心脑血管疾病。丹红注射液成分复杂,由原儿茶醛、咖啡酸、丹参素、5-羟甲基-2-糠醛、丹酚酸D、丹酚酸B、丹酚酸A、精酸、阿魏酸和迷迭香酸组成[10-11]。本实验表明,与模型组比较,丹红注射液各剂量神经缺失症状评分降低,神经细胞存活率升高。这提示丹红注射液显著减少了糖尿病合并脑缺血大鼠引起神经缺失症状,并提升了神经细胞存活率。结合病理学结果,丹红注射液高剂量组脊髓区见少量坏死神经元细胞,变性与断裂显著减少、髓鞘着色不均匀,局部仍有炎症反应发生。这说明丹红注射液能减轻糖尿病合并脑缺血大鼠脊髓神经元损伤程度。
抗氧化/亲电子反应元件(ARE/EpRE)调节的Ⅱ期解毒酶和抗氧化剂是抵抗增加的氧化应激和维持许多组织中氧化还原状态的主要抗氧化途径之一[12]。HO-1是催化血红素降解为胆绿素,碳氧化物(CO)和铁的限速酶,是ARE调节的Ⅱ期解毒酶和抗氧化剂之一,受到氧化还原敏感的转录因子核因子红细胞2相关因子(Nrf2)的调节[13]。HO-1基因表达的调节发生在多个水平上并且是诱导物特异性的。在转录水平,HO-1由转录因子Nrf2介导。在生理条件下,Nrf2被Keap1隔离在胞质溶胶中,并且靶向蛋白酶体降解。在存在亲电子或ROS的情况下,Nrf2从Keap1释放,然后易位到细胞核中,激活靶基因(包括HO-1)的转录。Nrf2对脑缺血再灌注损伤中的神经元和血管变性具有保护作用[14]。据报道,HO-1在其启动子上具有最多的ARE,使其成为预防脑缺血神经损伤的高效治疗靶标。HO-1的过表达在转基因小鼠的永久性大脑中动脉闭塞模型(MCAO)中具有神经保护作用[15]。此外,HO-1的药理学诱导已被证明可以保护视网膜免受急性青光眼诱导的缺血再灌注损伤。本研究结果显示,与模型组比较,丹红注射液各剂量组Nrf2、HO-1 mRNA、蛋白表达水平、MDA、NO蛋白表达水平明显降低,SOD蛋白表达水平明显升高。这提示丹红注射液抑制Nrf2、HO-1 mRNA、蛋白的表达水平激活抗氧化途径,降低氧化应激产物水平,进而对糖尿病合并脑缺血大鼠的神经起保护作用。
综上所述,丹红注射液显著减少糖尿病合并脑缺血大鼠引起的神经缺失症状,减轻脊髓神经元损伤程度;其机制与抑制Nrf2、HO-1 mRNA、蛋白的表达水平激活抗氧化途径,降低氧化应激产物水平有关。
