转化人参皂苷菌株的筛选及活性初步鉴定
2019-09-11贾桂燕潘昉刘玉鹏李晶莹王维峰孙工兵葛文中张月莹
贾桂燕 潘昉 刘玉鹏 李晶莹 王维峰 孙工兵 葛文中 张月莹
摘 要:实验从吉林省长白山、通化市榆林镇、怀化白山市抚松县3地的鲜参根际土壤中筛选具有转化人参皂苷生物活性的微生物,平板划线法筛选单菌落菌株,人参总皂苷为底物经液体发酵,经薄层色谱分析初步判断具有转化活性的菌株,采用紫外分光光度法测定活性菌株对人参皂苷的转化率。最终筛选出8株真菌菌株,其中C4转化活性最高,可使人参皂苷的转化率提高28.92%。
关键词:人参皂苷;微生物转化;薄层层析法;紫外分光光度法
中图分类号 TQ929文献标识码 A文章编号 1007-7731(2019)15-0028-04
Screening of Transformed Ginsenosides Strains and Preliminary Identification of Their Activities
Jia Guiyan1 et al.
(1College of Life Science and Technology, Heilongjiang Bayi Agricultural University, Daqing 163319,China)
Abstract:In this experiment,there are eight fungi strains were selected from rhizosphere soil of fresh ginseng in Changbai Mountain of Jilin Province,Yulin Town of Tonghua City and Fusong County of Huaihua City,which had bioactivity of transforming ginsenoside.Through thin layer chromatography analysis,preliminary judgment has the activity of the strains,again by Ultraviolet spectrophotometric method determination of active strains of ginseng saponin conversion rate.Among them,C4 showed the highest conversion activity,which could increase the conversion rate of ginsenosides by 28.92%.
Key words:Ginsenoside;Microbial-Transformation;Thin-layer-Chromatography;UV spectrophotometry
人參(Panax ginseng C.A.Mey)是我国传统珍贵的药用植物之一,作为几千年来应用最广泛的中草药之一,在东方医学史上占有重要地位[1]。味甘,微苦,性质温和,具有调气血、滋补身体的作用,被誉为“中草药之王”[2,3]。人参皂苷是人参的主要药理活性成分,具有抗炎、抗肿瘤、抗癌等作用[4-6]。由于天然人参皂苷含量较低,利用化学和生物方法对人参皂苷进行定向转化,对于制备人参皂苷有着重要意义。
目前,人参皂苷的转化方法主要有微生物转化和酶转化2种[7,8]。酶转化法有一定的特异性,β-葡萄糖苷酶是酶转化法最常用的一种酶。微生物转化不同于酶转化,以简单的培养方式、多样的种类和丰富的酶系统成为生物转化中最常用的生物,其转化过程一般为:细菌筛选—培养转化底物—薄层色谱分析—紫外(高效液相)检测。近年来,学者们对人参皂苷的微生物转化途径和产物进行了研究,为转化人参皂苷奠定了基础[9,10]。微生物转化不仅具有环境污染程度低、成本低的优点,而且具有较高的特异性,是一种选择性、环保性技术[11]。应用微生物方法对天然人参皂苷糖基的结构进行改变,大大提高了其生理活性和应用价值,将其应用于工业生产具有重要的意义[12-14]。
本实验通过平板划线法从长白山、榆林镇、抚松县3个产地的鲜参根际土壤稀释液中筛选出22株真菌菌株,根据其形态、颜色,最终合并为8株菌株,采用液体发酵法以人参总皂苷为底物进行转化,经薄层色谱分析法初步确定具有转化能力的活性菌株,利用紫外可见分光光度法测定发酵液吸光度值[16],考察人参总皂苷的转化情况,继而得到转化活性最佳的活性菌株。
1 仪器与材料
1.1 仪器 详见表1。
1.2 试剂 琼脂粉(北京澳博星生物技术有限责任公司)、葡萄糖(沈阳市华东试剂厂),硅胶板GF254(青岛海洋化工厂分厂),pH试纸(天津市金达化学试剂有限公司),甲醇(天津市科密欧化学试剂有限公司),乙醇(天津市永大化学试剂有限公司),三氯甲烷(北京化工厂),正丁醇(天津市百世化工有限公司),均为分析纯。浓硫酸、香草醛、冰乙酸、高氯酸均为分析纯,购买于天津市大茂化学试剂厂。
1.3 材料 带土鲜参分别购买于吉林省长白山,通化市榆林镇,怀化白山市抚松县3个地区(均为5年参);人参总皂苷Re标准品购买于合肥博美生物科技有限公司;实验所用底物人参茎叶总皂苷购买于辽宁省生物医药研发中心。
2 方法
2.1 培养基的制备 培养液pH控制在7左右,用1mol/L的氢氧化钠溶液进行调节控制。制备的培养基以及培养皿等均在121℃的高温下灭菌25min。
2.1.1 马铃薯固体培养基(PDA培养基) 将马铃薯去皮,洗净并切成1cm3的小块,用天平称取200g,加入1000mL的蒸馏水和20 g琼脂粉,一起煮沸约20min后土豆块熟而不烂,停止加热[16]。用纱布过滤,将滤液倒入1000mL的烧杯中,再向滤液中加入20g葡萄糖,用玻璃棒搅拌溶解,最后加蒸馏水定容到1000mL。
2.1.2 馬铃薯液体培养基(PDB培养基) 配置方法同上述PDA培养基配置法相同,加入葡萄糖和人参总皂苷底物,再分装置250mL锥形瓶中,包好,放置121℃高温灭菌锅中25min[16]。灭菌后取出放入4℃左右冰箱冷藏保存。
2.1.3 斜面培养基 将PDA培养基趁热倒入试管中,使试管倾斜成斜面,使之凝固,4℃左右冰箱冷藏保存。
2.1.4 平面培养基 均匀将PDA培养基倒入培养皿中,平铺培养皿底部即可。
2.2 鲜参根际土壤真菌的分离 采用稀释平板法进行土壤分离。取长白山、榆林镇、抚松县3个地方的土壤放置于40~ 50℃电热恒温鼓风干燥箱中烘干2~3h。分别取1g烘干土壤,在超净台上各加入10mL无菌蒸馏水,将土样从10-1稀释至10-6倍[16,17]。充分震荡摇匀。再将稀释液逐级取0.1mL用无菌三角棒均匀涂布在含有PDA平板培养基上。在30℃的恒温培养箱中培养2~3d。每24h观察并记录。结果显示,能培养出菌株的土壤稀释液通常为10-4~10-6。
2.3 菌种的纯化 利用单菌落划线法,将培养获得的菌种进行纯化。在超净台上用接种环挑取单菌落在含有卡那霉素(50μg/mL)PDA培养基上进行划线,30℃倒置培养48h后得到较纯的菌落。再经反复划线培养,每隔24h取出观察,直至得到单一的菌株,取出后,在无菌操作台上用接种环传至含有卡那霉素(50μg/mL)PDA斜面培养基上,置于30℃电热恒温培养箱中培养72h,4℃保藏,备用。
2.4 液体发酵培养 将纯化后的平板培养基中的菌株用2mL无菌蒸馏水冲洗制成孢子悬液,分别加入含有人参总皂苷的PDB培养基中(人参总皂苷的含量为0.4mg/mL,以相同浓度及体积的人参总皂苷溶液的无菌株液体培养基作为空白对照),置于30℃,160r/min[18~20]条件下全温振荡器摇晃12d。培养48h后,每隔24h取发酵液,用水饱和正丁醇V∶V=1∶1萃取,6000r/min离心10min,取上清液,备用。
2.5 薄层色谱初步鉴定活性菌株 层析条件:硅胶板GF254,100×100mm;展开剂:三氯甲烷∶甲醇=3∶1,临用前配制。取2.4项下制备的上清液,用微量点样器分别定量吸取对照品及供试品溶液,在离层析板边缘1.5cm处精确点样,点于同一硅胶板,展开剂展开,吹干溶剂,喷10%硫酸乙醇溶液,110℃均匀加热10min至斑点显色清晰[21,22]。置于日光与紫外灯光365nm下分别验视,通过与空白对照人参皂苷所显示的斑点对比判断经微生物转化后样品中所含皂苷成分的转化情况。
2.6 紫外分光光度法检测活性菌株转化率 人参总皂苷含量测定标准曲线的制备:精密称量人参皂苷Re标准品溶液(0.5mg/mL)0.1,0.15,0.2,0.25,0.3,0.35mL于试管中,60℃水浴锅中蒸干,加入0.2mL5%香草醛-冰醋酸、0.8mL高氯酸溶液,水浴锅中加热15min,冷却,加入5mL冰醋酸溶液,摇匀[23]。以相应的试剂作空白对照,540nm处测吸光度,以标准品人参皂苷Re样品量为横坐标,吸光度为纵坐标,绘制标准曲线。紫外分光光度法测定2.4项下所制备上清液的吸光度值,代入标准曲线,计算人参皂苷的含量及转化率。计算公式为:转化率(%)=(样品量-空白样品量)/空白样品量×100。
3 结果与分析
3.1 菌种的纯化 经反复划线培养从土壤稀释液中筛选出22株菌种,通过观察其形态、颜色,将其合并为8种菌株。其中,C1号菌株为淡黄色菌株,C2号菌株为白色菌株,C3号菌株为黄白色菌株,C4号菌株为青绿色菌株,Y5号菌株为青绿色菌株,Y6号菌株为白色菌株,H7号菌株为黄白色菌株,H8号菌株为青绿色菌株,如图1所示。(以该地区的首字母进行依次编号,C为吉林长白山,Y为榆林镇,H为怀化市,编号与图一一对应)。
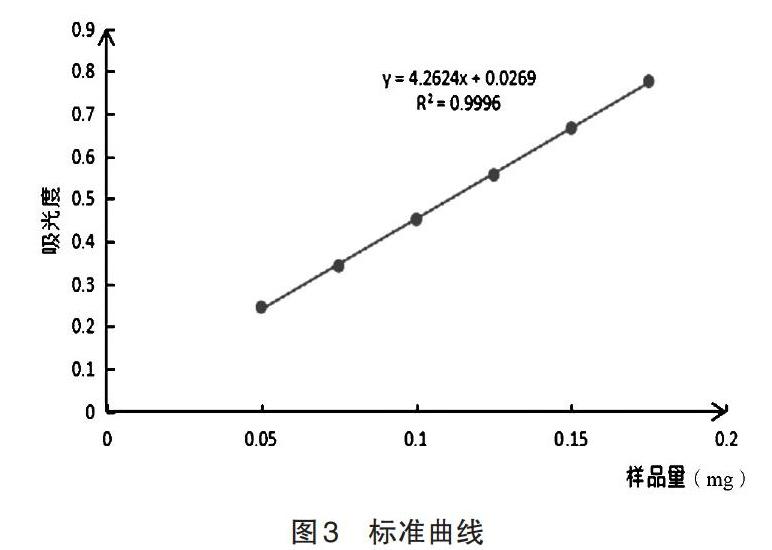
3.2 薄层色谱分析活性菌株 发酵萃取液经薄层层析(TLC),与空白对照比较,菌株C2、C3、C4、H8的部分斑点与空白对照对应斑点对比,明显较其形状大、颜色深,初步判断该菌株具有转化提高人参单体皂苷含量的活性。部分TLC结果如图2所示。空白对照、C1、C2、C3、C4、Y5、Y6、H7、H8编号与图上编号一一对应。
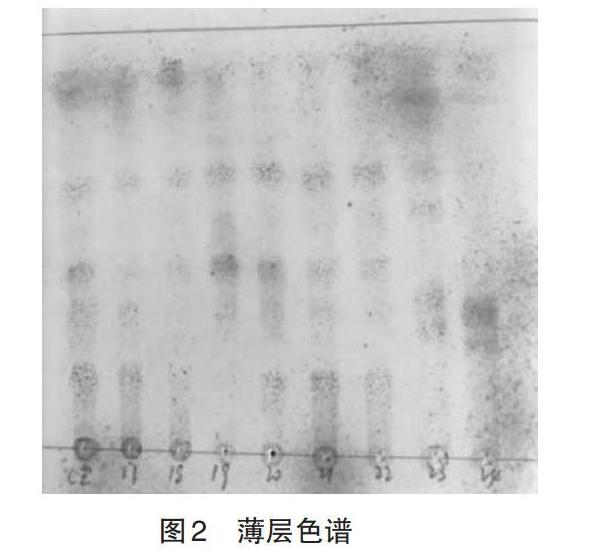
3.3 活性菌株的转化率 人参总皂苷含量测定标准曲线如图3所示,回归方程为:Y=4.2624X+0.0269,R2=0.9996。结果显示,人参皂苷Re在0.05~0.175mg范围内呈现出良好的线性关系。
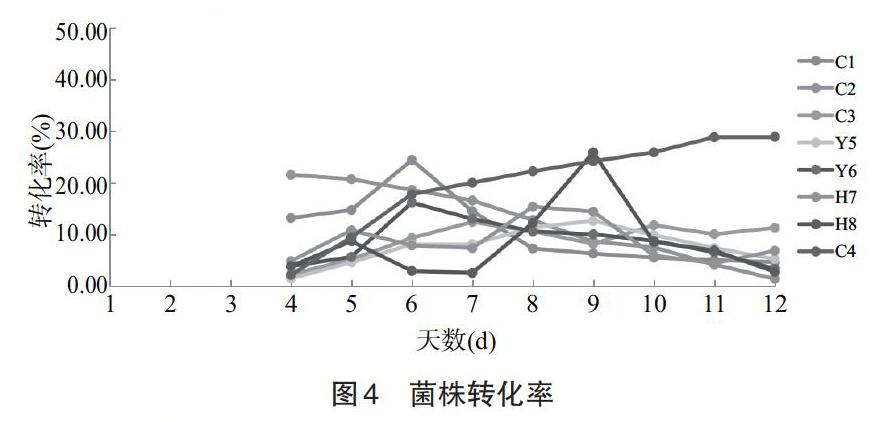
采用紫外可见分光光度法,测定菌液上清液的吸光度值,计算各菌株对于人参总皂苷的转化率,以培养天数为横坐标,以各菌株转化率为纵坐标,结果如图4所示。由图4可知,自吉林长白山鲜参根际土壤中分离出的1株菌株C4对人参总皂苷的转化率达28.92%。随着培养时间的增加,菌株C1转化率逐渐升高,第6天达到最高值为24.41%,之后转化率逐渐下降;菌株C2第4天转化率达到最高值为21.53%,之后转化率下降,人参皂苷被分解;菌株C3、Y5、Y6、H7转化率不高,菌株H8前7d趋于平稳转化,而在第9天达到转化最高值为25.89%,之后几天转化率却急速下降,而菌株C4的转化能力较为稳定且第11天转化率最高,为28.92%。
4 结论与展望
4.1 结论 本实验从鲜参根际土壤中最终筛选出8株真菌,TLC法初步判断出,具有转化人参皂苷能力的活性菌株有4株,其中菌株C4经进一步采用紫外分光光度法检测其总皂苷转化率最高为28.92%。
4.2 展望 本实验通过紫外分光光度法检测菌株发酵液的吸光度,仅能判断人参总皂苷的含量变化,而采用TLC法初步判断人参皂苷的含量变化结果显示,与空白对照比较,部分单体皂苷斑点颜色明显加深,说明该菌株有定向转化单体人参皂苷的活性,应继续采用高效液相色谱(HPLC)对其发酵液进行分析,确定对何种单体皂苷定向转化及转化率。最后,应进一步对活性菌株的培养条件、培养时间等发酵条件进行优化,以进一步提高转化率。
參考文献
[1]林福建.人参皂苷Rb1转化菌株的筛选鉴定和糖基水解酶性质分析[D].天津:天津大学,2015.
[2]周中流,李春燕,陈林浩,等.天然产物皂苷类化合物生物转化的研究进展[J/OL].中国实验方剂学杂志,2019.
[3]南博,游颖,王雨珊,等.微生物法转化人参皂苷的研究进展[J].食品研究与开发,2017,38(14):196-199.
[4]何丹,生物转化法制备人参皂苷F2的研究[D].大连:大连工业大学,2013.
[5]Lin-Hu Quan,Yeon-Ju Kim,Guan-Hao Li,et al.Microbial transformation of ginsenoside Rb1 to compound K byLactobacillus paralimentarius[J].World J Microbiol Biotechnol,2013,29:1001-1007.
[6]张丽娜,明有山,曲波权,等.微生物转化人参皂苷Re为人参皂苷Rh1的研究[J].中国酿造,2017(11):114-117.
[7]蔡小雨,闫培生,高秀君,等.人参皂苷生物转化的研究进展[J].中国农业科技导报,2018,20(4):52-60.
[8]Jin D S,Cui Y Z,Yu H S,et al.Ginsenoside Rh2 prepared from enzyme reaction[J].Dalian 1′olytech.Lniv.,2001,20(2):99-104.
[9]马子君,牛耀祥,高陆,等.人参对冬虫夏草蝙蝠蛾拟青霉固体发酵的影响[J].人参研究,2015,27(2):11-14.
[10]陈琪琪,吴晗琪,高秀君,等.西洋参中人参皂苷的真菌生物转化研究进展[J].食品研究与开发,2019,40(5):220-224.
[11]Le Cui,Song-quan Wu,Cheng-ai Zhao,et al.Microbial conversion of major ginsenosides in ginseng total saponins by Platycodon grandiflorum endophytes[J].Journal of Ginseng Research,2016,40(4):366-374.
[12]赵方允,陈自宏,虞泓,等.微生物转化人参皂苷研究进展[J].中国医药生物技术,2010(3):216-219.
[13]李浪,杨旭,薛永亮.现代固态发酵技术工艺、设备及应用研究进展[J].河南工业大学学报(自然科学版),2011,32(01):89-94.
[14]王宇.生物转化法制备人参皂苷F1及Rh1的研究[D].大连:大连工业大学,2015.
[15]岳展鹏,王贤英.紫外分光光度法测定参芪三七胶囊中总皂苷含量[J].中国药业,2017,26(1):22-24.
[16]明有山.微生物转化人参皂苷Re制备Rh[D].鞍山:辽宁科技大学,2017.
[17]吴秀丽,刘成,陈靖.黑曲霉Aspergillus niger对人参皂苷Re的微生物转化[J].中国当代医药,2011,18(33):7-9.
[18]武伦鹏,白龙律,韩春峰,等.微生物转化人参主要皂苷Rb1为C-K的研究[J].人参研究,2016(2):7-11.
[19]李东霄,常景玲,张志宏.微生物转化人参皂苷Rc和Rd的研究[J].江苏农业科学,2010(4):22-25.
[20]金艳,金香梅,尹成日.微生物转化人参皂苷Rb1为稀有皂苷F2[J].延边大学农学学报,2011(2):112-116.
[21]Aling Dong,Min Ye,HongzhuGuo et al.Microbial transformation of ginsenoside Rb1 by Rhizopus stolonifer and Curvularia lunata[J].Biotechnology Letters,2003(25):339-344.
[22]高娟.糖苷酶转化人参皂苷的研究[D].哈尔滨:东北师范大学,2012.
[23]金同庆,朱华荣.降脂脉安颗粒质量标准研究[J].亚太传统医药,2015,11(15):42-46.
(责编:张宏民)
