多孔立方Cu2O纳米膜的制备及吸附性能
2019-09-11肖坤儒侯家麒许亚兰
肖坤儒,侯家麒,许亚兰,杨 明
(武汉轻工大学化学与环境工程学院,武汉430023)
合成染料在生产和处理过程中有12%以废水形式排出[1].染料废水具有成分复杂、有机物含量高、可生化性差、毒性高等特点,很容易造成水体污染,破坏水体生态系统[2-4].染料废水的常用处理技术主要有:1)物理法[5-7],比如吸附法、萃取法、膜分离法等;2)化学法[8-10],比如光催化降解法、化学氧化法、电化学法等;3)生物法[11-12],比如好氧—厌氧法、生物絮凝法、高效菌种法等.其中,吸附法具有成本低、操作简单、效率高、材料来源广等优点,已成为应用最广泛的方法之一[5,13].Cu2O 是一种常见的无机吸附材料,对染料的吸附作用与其形貌结构有很大的关系,其结构形貌不同样品的比表面积差距很大,与染料的结合位点数目也不相同,对于同种材料,一般球形和多孔的结构比表面积大,吸附效果较好,其合成方法也是多种多样.Errokh等[14]用液相还原法,在棉纤维上还原出Cu2O颗粒.Bhosale等[15]以乙酸铜和甘油为原料,在超声辅助作用下,制得球状纳米 Cu2O.Al-Kuhaili[16]使用热蒸发沉积法在500℃高温条件下,热处理Cu2O粉末3 h制得Cu2O薄膜.以上方法存在操作复杂、反应时间长或者是需要超声、高温等环境的特点,而且样品结构和纯度也存在一定的缺陷.
本文在常温、常压条件下采用界面法一步合成的多孔立方Cu2O膜,以此样品作为吸附剂,考察了其对甲酚红染料模拟废水的吸附效果,为新型高效染料废水吸附剂的研发提供依据.
1 实验
1.1 实验试剂和仪器
氯化铜、正丁醇、正己醇、硫酸羟胺、甲酚红、氢氧化钠、盐酸(实验试剂均为分析纯).XRD-7000型 X射线衍射分析仪(日本岛津);S-3000N扫描电子显微镜(日本日立);TGL-16C高速离心机(上海安亭科学);7200可见光分光光度计(上海尤尼科);雷磁PHS-3G pH计(上海仪电科学);DF-101S集热式恒温加热磁力搅拌器(巩义市予华);AL-204电子天平(梅特勒-托利多).
1.2 多孔立方纳米Cu2O膜的制备和表征
在50 mL的比色管中加入20.00 mL一定浓度的硫酸羟胺水溶液(水相),用NaOH调节溶液pH为指定值,在比色管上方缓慢加入20.00 mL,一定浓度的 CuCl2正丁醇/正己醇溶液(油相),在不同温度下静置反应一段时间,取出界面处产物,用蒸馏水清洗几遍,干燥后即得砖红色纳米Cu2O膜.当温度为室温(30℃),CuCl2正丁醇溶液浓度为50 mmol/L,硫酸羟胺水溶液浓度为150 mmol/L,pH=10.00时,所得的产物形貌结构最好,为多孔立方结构.用XRD-7000型X射线衍射分析仪分析样品晶相;用S-3000N扫描电子显微镜观察样品表面形貌及结构.
1.3 吸附实验
取一定量的Cu2O加入到50 mL一定浓度的甲酚红溶液中,用NaOH和HCl调节溶液pH在指定范围内,在一定温度下搅拌,每隔一定时间进行取样离心后,以蒸馏水为参比测量吸光度.
2 实验结果
2.1 不同反应条件的选择
2.1.1 浓度对样品形貌的影响
当温度为室温,硫酸羟胺水溶液的浓度为0.15 mol/L、pH=12.00 时,在 CuCl2正丁醇溶液浓度分别为50、100、200 mmol/L浓度条件下制备所得的Cu2O膜,其形貌结构如图1所示.

图1 不同浓度条件下Cu2O样品SEM照片Fig.1 SEM images of Cu2O sample at different concentrations
图1 (a)为CuCl2正丁醇溶液浓度50 mmol/L时的SEM照片,可以看出样品形貌为规则的正方体结构,并且颗粒分布均匀;当CuCl2浓度增加到100 mmol/L时,如图1(b)所示,立方体结构受到破坏,此时颗粒没有固定形态;当CuCl2浓度再增加到200 mmol/L时,如图1(c)所示,立方体结构进一步遭到破坏,这时颗粒开始向球形转化.其主要原因是随着溶液浓度的增大,反应速率不断加快,原本生成的立方结构表面又会有新的产品附着上去,致使其形貌慢慢向球形转变.因此为了得到规则立方结构样品,实验选择CuCl2溶液浓度50 mmol/L.
2.1.2 温度对样品形貌的影响
当控制CuCl2正丁醇溶液浓度为50 mmol/L,硫酸羟胺水溶液的浓度150 mmml/L,pH=12.00时,在温度分别为30、60、90℃条件下反应所得样品的SEM照片如图2所示.

图2 不同温度条件下Cu2O样品SEM照片Fig.2 SEM images of Cu2O sample at different temperatures
从图2可以看出:3个样品均为立方结构,不同的是,30℃时所形成膜的致密度不如60℃条件下反应所得的样品;当温度上升到90℃时,致密的膜又开始分散开来,形成单个的立方结构并且立方结构受到一定的破坏.其主要原因是温度越高,反应越快,在颗粒尚未形成完整的立方结构之前新的颗粒就已经形成,从而使它们迅速生长在一起,形成一整块致密的薄膜.但是,当温度90℃时,过高的温度使得这些颗粒运动加快,没法附着在一起,并且在运动过程中颗粒之间也存在一定的碰撞,对其立方结构也会有一定的破坏,因此,温度主要会对生成膜的致密性产生一定影响.综合实验结果和节能角度考虑,本实验选择反应温度为室温环境30℃.
2.1.3 水相pH对样品形貌的影响
在温度为室温,CuCl2正丁醇溶液的浓度为50 mmol/L,硫酸羟胺水溶液的浓度为150 mmol/L、pH分别为12.00和10.00条件下,反应所得样品的SEM照片如图3所示.

图3 不同水相pH条件下Cu2O样品SEM照片Fig.3 SEM images of Cu2O sample at different pHs
图3 (a)为水相pH=12.00时SEM照片,可以看出该样品膜的致密性比图3(b)好,但是其立方结构表面并没有孔隙形成,而图3(b)在水相pH=10.00的条件下所形成的膜立方结构上形成的孔隙较多且明显.主要原因是随着pH的升高,硫酸羟胺的还原性会增强,反应速率也会随之加快,反应过程中生成的N2O气体会快速溢出,所以当pH=12.00时生成膜的致密性较好,而几乎没有孔隙;而在pH=10.00反应速率相对较慢,再加之在反应过程中N2O气体慢慢溢出,使得生成样品具有较好的多孔结构.由此水相pH主要影响生成样品的孔隙率,pH越低孔隙率越高,但当pH低于10.00时,硫酸羟胺的还原性较弱,反应速率过慢,而且样品产率极低.为了得到孔隙较好的样品,本实验选择水相pH=10.00.
2.1.4 油相溶剂对样品形貌的影响
将溶解CuCl2的油相试剂正丁醇换成正己醇,在室温条件下,硫酸羟胺水溶液的浓度仍为150 mmol/L,图4(a)和(b)分别是CuCl2浓度为50 mmol/L,水相 pH 值分别为10.00和12.00条件下反应所得的SEM图,图4(c)是CuCl2浓度为100 mmol/L,水相pH=12.00反应条件下所得的SEM照片.
对比图4与图3可知,在其他反应条件不变的情况下,改变油相试剂后,样品的形貌结构和孔隙率都会受到很大影响.主要原因是正己醇比正丁醇的极性要弱,在界面处与水相相容性会变小,反应速率减慢,其次是正己醇的粘度比正丁醇大,使得在油相中溶解的Cu2+扩散速度减慢,也使得反应减慢.当CuCl2浓度升高到100 mmol/L时样品会从立方体向球形转化,这也验证了2.1.1小节所得的结论,样品的形貌主要受CuCl2溶液浓度的影响.

图4 正己醇作为油相试剂条件下Cu2O样品SEM照片Fig.4 SEM images of Cu2O sample at 1 - Hexanol
2.2 样品XRD表征
当反应体系为正丁醇—水,CuCl2浓度为50 mmol/L,水相pH=10.00时,产物为均匀分散的多孔立方Cu2O膜.此样品的XRD谱图如图5所示,可以看出,其不同晶面对应峰的位置2θ分别为 29.54°、36.42°、42.28°、61.31°、73.48°、77.46°,没有其他杂峰出现,与国际衍射数据库中心数据JCPDS,No.05-0667相吻合,由此也验证了该Cu2O样品为立方结构,且纯度极高.根据谢乐公式可以计算出该样品的晶粒尺寸为18 nm.
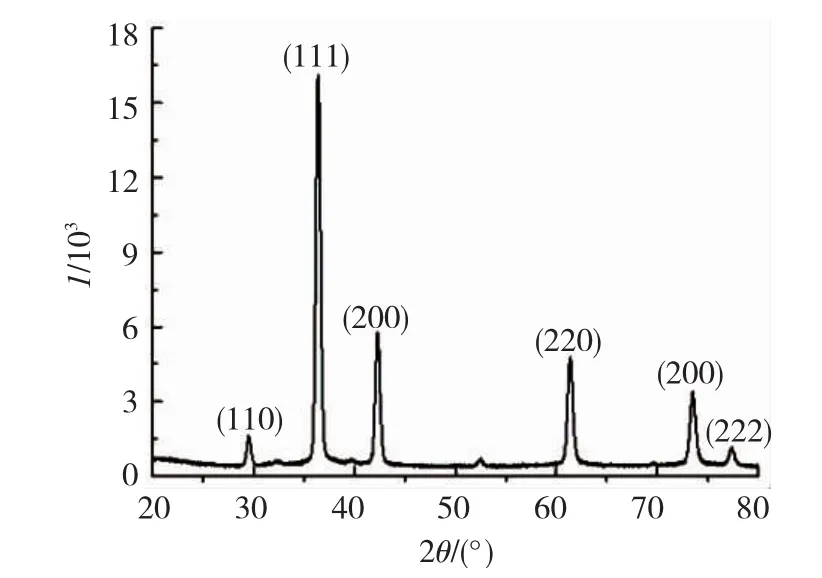
图5Cu2O样品XRD谱图Fig.5 X-ray diffraction pattern of Cu2O sample
2.3 样品SEM表征
图6 为样品(与2.2小节反应条件相同的样品)的SEM照片,可以看出样品是由立方结构的多孔Cu2O颗粒自组装而成的纳米膜,通过Nano Measurer可计算出该立方颗粒边长为200~500 nm,图6(b)是样品膜的横切面图,可以看出该膜的厚度约为600 nm.
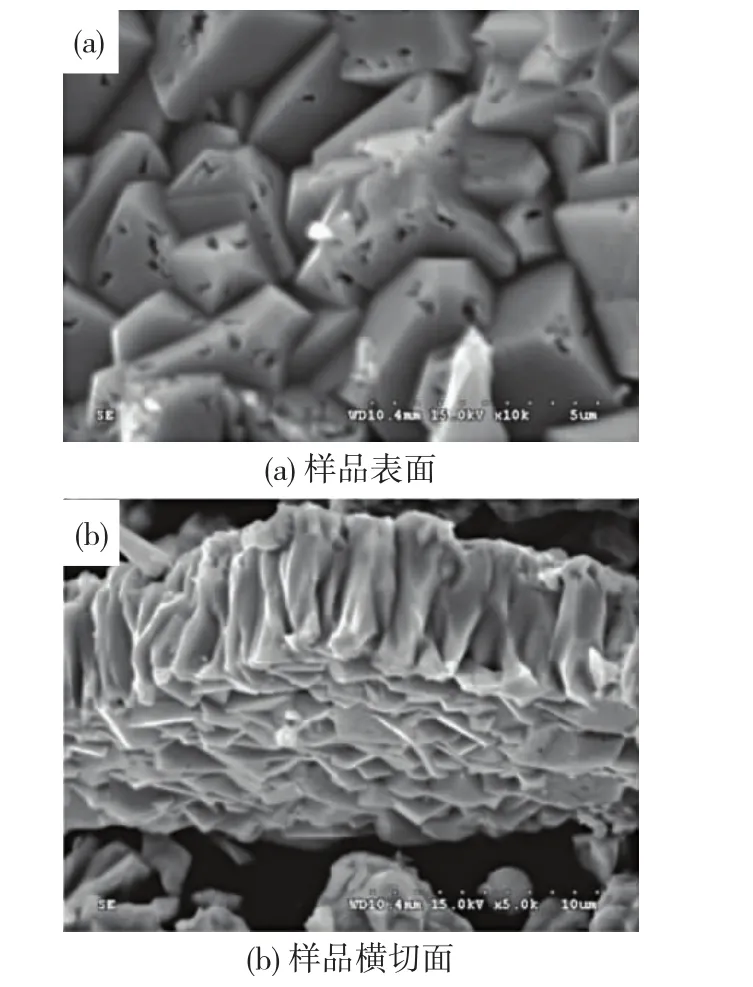
图6 Cu2O样品的SEM照片Fig.6 SEM images of Cu2O sample:(a)surface of sample;(b)cross section of sample
2.4 纳米自组装多孔立方Cu2O膜形成机理
基于对Cu2O膜形成机理的研究,其反应方程式如下:
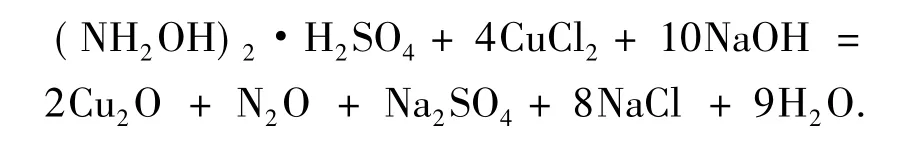
实验中以用硫酸羟胺还原氯化铜,调节水相溶液pH=10.00,静置反应一段时间后,在界面处可以观察到有致密的自组装砖红色膜生成.反应机理示意图见图7.图8(a)反应刚过程摄像图.

图7 纳米自组装多孔Cu2O膜形成机理示意图Fig.7 Basic process of self-assembled nano-porous Cu2O film

图8 纳米Cu2O膜界面反应过程拍照图Fig.8 Cu2O film interfacial reaction process image:(a)initial reaction stage;(b)7 days after the reaction
2.5 样品对甲酚红吸附效果影响
配制不同浓度的甲酚红溶液于436 nm处以蒸馏水为参比,测其吸光度,作甲酚红标准曲线,其线性方程为C=21.359 30A-0.086 48,C为甲酚红浓度,A为吸光度,相关系数为0.999 97,结果表明,在甲酚红质量浓度为0~40 mg/L内线性关系极好.
实验还探究了吸附时间、甲酚红初始质量浓度、溶液pH值、吸附剂投加量和反应温度对脱色率的影响.其中,当吸附时间为60 min时,吸附达到饱和;甲酚红初始浓度和温度对吸附效果影响不大,当甲酚红质量浓度在15~35 mg/L时,脱色率均可达到80%以上,特别是在甲酚红初始质量浓度为30 mg/L时,脱色率可达86%;温度在20~50℃变化时,对吸附效果基本没影响,故从节约能耗方面考虑,吸附选取室温30℃;溶液pH值和Cu2O投加量对脱色率的影响较大,其影响结果分别如图9和10所示.
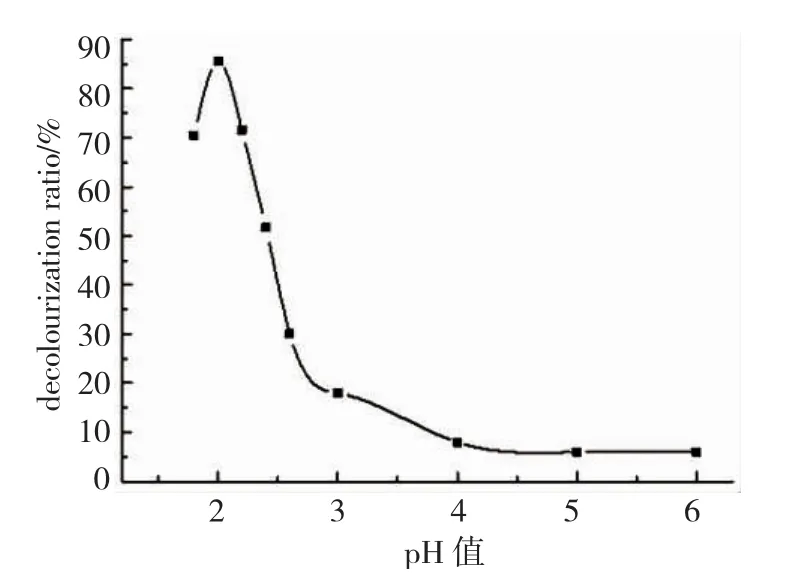
图9 溶液pH和脱色率的关系曲线Fig.9 Relationship between pH and decolorization ratio
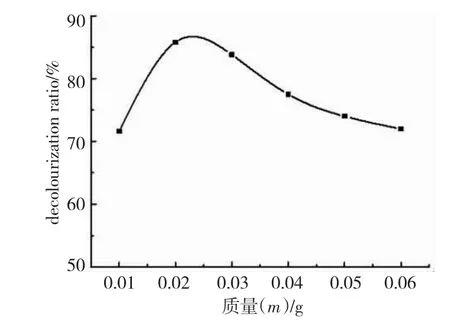
图10 Cu2O投加量和脱色率的曲线图Fig.10 Relationship between dosage of Cu2O and decolorization ratio
由于甲酚红染料的颜色受pH影响(第一次显色范围为0.2 ~1.8,第二次显色范围为6.5 ~8.5),所以pH影响实验选择测定范围为1.8~6.0.由图9可以看出,在溶液pH不同的情况下,甲酚红溶液的脱色率有明显的区别,pH会影响Cu2O表面所带电荷的电量和电性,而其表面的电荷性质决定了其对甲酚红的吸附行为,在溶液pH>3.00时,甲酚红溶液的脱色率极低,随着溶液pH的降低,脱色率迅速上升,但当pH降到2.00以下时,脱色率又开始降低,主要原因是pH过低,溶液中H+含量高,Cu2O会与H+反应,消耗部分了Cu2O,并且此时溶液的pH也有所上升,导致其脱色率又有所下降.故实验选择溶液的pH=2.00.
由图10可知,在Cu2O质量为0.01~0.02 g时,随着Cu2O投加量的增加,吸附效率有明显的升高,这是因为在甲酚红初始浓度不变的情况下,由于吸附剂的增加,吸附剂的吸附位点增加,从而使得吸附效率明显的增加.但当Cu2O投加量大于0.02 g后,随着投加质量的增加,脱色率会下降,主要原因是当Cu2O加入较多时,Cu2O与溶液中的H+反应机率就大大增加,溶液pH上升,吸附停止,从而导致脱色率有所下降.故实验选择Cu2O 的用量为0.02 g.
3 结论
1)在正丁醇—水液液界面体系中,用硫酸羟胺在pH=10.00条件下还原CuCl2,成功制备了自组装多孔立方Cu2O膜,立方体边长为200~500 nm,膜的厚度约为600 nm.
2)不同反应条件对样品质量有较大的影响,其中溶液浓度主要会对样品形貌产生影响,浓度较低时呈立方体形貌,较高则向球形转变;反应温度决定了生成膜的致密性;而孔隙率主要受pH的控制;油相溶剂也对生成样品质量有一定影响.
3)多孔立方Cu2O膜吸附甲酚红迅速、高效,60 min可以达到吸附饱和,其吸附最优条件为:甲酚红初始质量浓度 30 mg/L、溶液 pH=2.00、Cu2O投加量为0.02 g、温度30℃.在此条件下脱色率可达86.37%.这表明自组装的立方多孔Cu2O具有很好的吸附性能,适合染料废水处理.
