不同激素、基质配方对“花叶”玉簪组培苗快繁的影响
2019-09-10张春梅
张春梅

[摘要]以“花叶”玉簪的组培苗为试材,研究了不同激素水平、基质配方对“花叶”玉簪组培苗增殖、诱导生根及移栽成活率的影响。结果表明:1)“花叶”玉簪的最适增殖培养基为MS+3.0 mg/L 6-BA(6-苄基-氨基腺嘌呤)+0.1 mg/L NAA(萘乙酸)+0.4 mg/L ZT(玉米素),培养35 d后,其增殖倍数为3.0;2)“花叶”玉簪的最适生根培养基为1/2 MS+0.5 mg/L IBA(吲哚丁酸),培养25 d的生根率为86.66%;3)“花叶”玉簪组培苗移栽的最佳基质配比是泥炭∶黄土∶珍珠岩=3∶1∶2,移栽两个月后成活率为99%,鲜重为1.5 g/株,叶片数和根数为17片和13根及叶长和根长达到5.2 cm和10.2 cm。
[关键词]激素;基质;“花叶”玉簪;组培苗
[中图分类号]S 682.19[文献标志码]A[文章编号]1005-0310(2019)03-0067-0
Abstract: In the paper, the effects of different hormones, media formula on the proliferous, root induction and survival rate of transplanting of Hosta undulate have been studied. The results showed that the best medium of tissue-culture seedlings for proliferation of Hosta was MS+3.0 mg/L 6-BA+0.1 mg/L NAA+0.4 mg/L ZT, and the proliferation multiples was 3.0 after 35 days; The most suitable rooting medium was 1/2MS+0.5 mg/L IBA and the highest rooting percentage was 86.66% after 25 days. Meanwhile, taking the quality of plantlets and economy into account,
Vpeat∶Vloess∶
Vperlite=3∶1∶2 was the optimal substrate for transplanting of tube plantlets of Hosta undulata, the survival rate was 99% after two months of transplanting, and the fresh mass was 1.5 g/plant, the number of leaves and roots was 17 and 13 and the length of leaf and root reached 5.2 cm and 10.2 cm.
Keywords: Hormones; Substrate; Hosta undulata; Tissue culture seeding
0引言
“花葉”玉簪(Hosta undulata),别名波叶玉簪,原产中国和日本,属多年生宿根草本植物,国内多认定属于百合科(Liliaceae),是一种比较流行的居室盆栽观叶观花类花卉,或在园林和庭院进行露地栽培或盆栽,深受人们喜爱[1]。玉簪除具有较高的观赏价值外,全株均可入药,具有利湿、调经止带之功效,根入药清热消肿、解毒止痛,叶能解毒消肿。近年来,已成为极具开发前景和药用价值的花卉[2]。
玉簪的繁殖方法通常采用种子繁殖、分株繁殖及组织培养繁殖,但玉簪从播种到开花至少需3年时间,且种子繁殖的后代不能保持亲本的优良性状,因此,生产中一般不用其种子进行繁殖[3-4]。分株繁殖是玉簪生产中的常用方法,但因其繁殖速度较慢,年增殖系数为3~4倍[5],而且实生苗容易出现退化现象[6],不能达到快速繁殖和大面积进行种苗推广应用的要求。植物快速繁殖技术是植物组织培养在农业生产中应用最广泛、产生经济效益最大的研究领域,近年来种植苗需求量较大,因此,必须利用植物组织培养技术进行“花叶”玉簪繁殖。此技术繁殖花卉具有明显优势:能高度保持遗传性状稳定、繁殖系数高、生产周期很短、生产过程中占地面积小等,该技术在花卉植物生产中受到越来越多的重视。因此,本试验在前人的研究基础上,对“花叶”玉簪增殖的激素配比、生根培养基与移栽的基质配方进行了优化研究,筛选出合理高效的玉簪增殖激素配比、生根培养基和移栽基质,并完善了移栽后的管理技术,为我国玉簪的组培工厂化育苗提供一定的科学依据。
1材料与方法
1.1试验地点、时间及材料
本试验于2017年2—6月在上海园艺大地种苗有限公司组培研究室进行,材料为前期培养所获得无病害、生长健壮的“花叶”玉簪(Hosta undulata)的分化苗。
1.2试验方法
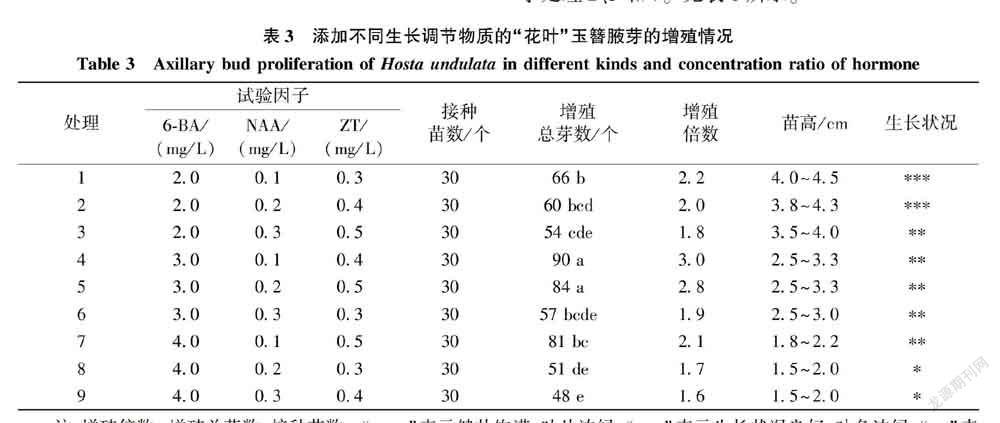
1.2.1不同激素配比对“花叶”玉簪组培苗增殖的影响以MS培养基为基础培养基,加蔗糖30 g/L,琼脂6 g/L,PH值为5.9。采用3因素3水平正交试验设计L9 (33) 方案(见表1),添加不同质量浓度的6-BA
(2.0、3.0、4.0 mg/L)、NAA(0.1、0.2、0.3 mg/L)和ZT(0.3、0.4、0.5 mg/L)至MS培养基中,每处理接种10个外植体,3次重复,接种7 d观察组培苗生长情况,培养35 d后统计总芽数、增殖倍数、苗高及生长状况(培养条件白天为24 ℃、夜间为20 ℃左右,光照时间为13.5 h/d,光照强度为2 000 lx)。
1.2.2不同培养基对“花叶”玉簪组培苗生根的影响
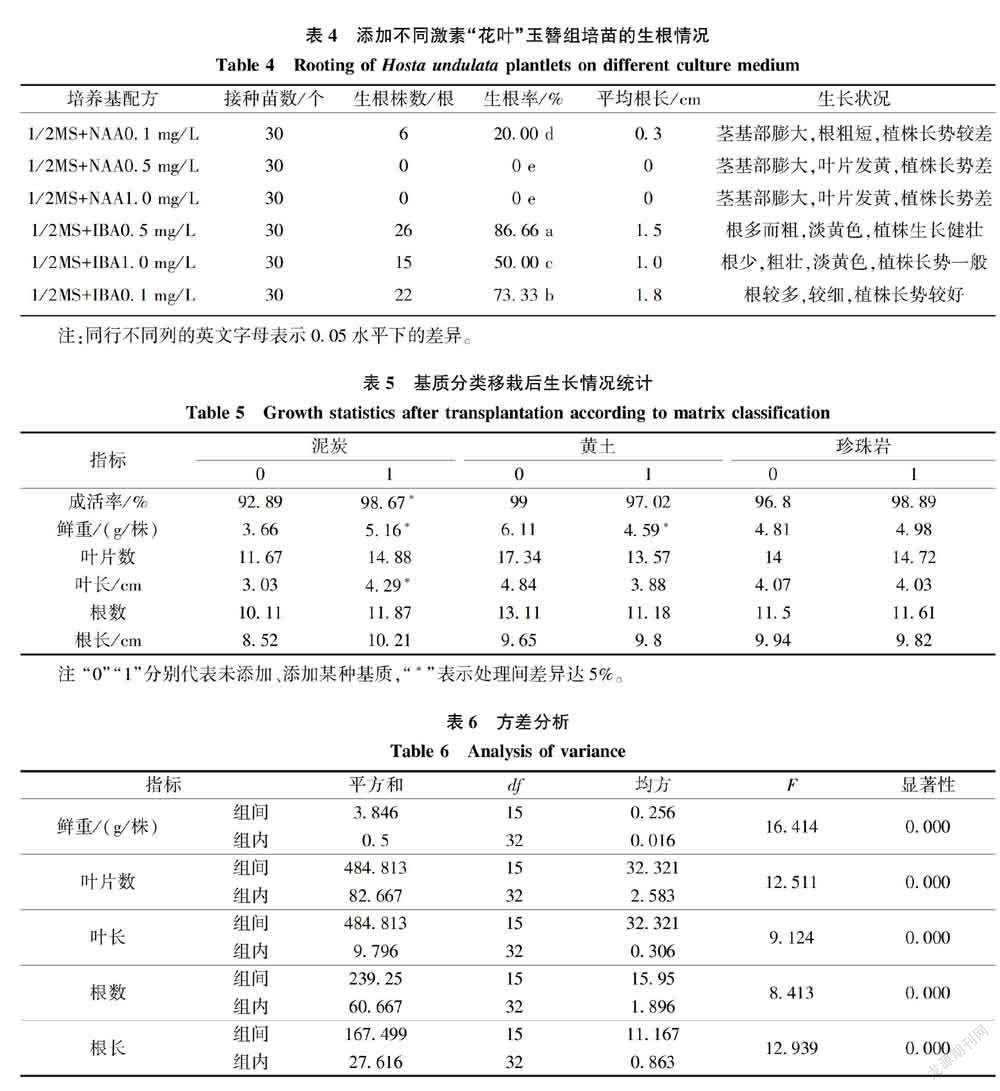
切取生长健壮的组培苗接种于添加不同质量浓度生长素NAA(0.1、0.5、1.0 mg/L)、IBA(0.1、0.5、1.0 mg/L) 的1/2 MS培养基上(大量元素减半,其他元素保持不变),每处理接种10个外植体,3次重复,培养25 d后统计生根情况,即接种苗数、生根株数、生根率、平均根长、生长状况(培养条件白天24 ℃、夜间20 ℃左右,光照时间为13.5 h/d,光照强度为2 000 lx)。
1.2.3不同移栽基质配方对“花叶”玉簪组培苗移栽成活率及生长状况的影响
1.2.3.1试验材料及设计
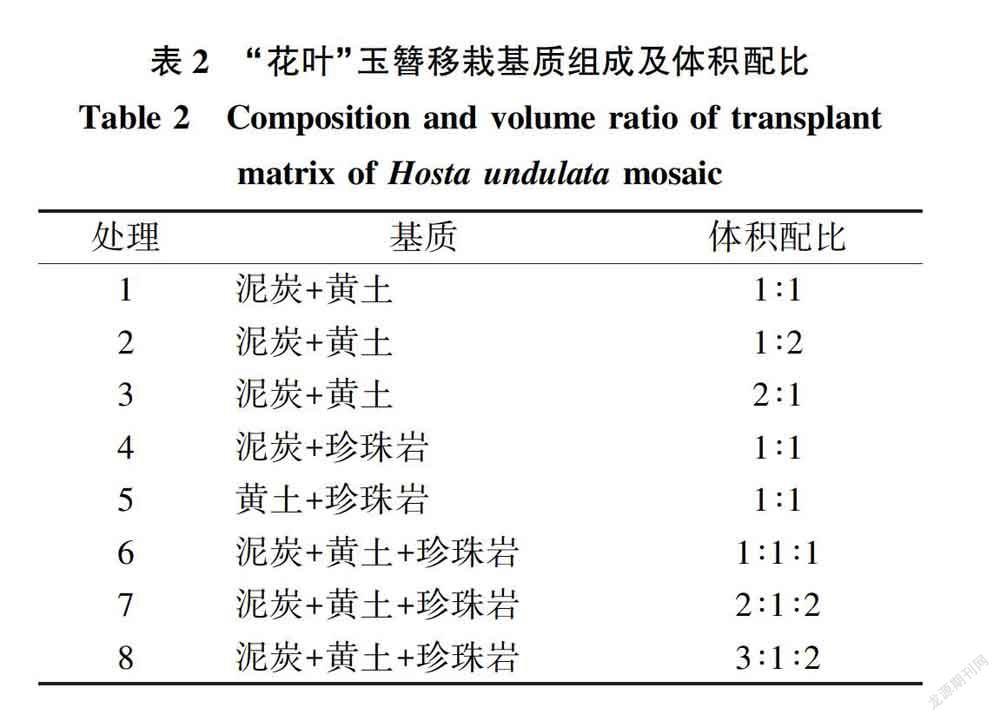
所选材料为前期所获得的苗高达4~5 cm、长势均匀一致的健壮生根组培苗,每个处理36株苗,移栽定植于12孔的育苗盘中,选用泥炭、黄土和珍珠岩3种基质,按各成分含量梯度不同设置8个处理组合(见表2),每12株(1个穴盘)为1个试验小区,重复3次。
1.2.3.2移栽前驯化、移栽及栽后管理
将3种基质按设计的体积比混合均匀后采用百菌清、多菌灵混合消毒液消毒灭菌后,备用。将组培苗在培养室散射光下炼苗3 d,然后打开封口在温室大棚内锻炼2 d,最后用镊子将组培苗取出,洗净根部琼脂,去除枯黄叶并对组培苗根系进行修剪整理,选取苗高和生根情况一致的苗移栽入装有基质的12孔育苗盘中,每穴定植1苗,定植水浇透。移栽后盖上透明塑料袋套盒以保湿,生长温度控制在20~25 ℃左右,空气湿度保持在60%~75%之间,光照强度为1 200 lx。移栽2个月后,统计成活率及移栽幼苗生长情况(鲜重、叶片数、叶长、根数和根长)。
2结果与分析
2.1不同激素配比对“花叶”玉簪组培苗增殖的影响
“花叶”玉簪不定芽接种12~14 d后,基部腋芽开始萌动而产生突起。由表3可知,随着时间的延长腋芽不同程度增长,30~35 d后腋芽大小及增殖倍数存在差异。“花叶”玉簪在添加质量浓度为3.0 mg/L的6-BA、0.1 mg/L的NAA和较高质量浓度(0.4 mg/L和0.5 mg/L)ZT培养基中的芽增殖总数较多,即处理4和处理5的芽增殖较多,分别为30个和28个,且与其他处理差异显著,植株长势良好,最高增殖倍数为3.0。6-BA的质量浓度过高时,“花叶”玉簪的生长状况较差,苗高降低,叶片颜色较淡,添加低质量浓度6-BA处理的苗高呈上升趋势,植株生长健壮,叶片浓绿。结果表明,基础培养基中添加低质量浓度6-BA有利于组培苗生长。
2.2不同培养基配方对“花叶”玉簪组培苗生根的影响
由表4看出,一定质量浓度的IBA对“花叶”玉簪生根有明显影响,1/2MS培养基添加不同质量浓度的IBA和NAA均能促进“花叶”玉簪组培苗生根。IBA质量浓度为0.5 mg/L,培养25 d的生根率最高,为86.66%,与其他处理的生根率差异显著;根长1.5 cm左右,植株生长健壮,叶片浓绿。添加NAA的生根效果较差,添加高质量浓度NAA的培养基中,植株几乎不生根,且组培苗长势差,叶片发黄,质量浓度为0.1 mg/L NAA 的玉簪生根率仅为20.00%,根粗短。
2.3移栽基质配方对玉簪苗移栽成活率及生长状况的影响
通过比较分析表5中幼苗在不同基质中移栽成活率和鲜重,组培苗移栽60 d后,只在处理1、2和5中发现了死亡植株,在其他处理中移栽成活率均为99%;处理8中幼苗的鲜重最大,明显优于其他处理,泥炭对花叶玉簪移栽成活率有显著促进作用,黄土则显著降低其移栽成活率;对幼苗在不同基质中叶片数和叶长比较分析发现,基质对叶片数和叶长均有影响。处理8中幼苗生长情况明显优于其他处理,前者叶片数和叶长分别不少于17.34片和4.84 cm;对幼苗在不同基质中根数和根长比较分析发现,基质对幼苗根数和根长的影响较为明显。在根数方面,处理8的平均根数为13.11,与处理2差异显著;在根长方面,处理1、3和8显著大于处理2、5和7。见表6所示。
3讨论与结论
近年来,玉簪属植物的组织培养研究主要围绕寻找组织培养最佳条件、降低生产成本和缩短生产周期等方面。
3.1不同激素配比对“花叶”玉簪组培苗增殖的影响
在植物组织培养过程中,因种类、组合及使用浓度的差别,激素会发挥不同效应。有学者认为,6-BA促进分化、芽形成及诱导愈伤组织发生,抑制根发育及衰老,6-BA 与NAA 配合使用,能有效促进芽增殖与根诱导[7]。ZT的主要作用是促进细胞分裂,延缓组织衰老,增加蛋白质合成,抑制顶端优势,促进侧芽生长[8],但关于激素的最适剂量,并不统一。本试验结果表明,最适合“花叶”玉簪增殖的培养基为MS+3.0 mg/L 6-BA+0.1 mg/L NAA+0.4 mg/L ZT,培养35 d的增殖倍数为3.0,苗生长良好,叶色浓绿,这与王春婷等(2006)[3]的研究结果不一致。品种为“法兰西”与“甜心”的玉簪增殖芽分化效果最佳培养基为MS+6-BA2.0 mg/L+NAA0.2 mg/L[9],可能是由于不同基因型的培养材料在增殖过程中所需的激素浓度不同。本试验说明培养基中添加一定比例的6-BA、ZT和NAA,能有效促进“花叶”玉簪不定芽的分化。培养基内添加一定量的NAA,启动率会随着6-BA质量浓度的增加而升高,这与胡相伟[10]的观点一致。除6-BA、NAA 外,2,4-D、KT也具有刺激植物生长、促进细胞分裂的作用,但目前未见有用在玉簪组织培养中的报道[10]。
3.2不同培养基配方对“花叶”玉簪组培苗生根的影响
本试验结果表明,随着NAA的质量浓度增大,“花叶”玉簪组培苗几乎不生根,且生长状况变差,叶片发黄,质量浓度为0.1 mg/L NAA 的玉簪生根率仅为20.00%,根粗短,说明NAA不适合“花叶”玉簪组培苗生根,基础培养基中添加低质量浓度IBA根多而粗,淡黄色,植株生长健壮,可作为生根壮苗培养基,最适宜生根培养基为1/2 MS+0.5 mg/L IBA,培养25 d的生根率为86.66%,植株生长健壮,叶色浓绿。与周青等(2005)的研究结果一致[7],与冯慧等(2006)[5]、郝砚英等(2006)[11]和陈必胜等(2007)[12]研究得出IBA和NAA均能诱导玉簪生根的结果有一定差异,可能与品種不同有关。
3.3移栽基质配方对“花叶”玉簪苗移栽成活率及生长状况的影响
组培苗移栽是整个组培生产中至关重要的环节,移栽基质为幼苗提供水、气、肥等根系环境,基质性状的优劣直接影响组培苗的移栽成活率和后期生长,移栽基质的筛选是确保瓶苗移栽成活和幼苗生长的重要因素之一。玉簪喜阴湿环境,要求土层深厚、肥沃湿润且排水良好的沙质土壤[13],富含腐殖质的泥炭能够促进玉簪移栽成活以及后期玉簪根系和地上部分的生长[14],而在基质中添加适量的珍珠岩能够在一定程度上改善土壤保水能力及通气条件[15],同时,珍珠岩保肥能力不足则不利于后期叶片和根系的生长,而黄土透气性差,根系易腐烂,严重影响移栽成活和叶片的生长,但吸水性和保水性强,有利于后期根的生长[16]。本试验结果表明,最适宜玉簪组培苗移栽的基质为泥炭∶黄土∶珍珠岩=3∶1∶2,这可能与基质的化学成分及理化性质不同有关。珍珠岩有利于移栽成活,但不利于后期叶片和根系的生长,泥炭促进玉簪移栽成活和生长,而黄土严重影响移栽生根成活和叶片的生长,但有利于后期根的生长。由本试验结果得出,花叶玉簪移栽基质的透气性与保水性是移栽成活率较高的关键因素。
综上所述,“花叶”玉簪的最适增殖培养基为MS+3.0 mg/L 6-BA+0.1 mg/L NAA+0.4 mg/L ZT,培养35 d后,其增殖倍数为3.0;“花叶”玉簪的最适生根培养基为1/2 MS+0.5 mg/L IBA,培养25 d的生根率为86.66%;“花叶”玉簪组培苗移栽的最佳基质配比是泥炭∶黄土∶珍珠岩=3∶1∶2,移栽两个月后成活率为99%,鲜重为1.5 g/株,叶片数和根数为17片和13根及叶长和根长达到5.2 cm和10.2 cm。
玉簪品种繁多,在同时进行的其他品种玉簪的组织培养研究中,发现激素影响和培养基种类还有较大差异,有待进一步的对比研究。
[参考文献]
[1]张向东,张小虎. 玉簪的繁殖及栽培技术[J].林业实用技术,2006(1):39.
[2]李黎,陈菲,宫伟. 玉簪简化组培技术研究[J].国土与自然资源研究,2007(4):93-94.
[3]王春婷,石大兴,王米力. 紫鄂玉簪的组织培养和快速繁殖[J].植物生理学通讯,2006,42(4):685.
[4]张金政,施爱萍,孙国峰,等. 玉簪属植物研究进展[J].园艺学报,2004,31(4):549-554.
[5]冯慧,王茂良,王建红,等. 玉簪花器官植株再生体系的建立[J].北京农学院学报,2006,21(3):42-45.
[6]SCHULTZ H C, KEEVER G J, KESSLER J R. Application timing affects offset formation in hosta[J]. Journal of Environmental Horticulture, 2000(2)2:63-65.
[7]周青,任旭琴,俞建飞,等. 玉簪的组培快速繁殖技术研究[J].江苏农业科学,2005(6):89-91.
[8]郑永娟,汤春梅.植物组织培养[M]. 北京:中国水利水电出版社,2012.
[9]唐渊,赵欢,刘春,等. 不同激素水平对玉簪“法兰西”“甜心”芽诱导与生根的影响[J].农业科学研究,2014,35(3):15-19.
[10]胡相伟. 法兰西玉簪组培技术[J].甘肃科技,2013,29(4):146-148.
[11]郝砚英,赵哀梅,王勇,等. 花边玉簪的组织培养与快速繁殖技术研究[J].天津农业科学,2006(2):18-19.
[12]陈必胜,莫键彬,杜永芹,等. 玉簪新优品种离体培养技术的研究[J]. 上海农业学报,2007(2):77-80.
[13]周鹏,陈庆生,黄利斌,等. 不同基质对花叶玉簪组培苗移栽生长的影响[J].林业科技开发,2014,28(4):76-79.
[14]ZHANG J Z, SHI L, SHI A P, et al.Photosynthetic responses of four hosta cultivars to shade ttreatments [J]. Photosynthetica,2004,42(2): 213-218.
[15]金国庆,周志春,胡红宝,等. 3种乡土阔叶树种容器育苗技术研究[J].林业科学研究,2005,18(4):387-392.
[16]邓萌伟,邹海凡,张昌福,等.油茶扦插育苗两种基质不同配比与成活生长的影响[J].中国林副特产,2013(5):34-37.
(责任编輯李亚青)
