灵芝-蔬菜温室间作栽培对产量的影响及其CO2互补效应
2019-09-10陈华叶菁黄毅斌翁伯琦王义祥
陈华 叶菁 黄毅斌 翁伯琦 王义祥

摘 要:【目的】探讨菌蔬温室间作下不同食用菌和蔬菜数量配比对其互作效应的影响,为设施菌蔬间作技术研究与应用提供科学依据。【方法】利用温室控制试验研究了不同灵芝-蔬菜温室间作栽培对蔬菜生长和灵芝碳素转化利用的影响,以及温室内CO2浓度变化差异。【结果】蔬菜单作模式下温室内CO2浓度日变化较为平缓,菌蔬间作模式下灵芝培养料中的碳素以呼吸消耗的形式排放(占总碳量的51.62%~52.46%),导致温室内CO2浓度夜间处于较高值,白天显著下降。灵芝+蔬菜间作模式灵芝产量比灵芝单作和灵芝(减半量)+蔬菜间作方式分别提高了9.8%和23.6%;生菜和叶用甘薯产量也比蔬菜单作和灵芝(减半量)+蔬菜间作方式有不同程度提高。【结论】合理的菌蔬间作可提高蔬菜和食用菌的产量,达到增产增效和CO2减排的目的,其中以灵芝-蔬菜间作模式效果较好。
关键词:设施栽培;菌蔬间作;CO2浓度;碳素转化
中图分类号:S 626.5文献标识码:A文章编号:1008-0384(2019)03-293-05
Abstract: 【Objective】Effects of fungi-vegetable intercropping on crop yield and environmental CO2 were studied. 【Method】 By intercropping Ganoderma lucidum and vegetables in varied ratios,the plant growth,carbon transformation and CO2 emission were monitored in a confined chamber. 【Result】 The daily CO2 emission of vegetable cultivation was relatively constant. But the intercropping induced significant variations. It was heightened at night and declined in daytime as carbon was discharged as CO2 from G. lucidum (accounting for 51.62% to 52.46% of total carbon emission). The fungal yield under the total- and half-G.lucidum intercropping increased by 9.8% and 23.6%,respectively. The intercropping raised the yield of lettuce or leaf sweet potato to different extends. 【Conclusion】By cultivating G. lucidum along with vegetables,crop yields benefitted,and at the same time,CO2 emission from the cultivation was reduced.
Key words:greenhouse cultivation; fugus-vegetable intercropping; CO2 emission; carbon conversion
0 引言
【研究意義】减少温室气体的排放是减缓全球气候变暖的一项措施,但对溢出的温室气体的利用更是应重点考虑的问题[1]。在温室蔬菜栽培过程中,由于处于相对密闭的条件缺乏大气的交流,蔬菜光合作用消耗的CO2未能及时补充,从而影响产量和品质。因此,把食用菌栽培产生的CO2引入蔬菜温室,可实现光热资源共享、CO2效应互补,能增加蔬菜的生长速度,缩短其生长周期,提高温室的经济效益[2]。【前人研究进展】菌蔬栽培主要有两种模式,即间套型和轮作。间套种植过程中,蔬菜通常选择攀缘搭架的种类,如西红柿、黄瓜等,以便为菌类形成遮阴环境;而菌类应选择较耐高温的种类,如草菇、木耳等[3-5]。已有研究表明,菌蔬间套种的经济效益比单种蔬菜平均提高50%以上,而且蔬菜的产量也提高10%以上[6]。菇蔬间作虽然最大限度地利用了有效空间和光热资源,但在技术层面还存在一些问题。比如食用菌和蔬菜的光照要求差异大;湿度要求也有矛盾,食用菌在生长过程中,特别是出菇阶段,需要较高湿度,而蔬菜一般是尽量减少湿度以减轻蔬菜病害的发生;以及温度差异也较大,仍有诸多技术环节有待改进。【拟解决的关键问题】菌蔬间作条件下温室内CO2变化,以及蔬菜与食用菌之间CO2互补效应的研究还属空白。食用菌与蔬菜的数量配比也直接影响CO2浓度变化和互作效应。【本研究切入点】本研究利用密闭型温室研究不同灵芝-蔬菜(配比)间作下CO2浓度的变化规律,以及对灵芝培养料中碳素转化和损失的影响,旨在为设施菌蔬间作技术研究与应用提供科学依据。
1 材料与方法
1.1 试验地点
试验地点位于福州埔垱试验场内,利用PVC管搭置蔬菜栽培架,支架下面用于灵芝的栽培,温室同时安装水肥自动控制系统和温湿度、光照和CO2传感器用于数据的自动采集。
1.2 试验处理
试验设置4个处理,处理I为温室内灵芝单作,处理II为温室内蔬菜单作,处理Ⅲ为温室内灵芝+蔬菜间作,处理IV为温室内灵芝(减半量)+蔬菜间作。每个玻璃温室面积30 m2,蔬菜栽培面积18 m2,每个处理重复3次。试验选取灵芝品种为紫芝,室内温度保持在17~20℃,空气湿度控制在80%~90%,每天通风2次,每次40 min。4月8日栽种生菜苗,4月13日放置灵芝菌棒;5月18日收获生菜。5月19日栽种叶用甘薯苗,7月25日收灵芝,8月12日收获叶用甘薯。
1.3 测定指标及方法
灵芝和蔬菜产量的测定采取全部收获直接称重法。温室内CO2浓度的测定利用CO2传感器在线监测记录。试验前后每个试验处理分别随机选取灵芝菌袋5袋,称重,然后于65℃下烘干至恒重后再称重。采取四分法收集培养料样品用于有机碳含量的测定。有机碳含量测定采取重铬酸钾外加热法[7]。
2 结果与分析
2.1 灵芝和蔬菜产量
2.1.1 灵芝的产量
灵芝总产量以温室内灵芝+蔬菜间作方式最高,为25.21 kg,比温室内灵芝单作方式提高了9.8%。灵芝(减半量)+蔬菜间作方式产量最低,仅有15.24 kg。图1显示,在灵芝单袋平均产量中,灵芝+蔬菜间作方式中每袋均产量最高,为63.02 g,分别比灵芝单作和灵芝(减半量)+蔬菜间作方式提高了9.8%和23.6%;灵芝(减半量)+蔬菜间作方式中单袋均产量最低,为50.98 g。
2.1.2 蔬菜的产量
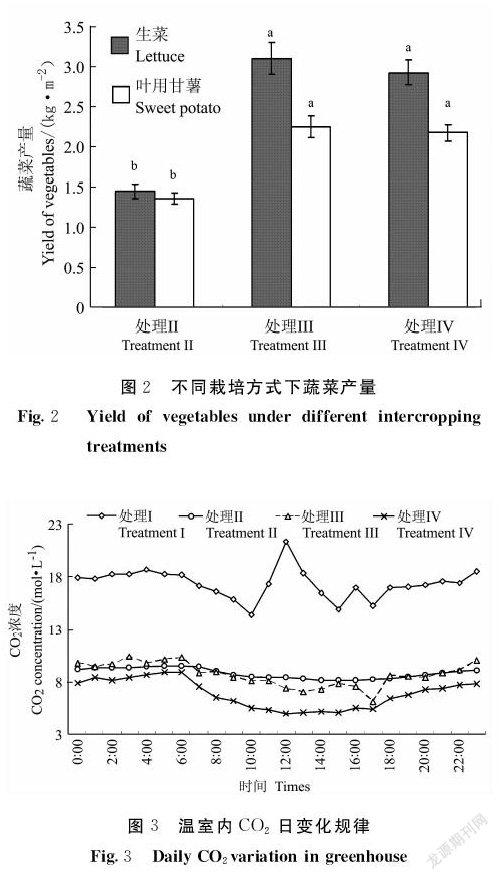
图2显示,生菜的产量在灵芝+蔬菜间作方式中最高,为3.1 kg·m-2,而在灵芝(减半量)+蔬菜间作方式中为2.93 kg·m-2,这两种栽培方式分别是蔬菜单作方式的2.1和2.0倍。叶用甘薯的产量情况与生菜相似,灵芝+蔬菜间作方式最高,为2.25 kg·m-2,而在灵芝(减半量)+蔬菜间作方式中为2.18 kg·m-2,这两种栽培方式分别是蔬菜单作方式的1.7和1.6倍。
2.2 温室内CO2浓度变化规律
2.2.1 温室内CO2浓度日变化规律
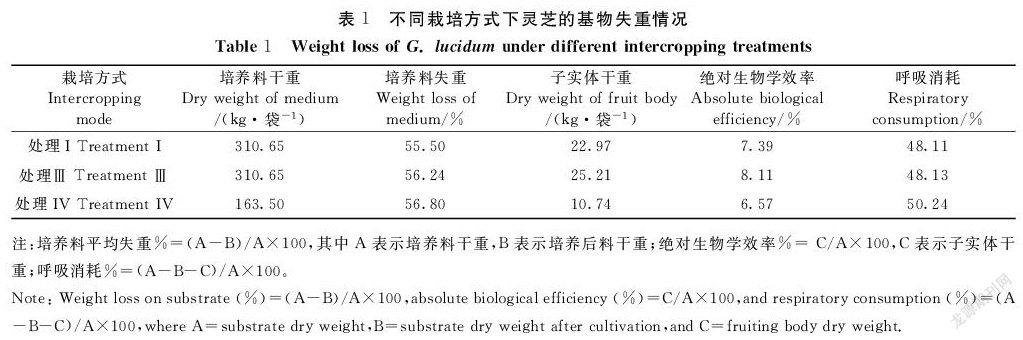
因不同蔬菜的光合效率存在一定差异,本研究仅选取叶用甘薯生长旺盛期间(7月份),计算每日同一时刻温室内CO2浓度的平均值来分析温室内CO2浓度的变化规律。图3显示,温室内灵芝单作栽培方式CO2浓度在中午时间段达到最大值,超过20.7 mol·L-1;温室内蔬菜单作栽培方式,CO2浓度波动较为平缓,在9.2 mol·L-1左右;温室内灵芝+蔬菜间作栽培方式与蔬菜单作比较,CO2浓度在夜间更高,在白天更低;温室内灵芝(减半量)+蔬菜间作栽培方式与蔬菜单作比较,CO2浓度也是在夜间更高,在白天更低,但比温室内灵芝+蔬菜间作栽培方式更显著。
2.2.2 温室内CO2浓度月变化规律
叶用甘薯生长旺盛期间(7月份)温室内平均CO2浓度以灵芝单作方式最高,为16.4 mol·L-1(图4);蔬菜单作方式的室内CO2浓度比灵芝+蔬菜间作的高5.76%,但两处理间的差异不显著(P>0.05)。灵芝(减半量)+蔬菜间作模式CO2浓度平均比蔬菜单作模式低6.16%,但两者间的差异不显著(P>0.05)。
2.3 灵芝的干物质转化
2.3.1 灵芝的基物失重
灵芝在栽培过程中,培养基重量不断降低,干物质量显著减少。表1显示,灵芝在不同栽培方式下对基质的分解能力略有不同,灵芝单作方式的基物失重率最低,为55.50%,其中有7.39%转化为子实体生物量;而灵芝(减半量)+蔬菜间作方式的基物失重率最高,为56.80%,绝对生物学效率最低,仅有6.37%转化为子实体生物量,且呼吸消耗是不同栽培方式中最高的。灵芝+蔬菜间作方式的基物失重率为56.24%,绝对生物学效率最高,有8.11%转化为子实体生物量。
2.3.2 灵芝的碳素转化
表2显示,灵芝在不同栽培方式中的碳素均大幅度降低,其中灵芝+蔬菜间作方式的碳素减少量为90.29 kg,41.28%的碳残留在菌渣中,51.66%的碳以呼吸的形式逃逸到大气中,有7.06%的碳素转移到子实体中,是不同栽培方式中最高的。灵芝单作方式的碳素减少量为89.45 kg,41.83%的碳残留在菌渣中,51.62%的碳以呼吸的形式逃逸到大气中,仅有6.55%的碳素转移到子实体中。灵芝(减半量)+蔬菜间作方式的碳素减少量为47.37 kg,41.47%的碳残留在菌渣中,52.46%的碳以呼吸的形式逃逸到大氣中,仅有6.07%的碳素转移到子实体中,是不同栽培方式中最低的。
3 讨论与结论
食用菌栽培过程中,培养基重量随栽培时间的延长而逐渐下降,这是由于食用菌降解的有机物质除了供给自身需要合成碳水化合物外,还会通过菌体的呼吸过程以CO2和H2O的形式排放到环境中[8]。已有研究表明,在棉籽壳培养基和麦草培养基上栽培巴西蘑菇,其培养基失重分别为40.58%和38.24%,其中,呼吸消耗分别为35.33%和33.83%[9];香菇栽培过程中,呼吸消耗也占培养基失重的大部分[10]。本研究结果也表明,灵芝栽培过程中培养料中51.62%~52.46%的碳素以呼吸消耗的形式排放,41.28%~41.83%残留在菌渣中,仅有6.07%~7.06%的碳素转移到子实体中。因此,在应对全球气候变化的背景下,研究食用菌生产过程中温室气体的排放量和潜力,寻求农业生产过程的减排与控制技术,对我国食用菌产业的持续发展和节能减排具有重要意义。
光合作用是作物产量形成的基础,蔬菜干物质的90%~95%来自光合作用,光合作用的主要原料是CO2。空气中的CO2浓度通常只有300 μL·L-1左右,不能满足作物的需要[11]。特别是在封闭的保护地,因大棚内外空气交换少,常造成CO2缺乏,影响蔬菜的正常生长。因此,将食用菌排放的CO2引入到蔬菜大棚内,提高蔬菜周围环境中CO2的浓度,可能是提高蔬菜光合作用效率和增加产量的一个重要途径。在温室内,生菜、叶用甘薯和灵芝间作,提高了蔬菜产量,达到了增产增效的目的。研究结果发现,本试验条件下蔬菜单作、灵芝+蔬菜间作、灵芝(减半量)+蔬菜间作模式温室内CO2浓度没有显著性差异。灵芝单作条件下温室内CO2浓度处于较高的水平,且显著高于蔬菜单作、灵芝+蔬菜间作、灵芝(减半量)+蔬菜间作模式,说明菌蔬间作下食用菌生长发育过程呼吸排放的CO2,有利于增强蔬菜的光合作用及有机物质的积累[12],这与灵芝+蔬菜间作方式的生菜和叶用甘薯产量最高的结果相一致。此外,温室内菌蔬间作的菌蔬配比情况会影响食用菌产量;适量菌蔬配比能提高食用菌产量,而过量的菌蔬配比会降低食用菌产量。最大灵芝+蔬菜间作方式的灵芝产量最高,而灵芝(减半量)+蔬菜方式的灵芝产量低于灵芝单作。灵芝属好气性真菌,CO2浓度是控制其子实体形成和发育的关键环境因素之一。已有研究认为,大多数食用菌子实体生长阶段要求CO2浓度小于40 μmol·L-1,否则就会对子实体产生毒害作用[13]。菌蔬间作栽培下,因为蔬菜光合作用引起温室内CO2浓度的变化,继而影响灵芝的生长对碳素的转化利用[14]。本研究结果表明,灵芝+蔬菜间作模式灵芝的产量比灵芝单作提高了9.8%。灵芝(减半量)+蔬菜方式中灵芝的呼吸消耗率最高,同时培养料中52.46%的碳素以CO2形式进入大气,41.47%的碳素留在菌渣中,可见在这种方式下灵芝不能有效地将培养料的干物质充分利用,并转化为子实体生物量。另一方面,灵芝+蔬菜方式中虽然呼吸消耗率高于灵芝单作方式,但对培养料的利用效率达到最高,使得绝对生物学效率是这几种方式中最高,因而灵芝+蔬菜方式产量最高。
参考文献:
[1]章永松, 柴如山, 付丽丽, 等. 中国主要农业源温室气体排放及减排对策[J]. 浙江大学学报(农业与生命科学版), 2012, 38(1):97-107.
ZHANG Y S, CHAI R S, FU L L, et al. Greenhouse gas emissions from major agricultural activities in China and corresponding mitigation strategies[J]. Journal of Zhejiang University(Agric & Life Sci), 2012, 38(1): 97-107.(in Chinese)
[2]高兵, 宋立晓, 曾爱松, 等. 设施条件下瓜菇立体栽培技术[J]. 上海蔬菜, 2014 (6):92-93.
GAO B, SONG L X, ZENG A S, et al. Three-dimensional cultivation technique of melon and mushroom under facility conditions[J]. Shanghai Vegetables, 2014 (6):92-93.(in Chinese)
[3]劉正鲁,刘敏德,姚永康.荷兰温室菌菜间作对黄瓜和榆黄菇生长及产量的影响[J].江苏农业科学,2010 (1):162-163.
LIU Z L,LIU M D,YQO Y K. Effects of intercroping on growth and yeld of Pleurotus Citrinopileatus and cucumber under greenhouse[J]. Jiangsu Agricultural Sciences,2010 (1):162-163.(in Chinese)
[4]李友丽, 王兰清, 刘宇. 果类蔬菜冠层下微环境及其对秀珍菇生长的影响[J]. 蔬菜, 2014 (4):68-71.
LI L Y, WANG L Q, LIU Y. Microenvironment under the canopy of fruit vegetables and its effect on the growth of Pleurotus ostreatus[J]. Vegetables, 2014 (4):68-71.(in Chinese)
[5]杜爱玲, 王进涛. 日光温室菇菜间套作栽培模式优化组合[J]. 北京农业, 2004 (8):2-3.
DU A L, WANG J T. Optimized combination of mushroom and vegetables intercropping in greenhouse[J]. Beijing Agriculture, 2004 (8):2-3.(in Chinese)
[6]王礼门, 花春英,孙玉东,等. 棚室黄瓜套种平菇综合效益研究[J]. 中国食用菌, 2001, 20(2):20-22.
WANG L M, HUA C Y,SUN Y D, et al. Study on comprehensive benefits of cucumber and Pleurotus ostreatus interplanting [J]. Edible Fungi of China, 2001, 20(2):20-22.(in Chinese)
[7]李波,叶菁,刘岑薇,等.生物炭添加对猪粪堆肥过程碳素转化与损失的影响[J].环境科学学报, 2017, 37(9): 311-3518.
LI B, YE J, LIU C W, et al. Effects of biochar addition on carbon transformation during composting of pig manure[J]. Acta Scientiae Circumstantiae, 2017, 37(9): 3511-3518.(in Chinese)
[8]王义祥, 叶菁, 肖生美, 等. 铺料厚度对双孢蘑菇栽培过程酶活性和CO2排放的影响[J]. 农业环境科学学报, 2015, 34(12):2418-2425.
WANG Y X, YE J, XIAO S M, et al. Effects of Substrate Thickness on CO2 Emissions and Enzyme Activities of Substrates During Agaricus bisporus Cultivation[J]. Journal of Agro-Environment Science, 2015, 34(12): 2418-2425.(in Chinese)
[9]倪新江, 梁丽琨, 丁立孝, 等. 巴西蘑菇对木质纤维素的降解与转化[J]. 菌物学报, 2001, 20(4):526-530.
NI X J, LIANG L K, DING L X, et al. Degradation and transformation of lignocellulose by Agaricus blazei[J]. Mycosystema, 2001, 20(4):526-530.(in Chinese)
[10]卢翠香, 江枝和, 翁伯琦. 食用菌栽培过程中CO2排放测定方法研究进展[J]. 福建农业科技, 2008 (2):88-90.
LU C X, JIANG Z H, WENG B Q. Advances in determination methods of CO2 emissions during cultivation of edible fungi[J]. Fujian Agricultural Science and Technology, 2008 (2):88-90.(in Chinese)
[11]KAUSHIK D, BARUAH K K. A comparison of growth and photosynthetic characteristics of two improved rice cultivars on methane emission from rainfed agroecosystem of northeast India[J]. Agriculture Ecosystems & Environment, 2008, 124(1):105-113.
[12]于國华, 同辉民, 张国树,等. CO2浓度对黄瓜叶片光合速率、RubisCO活性及呼吸速率的影响[J]. 华北农学报, 1997, 12(4):101-106.
YU G H, TONG H M, ZHANG G S, et al. Effect of CO2 concentrations on photosynthetic rate, RubisCO activity and respiratory rate of the cucumber leaves[J]. Acta Agriculturae Boreali Sinica, 1997, 12(4):101-106.(in Chinese)
[13]郭家选, 沈元月, 钟阳和. CO2浓度对金针菇生长发育的影响[J]. 中国生态农业学报, 2002, 10(1):21-23.
GUO J X, SHEN Y Y, ZHONG Y H. Effect of CO2 concentration on the growth and development of Flammulina velutipes[J]. Chinese Journal of Eco-Agriculture, 2002, 10(1):21-23.(in Chinese)
[14]吴惧, 徐锦堂. 二氧化碳对灵芝生长发育的影响[J]. 中国药学杂志, 1993, 28(1):13-16.
WU J, XU J T. Effect of carbon dioxide on the growth of Ganoderma lucidum[J]. Chinese Pharmaceutical Journal, 1993, 28(1):13-16.(in Chinese)
(责任编辑:翁志辉)
