乳清蛋白ACE抑制肽酶解工艺纯化研究
2019-09-10刘静

[摘要]为充分利用奶酪制作的副产物——乳清蛋白增加乳制品附加值,本研究以浓缩乳清蛋白为试验原料,采用酶解技术制备乳清蛋白ACE(Angiotensin Converting Enzyme)抑制肽。在酶的筛选试验中,以酶解产物ACE抑制率和肽得率为指标选出最佳水解用酶为Alcalase 2.4L碱性蛋白酶,然后采用单因素试验得到了此酶的最佳水解条件并对水解物的稳定性进行了试验。研究结果表明,最适酶解条件为底物浓度7.5%、加酶量6 000U/g、pH值8.5、温度55℃,得到酶解产物ACE抑制率为69.38%、IC50为0.80mg/mL,经模拟肠胃消化处理后,肽的活性并无显著变化,稳定性较好。经葡聚糖凝胶纯化后,抑制率提升至75.33%,其IC50为0.74mg/mL。
[关键词]乳清蛋白;ACE抑制肽;酶解;纯化
中图分类号:Q512+.1 文献标识码:A DOI:10.16465/j.gste.cn431252ts.20190517
牛奶中含有丰富的蛋白质资源,已有研究表明,可将这些蛋白质水解为活性肽,而且其中一些肽段已被证明具有免疫调节、抗菌等活性功能,大大提高了牛奶的利用价值[1-5]。本研究以生产干酪副产物——乳清蛋白为原料,制备ACE抑制肽,并对制备工艺进行优化,采用超滤分级、葡聚糖凝胶层析对水解产物进行纯化,制备出高活性乳清蛋白ACE抑制肽。
1 材料与设备
1.1 原料与试剂
主要原料与试剂见表1,其余试剂为分析纯。
1.2 仪器与设备
主要设备与仪器见表2。
2 试验方法
2.1 ACE抑制活性的测定
首先制备0.1 mol/L的硼酸盐缓冲液,pH值为8.3,将HHL溶于其中,配置浓度为5 mmol/L。取100 μL配置好的HHL溶液,加入25 μL的ACE抑制剂,用电动混匀器充分混匀,放置在37 ℃水浴锅中水浴5 min后,加入l5 μL的ACE,混匀,再放置37 ℃下温育40 min。结束后加入120 μL、1 mol/L的HCl终止反应。再加入1.2 mL乙酸乙酯,用混匀器混合20 s,用来萃取生成HA(马尿酸)。然后离心10 min,转速为1 200 r/min,静止后从中吸取0.9 mL上层溶液,滴入试管中,放入100 ℃的烘箱烘干,烘干后取出试管,加入3 mL去离子水溶解,混匀器混匀后于228 nm下测定吸光值[6-7]。抑制率计算式:
ACE抑制率=[(对照组-样品组)÷(对照组-空白组)]×100% (1)
抑制率达到50%时的抑制剂浓度为半抑制浓度,记为IC50。
2.2 肽得率的测定
肽得率以氮溶指数(TCA-NSI)表示,将等体积的水解液与15%三氯乙酸(TCA)混合均匀,静置20 min后离心15 min,转速为1200 r/min,采用微量凯氏定氮法测定上清液中蛋白质的含量[8]。肽得率计算公式:
肽得率=(N÷N0)×100% (2)
式中:N为经TCA处理后上清液中的总氮;N0为未经TCA处理的水解液中的总氮。
2.3 乳清蛋白ACE抑制肽水解用酶的筛选
首先要对蛋白酶进行筛选,根据龚琴等[9-10]的研究,筛选最适条件下的胃蛋白酶、风味蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶,加酶量为5 000 U/g,底物浓度为5%。以ACE抑制率和肽得率为指标,经比较分析得出最适宜水解乳清蛋白的蛋白酶。
称取一定量的乳清蛋白,加入去离子水配置成所需浓度,沸水预煮10 min使蛋白质中的酶失活,再降温至酶解所需温度,调节后加入蛋白酶。在酶解过程中,要用碱式滴定管不断滴入NaOH使pH值维持在最适范围之内,当pH值不再变化时,水解完毕。将水解液在沸水浴中不断搅拌15~20 min,使酶失活,然后以1 200 r/min离心分离15 min,取上清液经冷冻干燥制得ACE抑制肽。
2.4 酶解工艺单因素试验
酶解工艺单因素试验水平梯度见表3。
3 单因素试验结果
3.1 最佳水解用酶的确定
不同蛋白酶对ACE抑制率影响见图1。据图1可知,碱性蛋白酶和木瓜蛋白酶水解后的ACE抑制率效果较好,其中Alcalase 2.4L碱性蛋白酶在水解2 h后抑制率最高为53%,木瓜蛋白酶最大ACE抑制率也可达到48%,但水解时间较长,为4h,效率较低。在达到最大ACE抑制率后,随着水解时间延长,ACE抑制活性均有所降低,这可能是由于产生了对具有ACE活性的基作用有影响的水解产物,从而导致ACE抑制率下降。
不同蛋白酶对肽得率的影响见图2。据图2可知,随着水解时间增加,5種蛋白酶的肽得率均呈不断上升趋势,最后趋于平稳,其中碱性蛋白酶肽得率最大能达到42%。当水解时间足够长时,水解程度不再增加。根据ACE抑制率和肽得率两项指标可以得出碱性蛋白酶为最佳水解用酶。以下试验用酶均为Alcalase 2.4L碱性蛋白酶。
3.2 pH值对乳清蛋白肽ACE抑制率和肽得率的影响
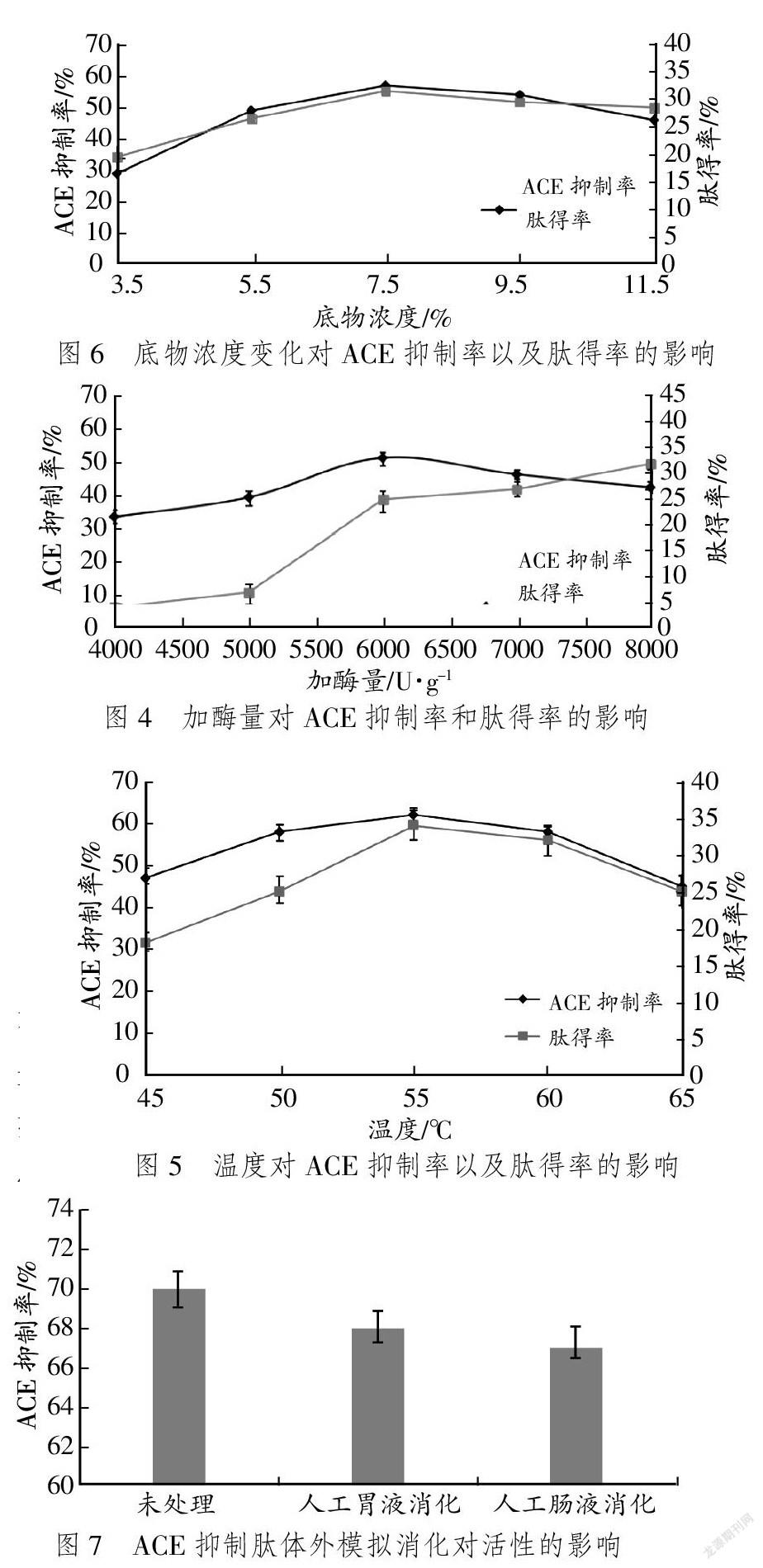
不同pH值对乳清蛋白肽ACE抑制率和肽得率的影响见图3。
据图3可知,随着pH值的升高,肽得率和ACE抑制率有明显增大,当pH值达到8.5时,肽得率达到最大,为34%,此时ACE抑制率也达到最大,为65%。当水解碱性环境继续增强,肽得率和ACE抑制率呈下降趋势。由此得出,Alcalase 2.4L碱性蛋白酶最适水解pH值为8.5。
3.3 加酶量对乳清蛋白肽ACE抑制率和肽得率的影响
不同加酶量对乳清蛋白肽ACE抑制率和肽得率的影响见图4。据图4可知,反应初期,肽得率和抑制率均随着加酶量的增加而增大,反应的速度也逐渐增快,但加酶过多会使水解程度过大,这可能是破坏了肽链的活性基团,造成活性下降。因此,加酶量6 000 U/g较为合适。
3.4 温度对ACE抑制率和肽得率的影响
ACE抑制率和肽得率受试验温度的影响程度见图5。据图5可知,随着温度升高,55 ℃之前,两项指标逐渐上升;升高到55 ℃以上后,指标均下降,且相对同步。经过分析,可能的原因是温度促使蛋白质结构变化,相关官能团发生反应,酶解效率不断受到影响,导致活性下降。由此可得出,55 ℃可视为最佳试验温度。
3.5 底物浓度对ACE抑制率和肽得率的影响
ACE抑制率和肽得率受底物浓度的影响程度见图6。据图6可知,底物浓度升高能够促使反应更好进行,浓度达到一定程度后,反应体系的流动性大幅下降,蛋白质分子运动速率变慢,底物与酶的接触不够活跃,呈现出反应被抑制趋势。由此可得出,7.5%为最佳底物浓度。
由5项单因素试验的结果可以看出,制备乳清蛋白ACE抑制肽最适合的水解酶是碱性蛋白酶,水解条件可确定为酶添加量6 000 U/g、pH值8.5、温度55 ℃、底物浓度7.5%。以上条件下,ACE抑制率为69.38%,IC50为0.80 mg/mL。
4 ACE抑制肽体外模拟消化稳定性试验
4.1 试验方法
4.1.1 模拟人体胃液试验
配置胃液:取稀盐酸1.6 mL,分别加80 mL水、胃蛋白酶1 g,混合均匀后,用水稀释到100 mL。
取固体肽产品40 mg,取12 mL胃液进行溶解,在37 ℃条件下水浴3.5 h,沸水灭酶15 min,在10 000 r/min条件下,离心分离15 min,取上清液进行ACE抑制活性检测。
4.1.2 模拟人体肠液试验
配置肠液:取磷酸二氢钾0.68 g,加100 mL水溶解,取0.1 mol/L氢氧化钠溶液调节pH值至6.8,加入胰蛋白酶10 g,混合均匀后,稀释至1 000 mL。
重复模拟人体胃液试验。
4.2 ACE抑制肽体外模拟消化对活性的影响
ACE抑制肽体外模拟消化对活性的影响见图7。
据图7可知,ACE抑制肽由胃、肠两种消化液分别处理后,抑制活性下降不大[11-14]。
5 ACE抑制肽的纯化
选取分离分子量为5 000 U、3 000 U和1 000 U的超滤膜开展分离试验,可以获得4种不同分子量的成分,分别是分子量大于5 000 U的肽I、分子量在3 000~5 000 U的肽Ⅱ、分子量在1 000~3 000 U的肽Ⅲ、分子量小于1 000 U的肽Ⅳ。逐一测定4种不同分子量区间肽的活性。
5.1 分子量不同的肽段与活性的关系
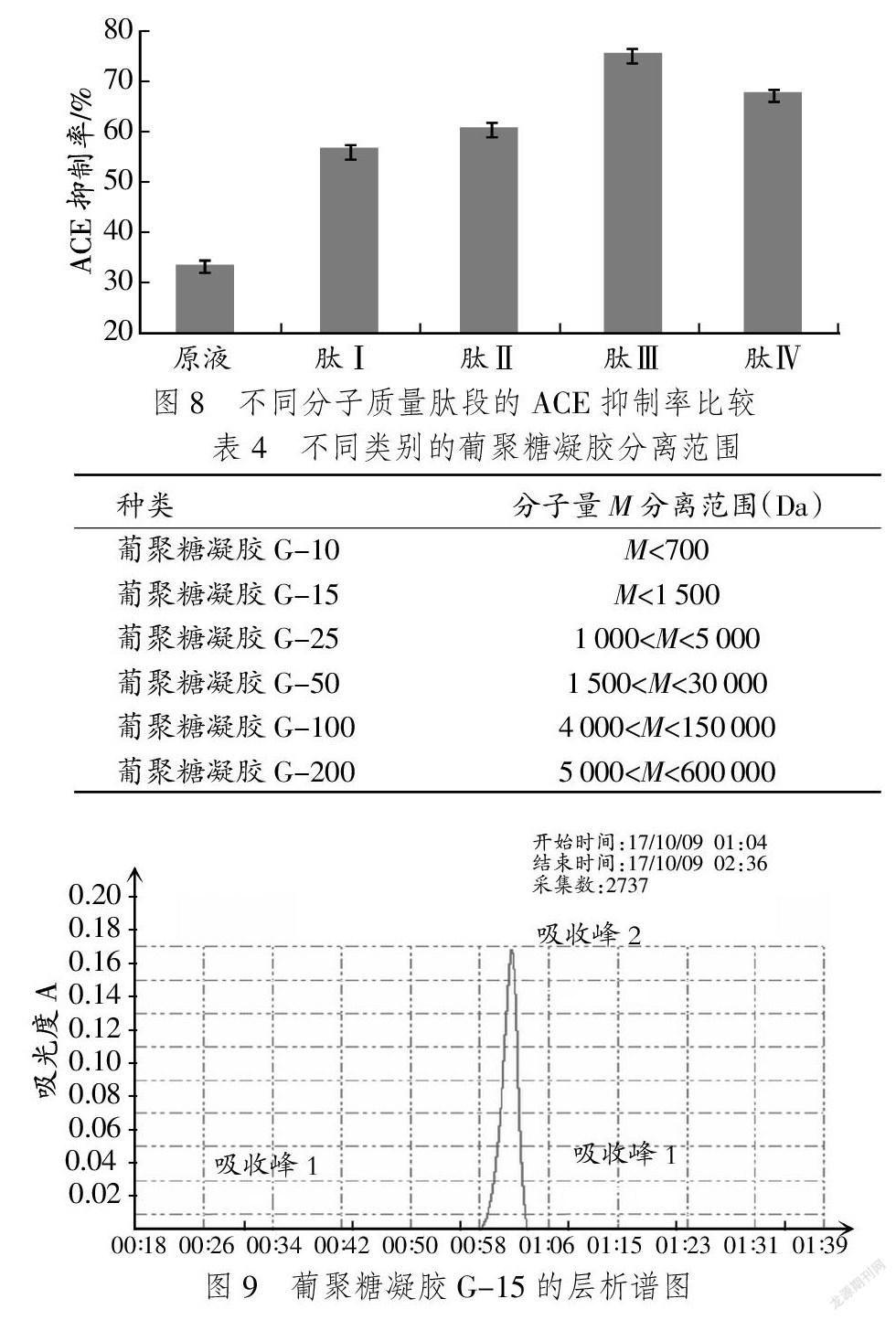
不同分子量肽段与活性的相关性见图8。
据图8可知,分子量在1 000~3 000 U的肽段是抑制最明显的组分,能达到75%,IC50为0.85 mg/mL。可以选择此组分进行下一步试验。
5.2 葡聚糖凝胶层析法分离ACE抑制肽
采用葡聚糖凝胶层析法分离ACE抑制肽,不同类别的葡聚糖凝胶分离范围见表4。
由表4可看出,纯化1 000~3 000 U的组分,选择葡聚糖凝胶G-15最为合适。层析分离结果见图9,图中的3个吸收峰,其中58~60 min的吸收峰分离效果最好。多次重复试验后,将3个吸收峰对应组分收集,冷冻干燥后测定活性,得出结论为峰2(81.3%)>峰3(52.6%)>峰1(43.6%),目标成分在峰2对应的肽段中,测定IC50为0.74 mg/mL。
6 結 论
通过单因素试验优化酶解工艺,确定了乳清蛋白ACE抑制肽的最佳用酶是碱性蛋白酶,对应最适水解条件:加酶量6 000 U/g、pH值为8.5、温度55 ℃、底物浓度7.5%,得到的多肽抑制率为69.38%,IC50为0.80 mg/mL,模拟体外消化得到乳清蛋白ACE抑制肽能够保持消化稳定性,经葡聚糖凝胶纯化后,抑制率提升至75.33%,其IC50为0.74 mg/mL。
参考文献
[1]GOBBETTI M,STEPANIAK L,ANGELIS M,et al.Latent bioactive peptides in milk proteins:proteolytic activation and significance in dairy processing[J].Critical Reviews in Food Science and Nutrition,2002(42):223-239.
[2]MEISEL H,BOCKELMANN W.Bioactive peptides encrypted in milk proteins:proteolytic activation and thropho-functional properties[J].Antonie Van Leeuwenhoek,1999(76):207-215.
[3]胡子豪,钟立人.如何提高食源性ACE抑制肽活性的探讨[J].食品与机械,2005(5):74-76+87.
[4]沈亮.食品源性降血压活性肽的研究进展[J].食品工业科技,2013(14):390-394.
[5]刘海军,乐超银,邵伟,等.生物活性肽研究进展[J].中国酿造,2010(5):5-8.
[6]张艳萍.贻贝蛋白中ACE抑制肽的制备及其构效关系研究[D].杭州:浙江工商大学,2011.
[7]NAKAMURA Y,YAMAMOTO N,SAKAI K,et al. Purification and characterization of angiotensin-converting enzyme inhibitors from sour milk[J].Dairy Science,1995(4):777-783.
[8]李理,张静.蛋白水解产物中多肽得率的测定方法研究[J].现代食品科技,2010(8):884-888.
[9]龚琴.绿豆粉丝废水生物法制备降血压肽的研究[D].武汉:湖北工业大学,2011.
[10]许均华.花生分离蛋白肽解制备工艺优化及其功能特性研究[D].长沙:中南大学,2012.
[11]孔令明,劳斐,李芳,等.响应面法优化杏仁ACE抑制肽的酶解工艺研究[J].中国食品添加剂,2013(1):130-136.
[12]吴梧桐.生物制药工艺学[M].2版.北京:中国医药科技出版社,2006.
[13]梁国香,韩忠杰,孙庆杰.生物酶法制取黑豆速食粉的研究[J].粮食科技与经济,2013(2):55-57.
[14]陈洁,王培慧,李雪琴,等.反应条件对面粉中多酚氧化酶活性测定的影响[J].粮食科技与经济,2012(3):25-26+40.
收稿日期:2019-04-16
作者简介:刘静,女,本科,助理工程师,研究方向为发酵技术工艺优化、新产品研发、食品科学及成果推广。
