陆川猪IGFBP5基因克隆及其差异表达分析
2019-09-10焦迪潘鹏丞谢婉张其伟曾令湖孙甜甜陈宝剑关志惠谢炳坤
焦迪 潘鹏丞 谢 婉 张其伟 曾令湖 孙甜甜 陈宝剑 关志惠 谢炳坤



摘要:【目的】克隆陸川猪胰岛素生长因子结合蛋白5(IGFBP5)基因,并明确其在不同猪种中的表达情况,为今后揭示IGFBP5基因在陆川猪肌肉发育中的作用机理提供理论依据。【方法】通过TRIzol法提取陆川猪背最长肌总RNA,反转录合成cDNA后进行PCR扩增,将正确的测序结果采用在线生物信息软件进行生物信息学分析,并以实时荧光定量PCR检测分析IGFBP5基因在陆川猪和杜洛克猪背最长肌中的表达差异。【结果】陆川猪IGFBP5基因编码区(CDS)序列全长816 bp,编码271个氨基酸,与NCBI上已公布的野猪IGFBP5基因(NM_214099.1)CDS序列相比,存在3处碱基差异,其核苷酸同源性为99.6%。陆川猪IGFBP5氨基酸序列与NCBI上已公布的野猪(NM_214099.1)、牛(NM_001105327.2)、水牛(NM_001290940.1)、马(NM_001308603.2)、人类(NM_000599.3)、猕猴(NM_001284032.1)、小鼠(NM_010518.2)和大鼠(NM_012817.1)IGFBP5氨基酸序列同源性分别为98.9%、98.2%、98.9%、97.4%、96.7%、97.4%、95.2%和95.2%;基于IGFBP5氨基酸序列同源性构建的系统发育进化树也显示,陆川猪与野猪的遗传距离最近。陆川猪IGFBP5蛋白二级结构由α-螺旋、延伸链、β-转角和无规则卷曲组成,其中无规则卷曲占比最高,为65.68%;陆川猪IGFBP5蛋白不存在跨膜结构,在第1~20位氨基酸残基存在1个信号肽序列;蛋白修饰结构预测结果表明,陆川猪IGFBP5蛋白存在2个O糖基化位点、2个N糖基化位点和多个潜在磷酸化位点,包含IB保守结构域和Thyroglobulin-1保守结构域。IGFBP5基因在杜洛克猪背最长肌中的相对表达量极显著高于其在陆川猪背最长肌中的相对表达量(P<0.01)。【结论】IGFBP5基因保守性较强,其在不同猪种间的差异表达可能是导致猪肉瘦肉率差异的主要原因,可作为陆川猪胴体重和瘦肉率等生长性状的遗传标记予以开发利用。
关键词: 陆川猪;IGFBP5基因;背最长肌;生物信息学;生长发育;差异表达
中图分类号: S828.89 文献标志码: A 文章编号:2095-1191(2019)06-1347-09
Abstract:【Objective】In this study, the insulin growth factor-binding protein 5(IGFBP5) gene was cloned and its expressions in different pig breeds were determined,which provided theoretical basis for revealing the mechanism of IGFBP5 gene in the muscle development of Luchuan pig. 【Method】The total RNA of the longissimus dorsi muscle of Luchuan pig was extracted by Trizol method and cDNA was reverse transcribed then amplified by PCR. According to the correct sequencing results, the online bioinformatics software was applied to analyze it bioinformatics, and expression of IGFBP5 gene in the longissimus dorsi of Luchuan pig and Duroc pig was detected by real-time fluorescent quantitative PCR. 【Result】The results showed that the coding region(CDS) of Luchuan pig IGFBP5 gene was full-length 816 bp and encoded 271 amino acids. Compared with the CDS sequence of the published wild pig IGFBP5 gene(NM_214099.1) on NCBI, there were three base differences with nucleotide homology of 99.6%. Homology between the amino acid sequence encoded by the IGFBP5 gene of Luchuan pig and the amino acid sequence encoded by the IGFBP5 gene in wild pig(NM_214099.1), bovineNM_001105327.2),buffalo(NM_001290940.1),horse(NM_001308603.2),human(NM_000599.3),rhesus monkey(NM_001284032.1), mouse(NM_010518.2) and rat(NM_012817.1) published on NCBI were respectively 98.9%, 98.2%, 98.9%, 97.4%, 96.7%, 97.4%, 95.2% and 95.2%. The phylogenetic tree based on the homology of IGFBP5 amino acid sequence also showed that the genetic distance between Luchuan pig and wild pig was the closest. Its secondary structure was composed of alpha-helix, extending strand, beta-turn and random coil, with the highest proportion of random coil being 65.68%. There was no transmembrane structure in Luchuan pig IGFBP5 protein. There was a protein signal peptide in the 1st to the 20th position. The prediction of protein modification structure indicated that there were two O-glycosylation sites, two N-glycosylation sites and multiple potential phosphorylation sites in IGFBP5 protein of Luchuan pig, and also contained the IB conserved domain and Thyroglobulin-1 conserved domain. The expression of IGFBP5 in the longissimus dorsi muscle of Duroc pig was extremely higher than that in the longissimus dorsi muscle of Luchuan pig(P<0.01). 【Conclusion】The IGFBP5 gene is highly conserved, and its differential expression among different pig breeds may be the main cause of the difference in pork lean rate. It can be used as a genetic molecular marker for growth traits such as body weight and lean meat rate of Luchuan pig.
Key words: Luchuan pig; IGFBP5 gene; longissimus dorsi; bioinformatics; growth and development; differential expression
0 引言
【研究意义】陆川猪具有肉嫩味鲜、体型紧凑、遗传力稳定、繁殖力高、抗逆性强等优点(黄雅琼等,2013;焦迪等,2019),属于脂肪型猪。脂肪是影响猪肉品质的一个重要因素,如猪肉品质中的大理石纹、嫩度、多汁性和风味均受肌内脂肪含量影响;而影响肌内脂肪含量的因素较多,包括脂肪细胞数量及脂肪沉积能力等(邓洛娜等,2018)。黄艳娜等(2014a,2014b)研究表明,肌肉生长抑制素基因(MSTN)和脂蛋白酶基因(LPL)均可作为研究陆川猪脂肪沉积的主要候选基因之一;夏琴等(2018)成功克隆获得陆川猪细胞因子信号通路抑制因子3基因(SOCS3),为下一步研究陆川猪脂肪沉积的分子机制奠定了基础;谢婉等(2018)研究证实,陆川猪G-蛋白偶联受体1(GPR1)基因启动子甲基化程度与肌内脂肪沉积存在一定关联。因此,加强陆川猪生长性状相关基因的研究对其开发和利用具有重要意义。【前人研究进展】胰岛素生长因子结合蛋白5(IGFBP5)属于胰岛素样生长因子结合蛋白(IGFBPs)家族成员(吴苏日古嘎,2013),由N端、C端和作为翻译后修饰主要部分的中央区域组成,其中,中央区域是结构变化较多的区域(Kalus et al.,1998),也是IGFBP5具有特殊功能的基础,如蛋白的磷酸化、水解和糖基化均发生在中央区域(毛胜,2009)。作为IGFBPs家族中最保守的成员,IGFBP5可储存胰岛素样生长因子,延长胰岛素样生长因子在循环中的半衰期,进而稳定其血清浓度,且IGFBP5可不依赖胰岛素样生长因子而独立发挥作用(Arai et al.,1994)。IGFBP5参与诸多生物过程如肌肉生长、皮肤损伤修复及癌症发生等,在肌肉、前列腺、骨、乳腺和肾脏等组织中均有表达,尤其在肌肉中高表达(吴苏日古嘎,2013)。Lehnert等(2007)研究发现IGFBP5基因在牛肌肉组织中的表达呈先上升后下降的变化趋势;McGivney等(2010)研究表明,与未训练过的纯血马相比,训练过的纯血马肌肉中IGFBP5基因mRNA表达呈下降趋势;但吴苏日古嘎(2013)研究發现,与未训练过的蒙古马相比,训练过的蒙古马肌肉组织中IGFBP5基因mRNA表达量呈上调趋势;商鹏等(2016)研究表明,IGFBP5与肌肉分化呈显著相关,最早可在大鼠第10 d左右的胚胎肌肉组织中检测到IGFBP5基因表达。此外,有研究表明IGFBP5可增加胶原、纤维连接蛋白的产生,促使纤维母细胞分化为成纤维细胞并转移,加速上皮细胞衰老,诱导上皮间质化,进而激活组织纤维溶解酶原激活物(Pilewski et al.,2005;Yasuoka et al.,2006)。刘怡然(2017)研究发现,IGFBP5基因可能是miRNA-149-5p直接作用的靶基因,过量表达的miRNA-149-5p通过抑制IGFBP5基因表达而参与2型糖尿病的发生;饶大庞等(2018)研究证实,IGFBP5基因是miRNA-149的下游靶基因,即mi-RNA-149抑制膀胱癌侵袭可能是通过抑制IGFBP5和PDGFRA蛋白的表达来实现。【本研究切入点】IGFBP5基因在肌肉中高表达,且与肌肉分化密切相关,但至今鲜见有关陆川猪IGFBP5基因克隆及其调控机理的研究报道。【拟解决的关键问题】从陆川猪背最长肌克隆IGFBP5基因,应用在线生物信息软件进行生物信息学分析,并明确其在不同猪种间的表达情况,为今后揭示IGFBP5基因在陆川猪肌肉发育中的作用机理提供理论依据。
1 材料与方法
1. 1 试验材料
3头10周龄的陆川猪背最长肌和3头10周龄的杜洛克背最长肌样品均从广西畜牧研究所养殖基地采样获得。酵母浸出物和胰蛋白胨购自英国Oxoid公司;TRIzol试剂、反转录试剂盒、Premix Taq DNA聚合酶、pMD18-T载体和定量试剂盒购自TaKaRa公司;胶回收试剂盒购自杭州博日科技有限公司;大肠杆菌Trans 5α感受态细胞购自北京全式金生物技术有限公司;DL5000 DNA Marker购自广州东盛生物科技有限公司;琼脂糖购自法国Biowest公司。
1. 2 引物设计与合成
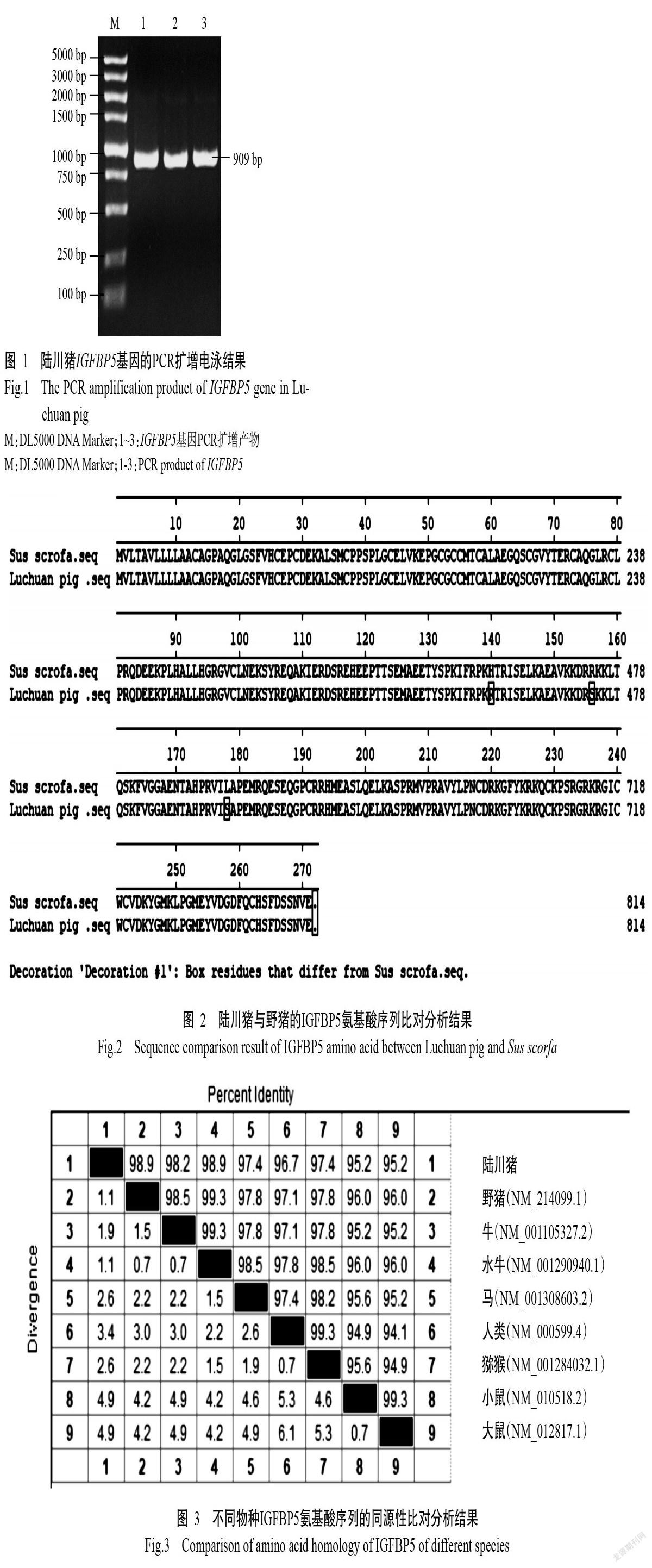
参考NCBI中的野猪IGFBP5基因序列(NM_214099.1),应用Oligo 7.0设计相关引物。克隆引物:IGFBP5-F1(5'-ATGGTGCTCACCGCGGTC-3')和IGFBP5-R1(5'-AAATGAGTGGCGTCTTGGGGTG GA-3'),预期扩增长度909 bp,包含816 bp的编码区(CDS)序列;定量引物:IGFBP5-F2(5'-CAATCTGA ACAACTATTGTGC-3')和IGFBP5-R2(5'-CTATAA CTCTGAGAGGTCT-3'),预期扩增长度208 bp;内参引物:GAPDH-F(5'-CTACGTCCTGAGAGAG-3')和GAPDH-R(5'-CGTGATCGTCCTTCTGCA-3'),预期扩增长度230 bp。所有引物均委托生工生物工程(上海)股份有限公司合成。
1. 3 陆川猪IGFBP5基因克隆
以陆川猪和杜洛克猪背最长肌为样品,采用TRIzol法提取总 RNA。具体操作:剪取约120 mg背最长肌样品置于液氮预冷的研钵中研磨至粉末,将其转移至1.5 mL的EP管中,加入1.0 mL TRIzol后参照说明提取总RNA;以总RNA为模板,按照反转录试剂盒说明进行反转录合成。反转录第一步:gDNA Eraser 1.0 µL,总RNA模板2.0 µL,5×g DNA Eraser Buffer 2.0 µL,RNase free ddH2O 5.0 µL;42 ℃ 2 min,4 ℃保存备用;第二步:取第一步反应液10.0 µL,5×Prime Script Buffer Ⅱ4.0 µL,RNase free ddH2O 4.0 µL,RT Primer Mix 1.0 µL,Prime Script Enzyme MixⅠ1.0 µL;37 ℃ 15 min;85 ℃ 5 s。PCR反应体系10.0 µL:IGFBP5-F1和IGFBP5-R1各0.4 µL,cDNA模板1.0 µL,RNase free ddH2O 3.2 µL,Premix Taq DNA聚合酶5.0 µL。扩增程序:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 80 s,进行34个循坏。取8.0 µL PCR产物用1.5%琼脂糖凝胶进行电泳检测,胶回收产物与pMD18-T载体在16 ℃下连接过夜,然后转化大肠杆菌Trans 5α感受态细胞,取75.0 µL转化产物涂布于含氨苄的LA培养基上,37 ℃培养12 h,挑取单个菌落接种于1.5 mL的LB液体培养基中培养4 h,菌液经PCR验证后,选取阳性菌液基因送至生工生物工程(上海)股份有限公司进行测序。
1. 4 实时荧光定量PCR检测
采用TRIzol法提取10周龄陆川猪和杜洛克猪(各3头)背最长肌总RNA,并反转录合成cDNA。以反转录合成的cDNA为模板,进行实时荧光定量PCR检测。反应体系20.0 µL:SYBR Green Master Mix 10.0 µL,cDNA模板5.0 µL,RNase free ddH2O 4.0 µL,IGFBP5-F2和IGFBP5-R2各0.5 µL。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行37个循环。每个样本3次重复,以GAPDH基因为内参基因对个体间差异进行矫正,并采用2-ΔΔCt法换算IGFBP5基因的相对表达量。
1. 5 陆川猪IGFBP5基因生物信息学分析
采用MegALign分析陆川猪IGFBP5氨基酸序列与其他物种的同源性,并基于IGFBP5氨基酸序列同源性构建系统发育进化树;运用ProtParam对陆川猪IGFBP5蛋白理化性质进行分析,以SOPMA和SWISS-MODEL分别预测陆川猪IGFBP5蛋白二、三级结构,用ProtScale预测陆川猪IGFBP5蛋白亲/疏水性,以MHMM Server预测陆川猪IGFBP5蛋白跨膜结构,利用SignalP分析陆川猪IGFBP5蛋白信号肽;采用NetNGlyc 1.0、NetOGlyc 3.1、NetPhos 3.1 Ser-ver分析陆川猪IGFBP5蛋白N和O糖基化位点、潜在磷酸化位点及对应的蛋白激酶位点;运用NCBI网站的中CDD工具预测陆川猪IGFBP5蛋白保守结构域,并以PSORT预测其亚细胞定位。
2 结果与分析
2. 1 陆川猪IGFBP5基因的克隆
以陆川猪背最长肌cDNA为模板,PCR扩增产物经1.5%琼脂糖凝胶电泳检测,得到一条长约900 bp的特异性条带(图1),与目的基因条带的长度(909 bp)相符。
2. 2 陆川猪IGFBP5基因CDS序列及其生物信息学分析结果
2. 2. 1 陆川猪IGFBP5基因测序分析结果 测序結果显示,克隆获得的陆川猪IGFBP5基因CDS序列长度为816 bp,共编码271个氨基酸,与NCBI上已公布的野猪IGFBP5基因(NM_214099.1)CDS序列相比,共存在3处碱基差异,其核苷酸同源性为99.6%,编码氨基酸同源性为98.9%。3处碱基突变均为错义突变(图2),分别是陆川猪IGFBP5基因419 bp处A突变为G,导致第140位的组氨酸突变为精氨酸(140His→Arg);468 bp处A突变为T,导致第156位的精氨酸突变为丝氨酸(156Arg→Ser);533 bp处T突变为C,导致第178位的亮氨酸突变为丝氨酸(178Leu→Ser)。
经MegALign分析发现,陆川猪IGFBP5氨基酸序列与NCBI上已公布的野猪(NM_214099.1)、牛(NM_001105327.2)、水牛(NM_001290940.1)、马(NM_001308603.2)、人类(NM_000599.4)、猕猴(NM_001284032.1)、小鼠(NM_010518.2)和大鼠(NM_012817.1)IGFBP5氨基酸序列同源性分别为98.9%、98.2%、98.9%、97.4%、96.7%、97.4%、95.2%和95.2%(图3),表明IGFBP5基因在哺乳动物中的保守性较强。基于IGFBP5氨基酸序列同源性构建的系统发育进化树(图4)也显示,陆川猪与野猪的遗传距离最近,与水牛和牛的遗传距离次之,遗传距离最远的是小鼠和大鼠。
2. 2. 2 陆川猪IGFBP5蛋白理化性质预测结果
IGFBP5蛋白分子量为30260.85 Da,理论等电点(pI)为8.56,N端残基为甲硫氨酸(Met),氨基酸组成中谷氨酸(Glu)含量最高,占10.0%,精氨酸(Arg)占8.1%,亮氨酸(Leu)占8.1%,赖氨酸(Lys)占7.7%;带负电荷的氨基酸[天冬氨酸(Asp)+Glu]36个,带正电荷的氨基酸(Arg+Lys)43个。IGFBP5蛋白在体外的半衰期为30 h,不稳定系数为54.76,其理化性质不稳定。
2. 2. 3 陆川猪IGFBP5蛋白二、三级结构预测结果 应用SOPMA程序对IGFBP5蛋白二级结构进行预测,结果(图5)发现陆川猪IGFBP5蛋白有178个无规则卷曲(占65.68%)、48个α-螺旋(占17.71%)、30个延伸链(占11.07%)和15个β-转角(占5.54%)。应用SWISS-MODEL对陆川猪IGFBP5蛋白可能存在的三级结构进行预测,发现存在2种模型(图6)。
2. 2. 4 陆川猪IGFBP5蛋白亲/疏水性预测结果 应用ProtScale对陆川猪IGFBP5蛋白亲/疏水性进行预测,然后根据分值大于0代表疏水、分值小于0代表亲水进行判断。结果表明,第116位氨基酸的疏水分值最小,为-3.389;第6位氨基酸的疏水值最大,为3.167(图7)。陆川猪IGFBP5蛋白共有192个亲水性氨基酸,71个疏水性氨基酸,即该蛋白表现为亲水性。
2. 2. 5 陆川猪IGFBP5蛋白跨膜区及其信号肽预测结果 采用TMHMM Server v.2.0对陆川猪IGFBP5蛋白跨膜结构进行预测,结果发现该蛋白不存在跨膜结构(图8);以SignalP 4.1对陆川猪IGFBP5蛋白信号肽进行预测,发现在第1~20位氨基酸残基存在1个信号肽序列(图9)。
2. 2. 6 陆川猪IGFBP5蛋白磷酸化位点预测结果 应用NetPhos 3.1 Server进行蛋白磷酸化位点预测分析,结果(图10)发现陆川猪IGFBP5蛋白第35、40、104、115、124、132、144、156、162、178、186、198、205、232、264、267和268位的丝氨酸(Ser),第70、122、123、130、141、160和171位的苏氨酸(Thr),第69、105、131、224、246和255位的酪氨酸(Tyr)可能会被磷酸化。同时对这些磷酸化位点所对应的磷酸激酶进行分析,结果发现在陆川猪IGFBP5蛋白上可能有unsp、cdc2、cdk5、GSK3、EGFR、CKII、PKG、PKA、RSK、PKC和p38MAPK等11种保守的蛋白激酶结合位点,且以第115位处的unsp分值最高,为0.998。
2. 2. 7 陸川猪IGFBP5蛋白糖基化位点预测结果 应用NetNGlyc 1.0对陆川猪IGFBP5蛋白N糖基化位点进行预测分析,结果发现该蛋白的第101和170位氨基酸处各存在1个N糖基化位点(图11);以NetOGlyc 3.1对其O糖基化位点进行预测分析,则发现陆川猪IGFBP5蛋白的第3和248位氨基酸处各存在1个O糖基化位点(图12)。
2. 2. 8 陆川猪IGFBP5蛋白保守域和亚细胞定位预测结果 应用NCBI上的CDD对陆川猪IGFBP5蛋白的保守结构域进行预测分析,结果发现该蛋白第39~315位氨基酸存在IB保守结构域,第191~262位氨基酸存在Thyroglobulin-1保守结构域(图13)。应用PSORT II中k-NN计算程序预测分析陆川猪IGFBP5蛋白的亚细胞定位情况,结果显示其分布情况为细胞核占39.1%、细胞质占17.4%、细胞膜(包括细胞壁)占17.4%、线粒体占13.0%、细胞骨架占8.7%、囊泡占4.3%。
2. 3 陆川猪和杜洛克猪背最长肌IGFBP5基因的表达差异
经实时荧光定量PCR检测分析,结果(图14)发现陆川猪和杜洛克猪背最长肌中IGFBP5基因相对表达量分别为0.70±0.08和1.84±0.10,二者表达差异极显著(P<0.01)。
3 讨论
IGFBP5作为IGFBPs家族的成员之一,在人类和动物的生长发育特别是肌肉生长过程中发挥重要作用,且有许多因子能调节其表达进而影响肌肉生长(张国梁等,2011)。Soriano-Arroquia等(2016)研究发现,miR-143的靶基因IGFBP5随细胞的衰老而上调表达,从而影响肌细胞生成。Pan等(2017)研究表明,miR-137可通过靶向IGFBP5和调节mTOR/STAT3信号传导途径来抑制血管平滑肌细胞的增殖和迁移。Zhang等(2017)研究表明,miR-143通过靶向IGFBP5调节牛骨骼肌卫星细胞的增殖和分化,miR-143过表达则导致IGFBP5蛋白水平降低,抑制细胞的增殖和分化。可见,IGFBP5在肌细胞的增殖分化过程中发挥重要作用,由此确定IGFBP5基因对陆川猪肌细胞增殖分化也有调控作用。本研究成功克隆获得陆川猪IGFBP5基因可为揭示IGFBP5对陆川猪肌细胞增殖分化的调控机制打下基础,同时为改善陆川猪瘦肉率和饲料转化率等提供理论依据。
IGFBP5基因作为生长肥育性状的候选基因,研究其在不同物种间的遗传多态性分布,挖掘与生产性状相关的遗传标记为育种生产提供指导。芦春艳等(2010)研究表明,草原红牛IGFBP5基因第3外显子在191 bp处存在G→A碱基突变,且该突变与宰前活重和胴体重显著相关;封利颖(2013)研究发现,虾夷扇贝IGFBP5基因UTR区中的C.1051A>G位点与其壳长、壳高、体重、软体重及横纹肌重显著相关;吴苏日古嘎(2013)研究表明,IGFBP5可能与蒙古马耐力运动性能及骨骼肌生长发育相关。本研究克隆获得的陆川猪IGFBP5基因CDS序列全长816 bp,与NCBI上已公布的野猪IGFBP5基因(NM_214099.1)CDS序列存在3处碱基差异,分别是:419 bp处A突变为G,导致第140位的组氨酸突变为精氨酸(140His→Arg);468 bp处A突变为T,导致第156位的精氨酸突变为丝氨酸(156Arg→Ser);533 bp处T突变为C,导致第178位的亮氨酸突变为丝氨酸(178Leu→Ser)。这3个位点的突变是否可作为与陆川猪胴体重、瘦肉率等性状相关的遗传标记,尚有待进一步研究。陆川猪IGFBP5基因共编码271个氨基酸,与NCBI上已公布各物种的IGFBP5氨基酸序列同源性均在95.2%以上,表明IGFBP5基因保守性较强;IGFBP5蛋白的二级结构由α-螺旋、延伸链、β-转角和无规则卷曲组成,其中无规则卷曲占比最高,为65.68%;陆川猪IGFBP5蛋白不存在跨膜结构,在第1~20位氨基酸残基存在1个信号肽序列;蛋白修饰结构预测结果表明,陆川猪IGFBP5蛋白存在2个O糖基化位点、2个N糖基化位点和多个潜在磷酸化位点;亚细胞定位预测分析结果表明其可能分布在细胞核、细胞质、细胞壁、线粒体、细胞骨架和囊泡中;陆川猪IGFBP5蛋白包含IB保守结构域和Thyroglobulin-1保守结构域。此外,实时荧光定量PCR检测分析发现IGFBP5基因在杜洛克猪背最长肌中的相对表达量极显著高于其在陆川猪背最长肌中的相对表达量。由于IGFBP5基因在肌肉中高表达,且与肌肉增殖分化密切相关,故推测IGFBP5基因在不同猪种间的差异表达是导致猪肉瘦肉率差异的主要原因。
4 结论
IGFBP5基因保守性较强,其在不同猪种间的差异表达可能是导致猪肉瘦肉率差异的主要原因,可作为陆川猪胴体重和瘦肉率等生长性状的遗传标记予以开发利用。
参考文献:
邓洛娜,罗祖朋,张志望,李一星,梁明振,周磊. 2018. 不同猪种脂肪组织基因组DNA甲基化分析[J]. 基因组学与应用生物学,37(11):4730-4735. [Deng L N,Luo Z P,Zhang Z W,Li Y X,Liang M Z,Zhou L. 2018. Analysis of DNA methylation in adipose tissues genomes of different pig breeds[J]. Genomics and Applied Biology,37(11):4730-4735.]
封利颖. 2013. 虾夷扇贝IGFBP5、IGF2BP2基因克隆、表达分析及与生长相关的SNP位点筛查[D]. 青岛:中国海洋大学. [Feng L Y. 2013. IGFBP5 and IGF2BP2 genes in Yesso scallop(Patinopecten yessoensis):Molecular clo-ning,expression analysis and identification of SNPs associated with growth traits[D]. Qingdao:Ocean University of China.]
黃雅琼,江永强,梁文全,陈旭健,曾诗媛,李家洲,赵仕花,阮桂文,石德顺. 2013. 陆川猪的生物学特征及其优良性能的研究概况[J]. 家畜生态学报,34(5):82-84. [Huang Y Q,Jiang Y Q,Liang W Q,Chen X J,Zeng S Y,Li J Z,Zhao S H,Ruan G W,Shi D S. 2013. A review of biolo-gical characteristics and performance in Luchuan pig[J]. Acta Ecologiae Animal Domastici,34(5):82-84.]
黄艳娜,李莉,韦玲静,郭晓萍,梁明振,兰干球,蒋钦杨. 2014a. 陆川猪肌肉生长抑制素基因的克隆与序列分析[J]. 南方农业学报,45(4):659-663. [Huang Y N,Li L,Wei L J,Guo X P,Liang M Z,Lan G Q,Jiang Q Y. 2014a. Gene cloning and sequence analysis of Myostatin in Luchuan pig[J]. Journal of Southern Agriculture,45(4):659-663.]
黄艳娜,李莉,何少婧,韦玲静,梁明振,兰干球,蒋钦杨. 2014b. 陆川猪脂蛋白脂酶基因的克隆与序列分析[J]. 南方农业学报,45(6):1074-1078. [Huang Y N,Li L,He S J,Wei L J,Liang M Z,Lan G Q,Jiang Q Y. 2014b. Gene cloning and sequence analysis of lipoprotein lipase in Luchuan pig[J]. Journal of Southern Agriculture,45(6):1074-1078.]
焦迪,谢婉,潘鹏丞,陈宝剑,关志惠,杨秀荣,兰干球,郭亚芬,谢炳坤. 2019. 陆川猪MYL9基因克隆及其表达差异分析[J]. 南方农业学报,50(3):454-460. [Jiao D,Xie W,Pan P C,Chen B J,Guan Z H,Yang X R,Lan G Q,Guo Y F,Xie B K. 2019. Cloning and differential expre-ssion analysis of MYL9 gene in Luchuan pig[J]. Journal of Southern Agriculture,50(3):454-460.]
刘怡然. 2017. miRNA-149-5p在2型糖尿病发病中的机制研究[D]. 开封:河南大学. [Liu Y R. 2017. The mechanism of miRNA-149-5p in the pathogenesis of type 2 diabetes mellitus[D]. Kaifeng:Henan University.]
芦春艳,杨润军,姜昊,张金玉,张国梁,赵玉民,赵志辉. 2010. 草原红牛IGFBP-5基因外显子多态性及对胴体性状的影响[J]. 中国兽医学报,30(7):1005-1008. [Lu C Y,Yang R J,Jiang H,Zhang J Y,Zhang G L,Zhao Y M,Zhao Z H. 2010. SNP analysis of IGFBP-5 gene exons and relationship with carcass weight in red steppes[J]. Chinese Journal of Veterinary Science,30(7):1005-1008.]
毛胜. 2009. IGF轴的重要成员—IGFBP5的结构与功能的研究进展[J]. 职大学报,(4):87-91. [Mao S. 2009. Research progress on the structure and function of IGFBP5,an important member of the IGF axis[J]. Journal of the Staff and Worker’s University,(4):87-91.]
饶大庞,虞海峰,王帅彬,孙来芳. 2018. miRNA-149抑制膀胱癌细胞侵袭的初步分子机制研究[J]. 中国现代医生,56(26):38-41. [Rao D P,Yu H F,Wang S B,Sun L F. 2018. Study on the preliminary molecular mechanism of miRNA-149 inhibiting bladder cancer cell invasion[J]. China Modern Doctor,56(26):38-41.]
商鹏,王克君,李文婷,谭占坤,张博,王志秀,马俊,张浩,强巴央宗. 2016. IGF-Ⅱ和IGFBP5基因在鸡胚胎发育过程中腿部肌肉表达模式分析[J]. 黑龙江畜牧兽医,(15):81-84. [Shang P,Wang K J,Li W T,Tan Z K,Zhang B,Wang Z X,Ma J,Zhang H,Qiangbayangzong. 2016. Analysis of expression patterns of leg muscles during embryonic development of IGF-II and IGFBP5 genes[J]. Hei-longjiang Animal Science and Veterinary Medicine,(15):81-84.]
吴苏日古嘎. 2013. IGFBP5基因在蒙古马不同组织及不同运动时期的表达量研究[D]. 呼和浩特:内蒙古农业大学. [Wusuriguga. 2013. The expression study of IGFBP5 gene in the different tissues and different exercise period of Mongolian horses[D]. Hohhot:Inner Mongolia Agricultural University.]
夏琴,崔悦悦,邹辉,瞿秋红,江雨航,蒋钦杨,黄艳娜. 2018. 陆川猪SOCS3基因克隆及生物信息学分析[J]. 基因组学与应用生物学,37(8):3269-3275. [Xia Q,Cui Y Y,Zou H,Qu Q H,Jiang Y H,Jiang Q Y,Huang Y N. 2018. The cloning and bioinformatics analysis of SOCS3 gene in Luchuan pig[J]. Genomics and Applied Biology,37(8):3269-3275.]
谢婉,焦迪,何剑雄,陈宝剑,关志惠,兰干球,郭亚芬,谢炳坤. 2018. 陆川猪GPR1基因启动子甲基化及其mRNA表达分析[J]. 黑龙江畜牧兽医,(17):1-4. [Xie W,Jiao D,He J X,Chen B J,Guan Z H,Lan G Q,Guo Y F,Xie B K. 2018. Methylation and mRNA expression analysis of GPR1 gene promoter in Luchuan pig[J]. Heilongjiang Animal Husbandry and Veterinary Medicine,(17):1-4.]
张国梁,吴健,李旭,刘基伟,胡成华,秦立红,赵志辉,赵玉民. 2011. IGFBP5基因在草原红牛阉割牛与公牛不同组织中的表达差异[C]. 北京:中国畜牧兽医学会养牛学分会2011年学术研讨会论文集. [Zhang G L,Wu J,Li X,Liu J W,Hu C H,Qin L H,Zhao Z H,Zhao Y M. 2011. Expression and comparaitve study of IGFBP5 in diffe-rent tissues of steerand bull Chinese Red Steppe[C]. Beijing:Proceedings of the 2011 Academic Symposium of the China Animal Husbandry and Veterinary Society’s Cattle Breeding Society.]
Arai T,Parker A,Busby W Jr,Clemmons D R. 1994. Heparin,heparan sulfate,and dermatan sulfate regulate formation of the insulin-like growth factor-I and insulin-like growth factor-binding protein complexes[J]. The Journal of Biological Chemistry,269(32):20388-20393.
Kalus W,Zweckstetter M,Renner C,Sanchez Y,Georgescu J,Grol M,Demuth D,Schumacher R,Dony C,Lang K,Holak T A. 1998. Structure of the IGF-binding domain of the insulin-like growth factor-binding protein-5(IGFBP-5):Implications for IGF and IGF-I receptor interactions[J]. The EMBO Journal,17(22):6558-6572.
Lehnert S A,Reverter A,Byrne K A,Wang Y,Nattrass G S,Hudson N J,Greenwood P L. 2007. Gene expression studies of developing bovine longissimus muscle from two
different beef cattle breeds[J]. BMC Development Biolo-
gy,7:95.
McGivney B A,McGettigan P A,Browne J A,Evans A C,Fonseca R G,Loftus B J,Lohan A,MacHugh D E,Murphy B A,Katz L M,Hill E W. 2010. Characterization of the equine skeletal muscle transcriptome identifies novel functional responses to exercise training[J]. BMC Geno-mics,11:398. doi: 10.1186/1471-2164-11-398.
Pan J,Li K,Huang W,Zhang X. 2017. MiR-137 inhibited cell proliferation and migration of vascular smooth musclecells via targeting IGFBP-5 and modulating the m TOR/STAT3 signaling[J]. PLoS One,12(10):e0186245.
Pilewski J M,Liu L,Henry A C,Knauer A V,Feghali-Bostwick C A. 2005. Insulin-like growth factor binding proteins 3 and 5 are overexpressed in idiopathic pulmonary fibrosis and contribute to extracellular matrix deposition[J]. The American Journal of Pathology,166(2):399-407.
Soriano-Arroquia A,McCormick R,Molloy A P,McArdle A,Goljanek-Whysall K. 2016. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration[J]. Aging Cell,15(2):361-369.
Yasuoka H,Jukic D M,Zhou Z,Choi A M,Feghali-Bostwick C A. 2006. Insulin-like growth factor binding protein 5 induces skin fibrosis:A novel murine model for dermal fibrosis[J]. Arthritis and Rheumatism,54(9):3001-3010.
Zhang W R,Zhang H N,Wang Y M,Dai Y,Liu X F,Li X,Ding X B,Guo H. 2017. miR-143 regulates proliferation and differentiation of bovine skeletal muscle satellite cells by targeting IGFBP5[J]. In vitro Cellullar & Deve-lopmental Biology,53(3):265-271.
(責任编辑 兰宗宝)
