玉米蔗糖转运蛋白基因ZmSUT4克隆及其低温胁迫下的表达模式
2019-09-10弓雪姜敏齐欣刘欣芳卢生乔陈坤刘亚利张述宽马涛杨耀迥
弓雪 姜敏 齐欣 刘欣芳 卢生乔 陈坤 刘亚利 张述宽 马涛 杨耀迥



摘要:【目的】克隆玉米蔗糖轉运蛋白基因ZmSUT4,并明确其组织表达特性及在低温胁迫下的表达模式,为深入研究SUT4基因响应低温胁迫的作用机理提供理论依据。【方法】以玉米自交系黄早四幼苗为材料,采用RT-PCR克隆其ZmSUT4基因,分析其生物学信息,构建系统发育进化树,并采用实时荧光定量PCR(qRT-PCR)检测其组织表达特异性及低温胁迫(4 ℃)下不同组织中的表达模式。【结果】克隆获得的ZmSUT4基因(GenBank登录号MK541991)全长为1621 bp,开放阅读框(ORF)长度为1506 bp,编码501个氨基酸,编码蛋白的分子量53.36 kD,理论等电点(pI)8.84,具有12个跨膜结构,定位于细胞膜上,既属于易化扩散载体(MFS)家族成员,也属于蔗糖/H+共转运体(GPH)超家族成员,其中第25~447位氨基酸是MFS家族蛋白的保守结构域,第17~484位氨基酸是GPH超家族成员的蔗糖运转子保守结构域GPH-sucrose。ZmSUT4蛋白的氨基酸序列与单子叶植物SUT4蛋白同源性较高,为86%~96%,聚集在同一分支上;与双子叶植物SUT4蛋白同源性较低,为62%~65%,说明该类蛋白在不同物种间高度保守。ZmSUT4基因在玉米的根、茎和叶中均有表达,以根中的表达量最高,其次是叶,茎中的表达量最低。低温胁迫下,ZmSUT4基因在不同组织中表达量模式不同,根和叶中ZmSUT4基因表达量均在胁迫24 h达最大值,分别是低温胁迫前(0 h)表达量的2.21和2.62倍,茎中的ZmSUT4基因表达量在胁迫6 h达最大值,是低温胁迫前表达量的3.01倍。【结论】ZmSUT4基因受低温胁迫诱导表达,推测其是调控玉米响应低温胁迫的关键基因。
关键词: 玉米;蔗糖转运蛋白;ZmSUT4基因;低温胁迫;基因表达;生物信息学分析
中图分类号: S513.035.3 文献标志码: A 文章编号:2095-1191(2019)06-1165-08
Abstract:【Objective】The sucrose transporter gene ZmSUT4 was cloned from maize genome, its tissue expression characteristic and expression patterns in different tissues under low temperature stress were analyzed to lay the foundation for studying the mechanism of SUT4 gene in response to low temperature stress. 【Method】Reverse transcription-PCR(RT-PCR)method was performed to clone the ZmSUT4 gene from the maize inbred line Huangzaosi. Its bioinformatics was ana-lyzed and phylogenetic tree was established. Tissue expression specificity of gene ZmSUT4 and its expression patterns in different tissues under low temperature stress(4 ℃) were analyzed by real-time fluorescence quantitative PCR(qRT-PCR). 【Result】ZmSUT4 gene was cloned(GenBank accession number MK541991) with full length of 1621 bp and harboured a open reading frame(ORF) of 1506 bp in length that encoded 501 amino acids with a molecular weight of 53.36 kD and an theoretical isoelectric point(pI) of 8.84. The ZmSUT4 protein had 12 trans-membrane spanning domains and located in cytomembrane,belonging to the major facilitator superfamily(MFS) and the sucrose/H+ symporter(glycoside-pentoside-hexuronide,GPH)family. Among them,the 25th to the 447th amino acids belonged to the conservative domain of MFS,while the 17th to th 484th amino acids were the conservative domain of GPH-sucrose. Amino acid sequence of ZmSUT4 had high identity(86-96%) with SUTs proteins in monocotyledon plants and belonged to the same branch, while shared low similarity(62%-65%) with SUTs proteins in dicotyledonous plant,illustrating that the amino acid sequences of SUT4 fami-ly proteins in different species were highly conservative. The relative expression level of ZmSUT4 could be detected in the leaves,stems and roots during seedling stage. Among them,the expression was the highest in the roots,followed by the leaves,and the lowest in the stems. Furthermore, the expression patterns of ZmSUT4 in various tissues were different. Under 24 h cold treatment,the expression in leaves and roots reached the peak and was as 2.21 times and 2.62 times as that at 0 h,respectively. The expression level in stems reached its maximum at 6 h,which was as 3.01 times as that before cold stress(0 h). 【Conclusion】The expression of ZmSUT4 is induced by low temperature stress. It is inferred that ZmSUT4 is a crucial gene in maize for responding to low temperature stress.
Key words: maize; sucrose transporter; ZmSUT4 gene; low temperature stress; gene expression; bioinformatics analysis
0 引言
【研究意义】玉米(Zea mays)是全球重要的粮食、经济和饲料作物,也是我国东北地区种植面积最大的作物。但我国东北地区平均温度偏低,积温不足,极端低温天气频发,严重阻碍玉米的生长,而导致大幅减产(李馨园等,2017)。蔗糖是玉米光合作用的重要产物,其作为能量代谢底物和信号物质在玉米抵御低温胁迫、稳产中发挥重要作用(Kühn and Grof,2010)。研究发现,蔗糖在从合成部位运输至生长器官过程中,蔗糖转运蛋白(Sucrose transporters,SUCs或SUTs)负责蔗糖装载、卸载及长距离运输,低温胁迫下可通过调整蔗糖在源库间分配从而减少对玉米生长发育的影响,提高逆境适应能力(Kühn and Grof,2010;Gong et al.,2015)。因此,深入研究低温胁迫下SUTs基因表达情况对探究植物光合产物运输和分配调节机制具有重要意义。【前人研究进展】通过RT-PCR、cDNA文库筛选、EST库或基因组序列数据库搜索等方法,已鉴定出100多种SUTs基因(Sun et al.,2008;Hirose et al.,2010;齐素坤等,2018),根据各基因序列同源性和蔗糖的亲和力,可将其划分为SUT1、SUT2、SUT3、SUT4和SUT5五个亚族,其中SUT1亚族是双子叶植物所特有,SUT2和SUT4亚族是单子叶和双子叶植物所共有,SUT3和SUT5亚族是单子叶植物所特有,说明单子叶和双子叶植物的SUTs发生分子变异及进化(Sauer,2007;Kühn and Grof,2010)。不同物种含有的SUTs基因家族成员数量也不同,如拟南芥含9个成员,玉米和小麦均含6个成员(Kühn and Grof,2010;Aoki et al.,2012)。SUTs基因家族成员在不同生长阶段及不同部位表达行使多种生物学功能,同时参与许多信号转导途径(Gupta and Kaur,2005;Kühn and Grof,2010)。此外,SUTs在高盐、干旱和低温等非生物胁迫中发挥重要作用,如拟南芥AtSUC2、AtSUC4、AtSUC9、苹果MdSUT2和水稻OsSUT2基因受非生物胁迫、ABA或低糖诱导表达时,通过加强源叶中蔗糖外运,促进库器官碳水化合物的积累而提高植株抗性(Ibraheem et al.,2011;Gong et al.,2015;Jia et al.,2015;Ma et al.,2016)。高盐胁迫诱导旱芹AgSUT1基因的表达下调,尤其是在根中表达显著下调,可能是植株通过减少对根中蔗糖的供应以抑制根的生长,从而抵御盐胁迫(Noiraud et al.,2000)。在盐和干旱胁迫下,百脉根LjSUT4和杨树PtaSUT4基因通过调控液泡中蔗糖浓度,改变液泡局部渗透压,影响植株水分平衡,提高植株抗性(Reinders et al.,2008;Frost et al.,2012)。干旱胁迫下,小麦叶片中TaSUT2基因表达显著下调,TaSUT3基因表达显著上调,但TaSUT1基因的表达量无明显变化,说明逆境胁迫下不同SUTs基因家族成员的响应方式和发挥的作用各不相同(Xue et al.,2008)。此外,利用分裂泛素系统研究发现,AtSUC3与AtSUC2和AtSUC4均存在互作效应(Reinders et al.,2002;Schulze et al.,2003),非生物胁迫下拟南芥野生型植株中AtSUC2和AtSUC4基因表达量较未处理组野生型显著上调,在AtSUC3突变体中AtSUC2和AtSUC4基因表达量增幅较野生型显著降低,说明AtSUC3基因可能通过调节AtSUC2和AtSUC4基因表达,参与植物逆境响应(Gong et al.,2015)。目前,关于玉米SUTs基因表达特性的研究报道较少。马小龙等(2009)研究发现,玉米ZmERD6基因受ABA、干旱、盐和低温诱导,其编码蛋白含有易化扩散载体(MFS)结构域,属于MFS家族的蔗糖转运子(Sugar transporter)亚族,但与ZmSUT1~ZmSUT6蛋白序列的同源性非常低。【本研究切入点】至今,鲜见有关玉米ZmSUT4基因克隆及低温胁迫下表达特性分析的研究报道。【拟解决的关键问题】以玉米自交系黄早四幼苗为材料,采用RT-PCR克隆其ZmSUT4基因,分析其生物學信息,构建系统发育进化树,并采用实时荧光定量PCR(qRT-PCR)检测其组织特异性及低温胁迫下不同组织中的表达模式,为探究ZmSUT4基因响应低温协迫的作用机制提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料为玉米自交系黄早四,由辽宁省农业科学院玉米研究所提供,种植于辽宁省农业科学院盆栽场。主要试剂:植物总RNA提取试剂盒和cDNA第一链合成试剂盒(Quantscript RT Kit)均购自天根生化科技(北京)有限公司;Promega GoTaq qPCR试剂盒购自美国Promega公司;KAPA Hifi高保真DNA聚合酶购自美国KAPA Biosystems公司;大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;pMD20-T克隆载体购自宝生物工程(大连)有限公司。主要仪器设备:人工气候箱(北京东联哈尔仪器制造有限公司)、ChemiDoc XRS+凝胶成像系统(BIO-RAD,美国)和qTOWER 2.2实时荧光定量PCR仪(Jena,德国)等。
1. 2 试验方法
1. 2. 1 低温胁迫处理及样品采集 将玉米自交系黄早四种子播种在营养土∶蛭石=3∶1(m/m)的混合土中,每盆种1粒种子。参照Zhao等(2009)的方法,待幼苗长至三叶一心时,将生长整齐健壮的幼苗移至4 ℃人工气候箱,低温处理0、1、3、6、12和24 h。每个时间点重复3次,每次处理1株。处理结束后,将玉米幼苗从土中取出,小心冲洗根部后擦干,迅速剪取植株根、茎和叶,用锡箔纸包好,液氮速冻后 -80 ℃保存备用。
1. 2. 2 总RNA提取及cDNA第一链合成 利用植物总RNA提取试剂盒提取黄早四幼苗的总RNA,采用1%琼脂糖凝胶电泳检测其完整性。以提取的总RNA为模板,采用cDNA第一链合成试剂盒反转录获得cDNA第一链。
1. 2. 3 引物设计及合成 根据NCBI上已发表的玉米SUT4基因cDNA序列(GenBank登录号AY603492),利用Primer 5.0设计特异引物(表1)。引物由生工生物工程(上海)股份有限公司合成。
1. 2. 4 PCR扩增 以cDNA全长序列为模板,PCR扩增ZmSUT4基因。PCR反应体系50.00 μL:5.00 μL 10×Buffer,2.5 mmol/L dNTP 1.00 μL,10 μmol/L上、下游引物(ZmSUT4-F和ZmSUT4-R)各1.00 μL,cDNA模板1.00 μg,5 U/μL DNA聚合酶0.5 μL,灭菌超纯水补足至50.00 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 100 s,进行30个循环;72 ℃延伸10 min。利用1%琼脂糖凝胶电泳检测PCR产物,切胶回收目的条带,将其与pMD20-T载体连接过夜后转化大肠杆菌DH5α感受态细胞,菌落PCR鉴定后将阳性克隆菌液送至上海立菲生物技术有限公司测序。
1. 2. 5 生物信息学分析 通过NCBI的BLAST进行ZmSUT4基因核苷酸序列比对,并利用ORF finder预测分析ZmSUT4基因的开放阅读框(ORF);采用ProtParam和ProtScale预测编码蛋白的分子量、理论等电点(pI)、亲/疏水性等生化性质;利用Smart和NCBI的CDD预测编码蛋白的保守结构域;利用TMHMM Server v2.0预测蛋白的跨膜结构;利用LocTree3预测蛋白的亚细胞定位;采用SOPMA Secondary Structure Prediction Method预测蛋白的二级结构;应用BioEdit的ClustalW与不同物种的SUT4亚族成员进行序列比对及同源性分析,利用MEGA 6.0.5构建系统发育进化树。
1. 2. 6 qRT-PCR检测 以cDNA第一链为模板,利用GoTaq qPCR试剂盒在qTOWER 2.2实时定量PCR仪上对低温胁迫下玉米苗期ZmSUT4基因的表达模式进行检测。反应体系25.00 μL:SYBR Mix 12.50 μL,10 μmol/L上、下游引物(qZmSUT4-F和qZmSUT4-R)各0.50 µL,cDNA模板1.00 μg,灭菌超纯水补足至25.00 µL。扩增程序:95 ℃預变性5 min;95 ℃ 15 s,60 ℃ 60 s,进行30个循环。以ZmSUT4基因在0 h的表达量为标准参量,以GADPH为内参基因(引物GADPH-F和GADPH-R见表1),无菌超纯水为阴性对照。反应结束后,采用2-ΔΔCt法统计不同处理样品中ZmSUT4基因的相对表达量,每个样品重复3次。
1. 3 统计分析
采用Excel 2007对数据进行统计分析及制图。
2 结果与分析
2. 1 ZmSUT4基因的PCR扩增结果
如图1所示,目的条带约1600 bp,与预期结果相符。测序结果(图2)显示,该片段长度为1621 bp,ORF长度为1506 bp,编码501个氨基酸,经BLAST比对分析发现,其与玉米SUT4基因(GenBank登录号AY603492)相似性高达99%,表明成功克隆获得ZmSUT4基因。该基因已在GenBank基因数据库注册,登录号为MK541991。
2. 2 ZmSUT4蛋白的生物信息学分析结果
ZmSUT4蛋白中带正电荷的氨基酸(精氨酸和赖氨酸)所占比例为33%,带负电荷的氨基酸(天冬氨酸和谷氨酸)所占比例为27%,理论等电点(pI)为8.84,分子式为C2441H3805N635O665S21,分子量53.36 kD,含7567个原子,蛋白不稳定系数(Instability index)36.18,为稳定蛋白。该蛋白N端序列是蛋氨酸,半衰期30 h,脂肪系数103.61;亲水性最强的位点为第167位,分值-3.000,亲水性平均值-0.49,疏水性最强的位点为第225位,分值3.311,由此推测ZmSUT4为亲水性蛋白(图3)。
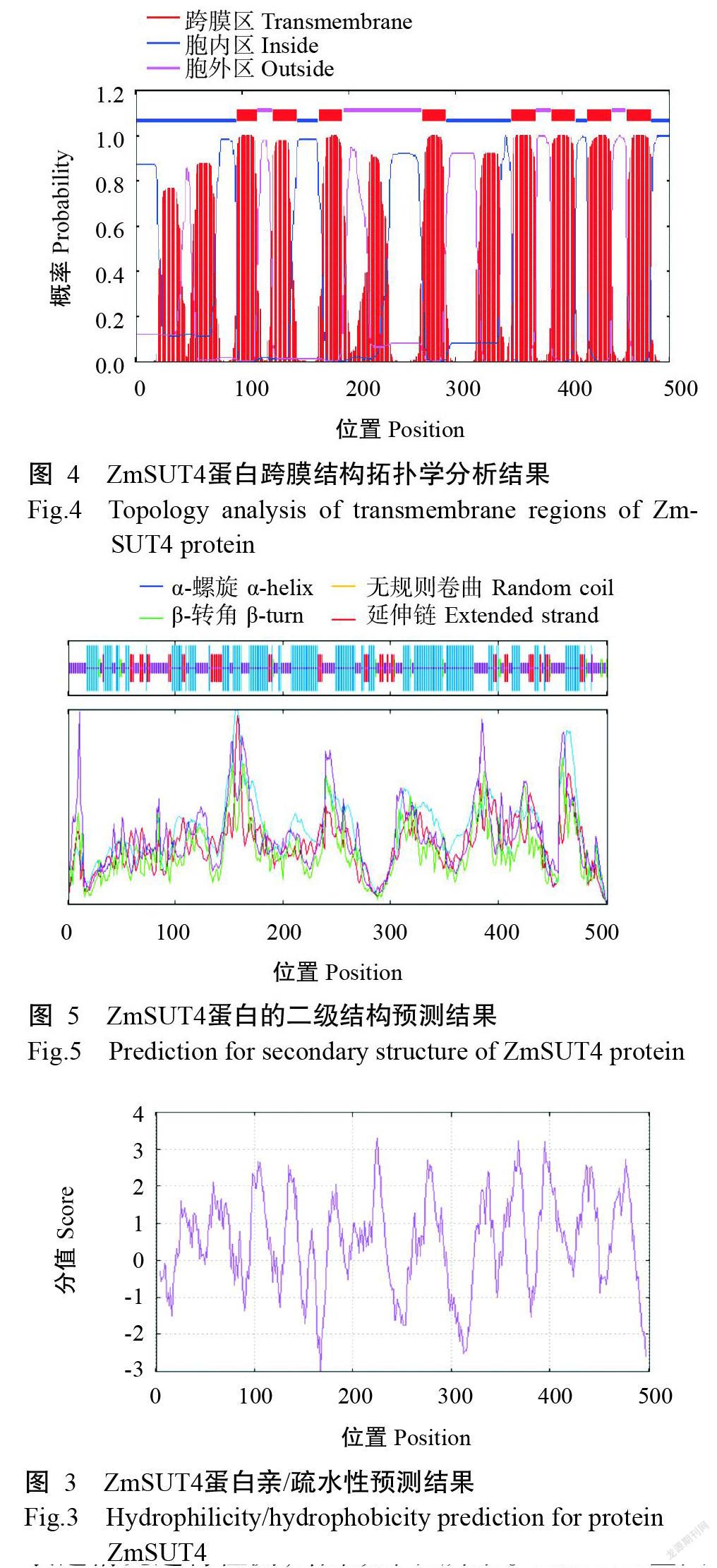
对ZmSUT4蛋白氨基酸序列的保守区进行预测,结果显示,该蛋白既属于MFS家族成员,也属于蔗糖/H+共转运体(GPH)超家族成员,其中第25~447位氨基酸是MFS家族蛋白的保守结构域,第17~484位氨基酸是GPH超家族成员的蔗糖运转子保守结构域GPH-sucrose。蛋白跨膜拓扑学分析结果表明,ZmSUT4蛋白存在12个跨膜结构,在第1个和第2个跨膜结构间均具有保守的组氨酸(His)残基,其是蔗糖与蔗糖转运蛋白的结合区域(图4)。亚细胞定位预测结果显示,ZmSUT4蛋白为一种膜蛋白,可能位于细胞膜上。蛋白二级结构预测结果显示,在ZmSUT4蛋白二级结构中,α-螺旋(α-helix,H)占46.31%,无规则卷曲(Random coil,C)占35.53%,β-转角(β-turn,T)占3.19%,延伸链(Extended strand,E)占14.37%(图5)。
2. 3 同源性比对及系统发育进化树分析结果
为明确ZmSUT4蛋白与其他物种SUTs亚族成员的同源性和进化关系,从NCBI数据库筛选获得11种植物SUT4亚族成员的氨基酸序列,其中,胡萝卜DcSUT1、大麦HvSUT2和水稻OsSUT2均已证实属于SUT4亚族成员(Sun et al.,2008;Kühn and Grof,2010),将其与ZmSUT4蛋白的氨基酸序列进行比对,结果显示,ZmSUT4蛋白与双子叶植物拟南芥AtSUT4(Arabidopsis thaliana,Q9FE59)、杨树PtaSUT4(Populus L.,ADW94617)、马铃薯StSUT4(Solanum tuberosum L.,AAG25923)、胡萝卜DcSUT1(Daucus carota L.,CAA76367)、番茄LeSUT4(Lycopersicon esculentum L.,AAG09270)、百脉根LjSUT4(Lotus corniculatus L.,CAD61275)和桃PpSUT4(Prunus persica L.,ALX37955)的同源性较低,分别为62%、62%、63%、63%、64%、64%和65%,与单子叶植物大麦HvSUT2(Hordeum vulgare L.,CAB75881)、水稻OsSUT2(Oryza sativa L.,BAC67163)、高粱SbSUT4(Sorghum bicolor L.,ACX7183)和甘蔗ShSUT4(Saccharum officinarum,ADE22272)的同源性较高,分别为86%、91%、96%和96%(图6)。由图7可知,单子叶植物和双子叶植物的SUT4亚族成员分别聚在两个不同的分支上,且在同一分支间保守性较高,说明ZmSUT4蛋白与单子叶植物SUT4蛋白的亲缘关系较近。
2. 4 ZmSUT4基因在不同玉米组织中的表达情况
利用qRT-PCR对不同玉米组织中ZmSUT4基因表达情况进行检测,结果如图8所示。ZmSUT4基因在玉米的根、茎和叶中均有表达,且表达量存在明显差异,以根中的表达量最高,叶次之,茎中的表达量最低。叶和根中的表达量分别是茎中表达量的3.81和4.03倍。可见,ZmSUT4基因在不同部位表达模式存在差异,其主要参与叶片蔗糖的合成及根部蔗糖的卸载。
2. 5 低温胁迫下ZmSUT4基因在不同玉米组织中的表达模式分析结果
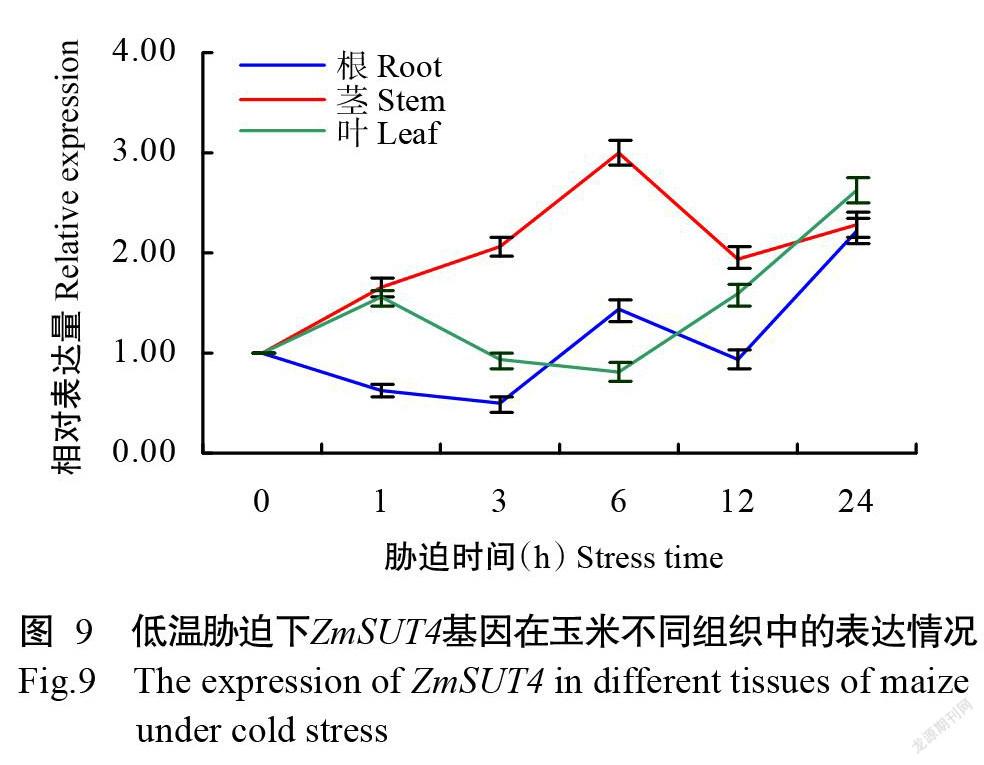
利用qRT-PCR检测低温胁迫下ZmSUT4基因在不同玉米组织中的表达模式,结果如图9所示。ZmSUT4基因对低温胁迫有较明显的响应,但不同组织的响应模式有所差异。根和叶中ZmSUT4基因表达量呈不同的波动式变化趋势,但均在胁迫24 h达最大值,分别是低温胁迫前(0 h)表达量的2.21和2.62倍。茎中ZmSUT4基因的表达量在胁迫0~6 h逐渐增加,至胁迫6 h达最大值,是低温胁迫前表达量的3.01倍,随后快速下降,但仍高于低温胁迫前表达量。可见,不同玉米组织中ZmSUT4基因对低温胁迫响应的关键时间点不同,但均受低温胁迫诱导高效表达,在植株抗低温胁迫中发挥重要调节作用。
3 讨论
SUTs作为一类重要的功能性蛋白,在植物的生长发育过程中发挥重要作用。目前,从玉米中已克隆获得6个SUTs基因(Kühn and Grof,2010),但其在玉米逆境胁迫响应中的作用机制尚未见报道。本研究通过RT-PCR从玉米自交系黄早四中克隆获得ZmSUT4基因,该基因全长1621 bp,ORF长度1506 bp,编码501个氨基酸,经同源比对分析发现,该基因编码蛋白的氨基酸序列与单子叶植物甘蔗、高粱、水稻和大麦的SUT4同源性较高,均在85%以上,尽管双子叶与单子叶植物属于不同分支,但ZmSUT4蛋白与双子叶的同源性仍在60%以上,说明不同植物中SUT4蛋白的氨基酸序列高度保守,推测其在不同植物中发挥相似的生理功能。
本研究发现,ZmSUT4蛋白具有12个跨膜结构,既属于MFS家族成员,也属于GPH超家族成员,其中第25~447位氨基酸是MFS家族蛋白的保守结构域,第17~484位氨基酸是GPH超家族成员的蔗糖运转子保守結构域GPH-sucrose,与前人的相关研究结果(Kühn and Grof,2010;Yan,2013)基本一致。植物SUTs的5个亚族中,SUT4亚族是低亲和/高转运能力的蛋白,定位于叶绿体、液泡膜和细胞膜(Weise et al.,2000;Rolland et al.,2003;Endler et al.,2006;Chincinska et al.,2008),如大麦HvSUT2、桃PpSUT4和水稻OsSUT2定位于液泡膜,参与液泡膜蔗糖的外运(Endler et al.,2006;Sauer,2007;Eom et al.,2011;Zanona et al.,2015);番茄LeSUT2和马铃薯StSUT4定位在细胞膜上,负责蔗糖韧皮部蔗糖装载、卸载和跨膜运输(Hackel et al.,2006;Hofmann et al.,2007;Chincinska et al.,2008)。本研究的亚细胞定位预测结果显示,ZmSUT4蛋白为一种膜蛋白,可能位于细胞膜上。此外,本研究qRT-PCR检测结果表明,在正常生长条件下,ZmSUT4基因在玉米根、茎和叶中均有表达,但表达量存在明显差异,与贺红霞等(2015)研究结果一致。其中,ZmSUT4基因在叶片和根中的表达量较高,茎中的表达量较低,推测该基因可能与番茄LeSUT2和马铃薯StSUT4基因功能相似,参与蔗糖在源器官的装载及库器官的吸收和利用,为库器官提供碳水化合物(Hackel et al.,2006;Hofmann et al.,2007;Chincinska et al.,2008)。
本研究还发现,根和叶中ZmSUT4基因表达量均在低温胁迫24 h达最大值,分别是低温胁迫前表达量的2.21和2.62倍,茎中ZmSUT4基因的表达量在胁迫6 h达最大值,是低温胁迫前表达量的3.01倍,可见,ZmSUT4基因对低温胁迫有较明显的响应,但在不同组织的响应模式有所差异。Gong等(2015)也研究发现,拟南芥叶片和根中AtSUC4基因受低温胁迫诱导高表达。综上所述,不同植物的SUT4基因具有相似调控功能。下一步应将ZmSUT4基因转入模式植物如拟南芥中,以期深入研究玉米ZmSUT4基因在逆境胁迫应答中的调控机制。
4 结论
ZmSUT4基因受低温胁迫诱导表达,推测其是调控玉米响应低温胁迫的关键基因。
参考文献:
贺红霞,陈亮,康爽,林春晶,李楠,柳青,刘丹,薛晶,孙瑞聪,赵慧敏. 2015. 玉米ZmSUT4-J基因的克隆与植物表达载体构建[J]. 吉林农业科学,40(3):18-22. [He H X,Chen L,Kang S,Lin C J,Li N,Liu Q,Liu D,Xue J,Sun R C,Zhao H M. 2015. Cloning of sucrose transporter ZmSUT4-J from Zea mays and construction of plant expre-ssion vector[J]. Journal of Jilin Agricultural Sciences,40(3):18-22.]
李馨园,杨晔,张丽芳,左师宇,李丽杰,焦健,李晶. 2017. 外源ABA对低温胁迫下玉米幼苗内源激素含量及Asr1基因表达的调节[J]. 作物学报,43(1):141-148. [Li X Y,Yang Y,Zhang L F,Zuo S Y,Li L J,Jiao J,Li J. 2017. Regulation on contents of endogenous hormones and Asr1 gene expression of maize seedling by exogenous ABA under low-temperature stress[J]. Acta Agronomica Sinica,43(1):141-148.]
馬小龙,刘颖慧,袁祖丽,石云素,宋燕春,王天宇,黎裕. 2009. 玉米蔗糖转运蛋白基因ZmERD6 cDNAs的克隆与逆境条件下的表达[J]. 作物学报,35(8):1410-1417. [Ma X L,Liu Y H,Yuan Z L,Shi Y S,Song Y C,Wang T Y,Li Y. 2009. Cloning of cDNAs for a novel sugar transporter gene,ZmERD6,from maize and its expression analysis under abiotic stresses[J]. Acta Agronomica Sinica,35(8):1410-1417.]
齐素坤,侯夫云,秦桢,李爱贤,王庆美,张立明. 2016. 植物蔗糖转运蛋白研究进展[J]. 山东农业科学,48(2):149-153. [Qi S K,Hou F Y,Qin Z,Li A X,Wang Q M,Zhang L M. 2016. Research progress of sucrose transporters in plant[J]. Shandong Agricultural Sciences,48(2):149-153.]
Aoki N,Hirose T,Furbank R T. 2012. Sucrose transport in higher plants:From source to sink[J]. Advances in Photosynthesis and Respiration,34:703-729.
Chincinska I A,Liesche J,Krügel U,Michalska J,Geigenber-ger P,Grimm B,Kühn C. 2008. Sucrose transporter StSUT4 from potato affects flowering,tuberization,and shade avoidance response[J]. Plant Physiology,146(2):515-528.
Endler A,Meyer S,Schelbert S,Schneider T,Weschke W,Peters S W,Keller F,Baginsky S,Martinoia E,Schmidt U G. 2006. Identification of a vacuolar sucrose transporter in barley and Arabidopsis mesophyll cells by a tonoplast proteomic approach[J]. Plant Physiology,141(1):196-207.
Eom J S,Cho J I,Reinders A,Lee S W,Yoo Y,Tuan P Q,Choi S B,Bang G,Park Y I,Cho M H,Bhoo S H,An G,Hahn T R,Ward J M,Jeon J S. 2011. Impaired function of the tonoplast-localized sucrose transporter in rice,OsSUT2,limits the transport of vacuolar reserve sucrose and affects plant growth[J]. Plant Physiology,157(1):109-119.
Frost C J,Nyamdari B,Tsai C J,Harding S A. 2012. The tonoplast-localized sucrose transporter in Populus(PtaSUT4) regulates whole-plant water relations,responses to water stress,and photosynthesis[J]. PLoS One,7(8):e44467.
Gong X,Liu M L,Zhang L J,Ruan Y Y,Ding R,Ji Y Q,Zhang N,Zhang S B,Farmer J,Wang C. 2015. Arabidopsis AtSUC2 and AtSUC4,encoding sucrose transporters,are required for abiotic stress tolerance in an ABA-dependent pathway[J]. Physiologia Plantarum,153(1):119-136.
Gupta A K,Kaur N. 2005. Sugar signalling and gene expre-ssion in relation to carbohydrate metabolism under abiotic stresses in plants[J]. Journal of Biosciences,30(5):761-776.
Hackel A,Schauer N,Carrari F,Fernie A R,Grimm B,Kühn C. 2006. Sucrose transporter LeSUTl and LeSUT2 inhibition affects tomato fruit development in different ways[J]. The Plant Journal,45(2):180-192.
Hirose T,Zhang Z J,Miyao A,Hirochika H,Ohsugi R,Terao T. 2010. Disruption of a gene for rice sucrose transpor-ter,OsSUT1,impairs pollen function but pollen maturation is unaffected[J]. Journal of Experimental Botany,61(13):3639-3646.
Hofmann J,Wieczorek K,Blöchl A,Grundler F M. 2007. Sucrose supply to nematode-induced syncytia depends on the apoplasmic and symplasmic pathways[J]. Journal of Experimental Botany,58(7):1591-601.
Ibraheem O,Dealtry G,Roux S,Bradley G. 2011. The effect of drought and salinity on the expressional levels of sucrose transporters in rice(Oryza sativa Nipponbare) cultivar plants[J]. Plant Omics Journal,4(2):68-74.
Jia W Q,Zhang L J,Wu D,Liu S,Gong X,Cui Z H,Cui N,Cao H Y,Rao L B,Wang C. 2015. Sucrose transporter AtSUC9 mediated by a low sucrose level is involved in Arabidopsis abiotic stress resistance by regulating sucrose distribution and ABA accumulation[J]. Plant Cell Physio-logy,56(8):1574-1587.
Kühn C,Grof C P L. 2010. Sucrose transporters of higher plants[J]. Current Opinion in Plant Biology,13(3):288-298.
Ma Q J,Sun M H,Liu Y J,Lu J,Hu D G,Hao Y J. 2016. Molecular cloning and functional characterization of the apple sucrose transporter gene MdSUT2[J]. Plant Physio-logy and Bochemistry,109:442-451.
Noiraud N,Delrot S,Lemoine R. 2000. The sucrose transpor-ter of celery. Identification and expression during salt stress[J]. Plant Physiology,122(4):1447-1455.
Reinders A,Schulze W,Kühn C,Barker L,Schulz A,Ward J M,Frommer W B. 2002. Protein-protein interactions between sucrose transporters of different affinities colocali-zed in the same enucleate sieve element[J]. The Plant Cell,14(7):1567-1577.
Reinders A,Sivitz A B,Starker C G,Gantt J S,Ward J M. 2008. Functional analysis of LjSUT4,a vacuolar sucrose transporter from Lotus japonicus[J]. Plant Molecular Bio-logy,68(3):289-299.
Rolland N,Ferro M,Seigneurin-Berny D,Garin J,Douce R,Joyard J. 2003. Proteomics of chloroplast envelope membranes[J]. Photosynthesis Research,78(3):205-230.
Sauer N. 2007. Molecular physiology of higher plant sucrose transporters[J]. FEBS Letters,581(12):2309-2317.
Schulze W X,Reinders A,Ward J,Lalonde S,Frommer W B. 2003. Interactions between co-expressed Arabidopsis sucrose transporters in the split-ubiquitin system[J]. BMC Biochemistry,4(1):1-10.
Sun A J,Xu H L,Gong W K,Zhai H L,Meng K,Wang Y Q,Wei X L,Xiao G F,Zhu Z. 2008. Cloning and expression analysis of rice sucrose transporter genes OsSUT2M and OsSUT5Z[J]. Journal of Integrative Plant Biology,50(1):62-75.
Weise A,Barker L,Kühn C,Lalonde S,Buschmann H,Frommer W B,Ward J M. 2000. A new subfamily of sucrose transporters,SUT4,with low affinity/high capacity locali-zed in enucleate sieve elements of plants[J]. The Plant Cell,12(8):1345-1355.
Xue G P,Mclntyre C L,Glassop D,Shorter R. 2008. Use of expression analysis to dissect alterations in carbohydrate metabolism in wheat leaves during drought stress[J]. Plant Molecular Biology,67(3):197-214.
Yan N. 2013. Structural advances for the major facilitator superfamily(MFS) transporters[J]. Trends in Biochemical Sciences,38(3):151-159.
Zanon L,Falchi R,Hackel A,Kühn C,Vizzotto G. 2015. Expression of peach sucrose transporters in heterologous systems points out their different physiological role[J]. Plant Sciene,238:262-272.
Zhao J F,Sun Z F,Zheng J,Guo X Y,Dong Z G,Huai J L,Gou M Y,He J G,Jin Y S,Wang J H,Wang G Y. 2009. Cloning and characterization of a novel CBL-interacting protein kinase from maize[J]. Plant Molecular Biology,69(6):661-674.
(責任编辑 陈 燕)
