响应面优化鼓槌石斛花总黄酮提取工艺及其体外抗氧化活性
2019-09-10王彦兵黄家卫李国明刘小琼胡永亮王晓媛白燕冰
王彦兵 黄家卫 李国明 刘小琼 胡永亮 王晓媛 白燕冰



摘 要:【目的】优化鼓槌石斛花总黄酮提取工艺条件,为鼓槌石斛花种质的开发提供技术参考。【方法】以鼓槌石斛花为原料,乙醇溶液为提取剂,在单因素的基础上,选择乙醇体积分数、液料比、超声温度、超声时间4个因素为影响因素,鼓槌石斛花总黄酮提取率为响应值,采用Box-Behnken 试验设计方法,研究各自变量及其交互作用对鼓槌石斛花总黄酮提取率的影响。并通过鼓槌石斛花总黄酮对1, 1-二苯基-2-三硝基苯肼(DPPH)自由基、羟自由基的清除作用评价其抗氧化活性。【结果】鼓槌石斛花总黄酮最佳提取工艺条件为:乙醇体积分数83%,液料比31 mL·g-1,超声温度59℃,超声时间44 min,在此条件下,得到的实际提取率9.71 mg·g-1,与理论值(9.60 mg·g-1)相对误差为1.15%。采用响应面法优化鼓槌石斛花总黄酮提取工艺切实可行,回归模型拟合度及重现性较好。鼓槌石斛花黄酮对DPPH自由基半清除浓度(IC50)值为11.30 μg·mL-1,其清除能力是L-抗坏血酸的0.51倍、2,6-二叔丁基对甲酚(BHT)的1.42倍;对羟自由基IC50值为137.26 μg·mL-1,其清除能力是L-抗坏血酸的0.70倍、BHT的1.95倍。体外抗氧化活性试验表明,相同浓度下其对两种自由基清除能力优于BHT,弱于L-抗坏血酸。【结论】采用响应面法优化得出的鼓槌石斛花总黄酮提取的最佳工艺条件,能有效提高总黄酮提取率。
关键词:鼓槌石斛花; 总黄酮; 提取工艺; 响应面; 抗氧化
中图分类号:TS 201.2;R 284.2文献标识码:A文章编号:1008-0384(2019)06-730-09
Abstract: 【Objective】 Extraction process of flavonoids from the flowers of Dendrobium chrysotoxum Lindl. was optimized, and the antioxidative activity of the extract determined in vitro. 【Method】Flowers of D. chrysotoxum was subjected to an ethanol extraction for flavonoids. The resulting yield was weighed against the processing conditions based on the single-factor tests and Box-Benhnken center composite experiment with four factors including ethanol volume fraction, solvent-to-substrate ratio, temperature, and time of ultrasonic treatment. The antioxidant capacity was estimated by the ability of the extract to scavenge 1, 1-diphenyl-2-picrylhydrazyl (DPPH) and hydroxyl free radicals. 【Result】The optimized processing conditions were determined to include ethanol volume fraction at 83%, solvent-to-substrate ratio at 31 mL·g-1, temperature at 59℃ and ultrasound application for 44m to obtain up to 9.71 mg·g-1 of total flavonoids in the extract. The yield exceeded the theoretically expected 9.60 mg·g-1 with a relative deviation of 1.15%. The in vitro tests showed an IC50 for DPPH to be 11.30 μg·mL-1, a scavenging ability 0.51-time of L-ascorbic acid or 1.42-time of BHT, while that for hydroxyl radicals, 137.26 μg·mL-1, a scavenging ability 0.70-time of L-ascorbic acid or 1.95-time of BHT.【Conclusion】The optimized flavonoid extraction paved the way for scale-up utilization of D. chrysotoxum flowers.
Key words:Dendrobium chrysotoxum Lindl. flowers; total flavonoids; process optimization; response surface analysis; antioxidant
0 引言
【研究意义】鼓槌石斛Dendrobium chrysotoxum Lindl.属兰科Orchidaceae多年生附生草本植物,茎兩端急尖,形似“鼓槌”,因此得名[1-3]。主要分布于缅甸、老挝和我国西南地区,资源丰富,具有较高的药用价值,收录于2015年版《中华人民共和国药典》[1, 3-4]。鼓槌石斛活性提取物具有抗氧化、抑制肿瘤活性、提高免疫力及清除自由基等功效[5-8]。而其花兼具药用和食用价值,具有疏肝解郁、缓急止痛、缓解疲劳等功效[9-10]。总状花序由茎顶端生出,斜下生长,可长达20 cm,产花量大,是保健石斛花茶的理想原料,具有重要的开发研究价值[11]。大量研究表明,天然植物中的黄酮类化合物具有抗氧化、抑制脂肪酶、抑制癌细胞扩散等功效,是天然产物研究的热点[12-13]。因此,开展鼓槌石斛花总黄酮提取工艺研究,对鼓槌石斛花的开发研究具有重要意义。【前人研究进展】目前,关于石斛花的研究主要集中在其营养价值[10, 14]、降压[15-16]、挥发性成分[17-18]等方面,其总黄酮含量测定及提取工艺的优化报道较少。唐静月等[19]发现采用超声波提取铁皮石斛花总黄酮提取率优于加热回流提取法,而后采用正交法优化乙醇超声波浸提铁皮石斛花总黄酮工艺,在乙醇体积分数80%、料液比1∶50,提取温度55℃条件下浸提2次,总黄酮提取率达1.99%;缪园欣等[20]采用正交实验对乙醇超声波浸提铁皮石斛花总黄酮提取工艺进行优化,在乙醇体积分数80%、料液比1∶35 (g∶mL)、超声温度40℃条件下浸提50 min,铁皮石斛花总黄酮提取率为2.31%;张东英等[9]对比超声波法和热回流法提取鼓槌石斛花总黄酮效果,发现超声提取具有操作方便,用时少,提取率高等优点。【本研究切入点】目前,采用正交试验优化石斛花总黄酮提取工艺条件,借助响应面法优化石斛花总黄酮提取工艺的研究鲜有报道。响应面法可以克服正交法只能在已有水平条件下获取水平组合的缺点,对所取水平的整个区域进行筛选,结果更具说服力。【拟解决的关键问题】本文以鼓槌石斛花为研究对象,基于单因素实验,以乙醇体积分数、液料比、超声温度、超声时间为自变量,鼓槌石斛花总黄酮提取率为响应值,利用响应面实验设计方法,对鼓槌石斛花总黄酮提取工艺进行优化,并分析其体外抗氧化活性,为鼓槌石斛花的进一步开发利用提供理论基础。
1 材料与方法
1.1 材料与仪器
鼓槌石斛花,由云南省德宏热带农业科学研究所药植中心提供,经该所白燕冰研究员鉴定为兰科Orchidaceae石斛属Dendrobium顶叶组Sect. Chrysotoxae鼓槌石斛D. chrysotoxum花序,50℃烘箱中烘干后,粉碎过60目筛,干燥保存备用;芦丁标准品,HPLC≥98%,北京世纪奥科生物技术有限公司;亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇,均为分析纯,天津市风船化学试剂科技有限公司;实验用水均为去离子水(实验室自制)。
GZX-9030MBE电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;SB25-12DTS超声波双频清洗机,宁波新芝生物科技股份有限公司;ME201电子天平,梅特勒-托利多仪器(上海)有限公司;Labonova Smar超纯水机,Think-lab Corporation;CT14D台式高速离心机,上海天美生化仪器设备工程有限公司。
1.2 试验方法
1.2.1 鼓槌石斛花总黄酮提取流程
鼓槌石斛花→50℃烘干→粉碎→过60目筛→称取1.0 g样品→自变量下超声浸提(超声波功率200 W,超声频率40 kHz)→离心(4 000 r·min-1)→取上清液→备用。
1.2.2 单因素试验
乙醇体积分数:固定液料比30∶1(mL·g-1),超声温度60℃,超声时间45 min,考察乙醇体积分数为40%、50%、60%、70%、80%、90%条件下鼓槌石斛花总黄酮得率。
液料比:固定乙醇体积分数80%,超声温度60℃,超声时间45 min,考察液料比(mL∶g-1)为10∶1、20∶1、30∶1、40∶1、50∶1、60∶1条件下鼓槌石斛花总黄酮得率。
超声温度:固定乙醇体积分数80%,液料比30∶1(mL·g-1),超声时间45 min,考察超声温度为30、40、50、60、70、80℃条件下鼓槌石斛花总黄酮得率。
超声时间:固定乙醇体积分数80%,液料比30∶1(mL∶g-1),超声温度60℃,考察超声时间为25、35、45、55、65、75 min条件下鼓槌石斛花总黄酮得率。
1.2.3 响应面法优化
依据单因素试验,结合Box-behnken中心组合试验原理,采用4因素3水平的四元二次响应面分析方法(表1),以鼓槌石斛花总黄酮提取率为考察指标,优化提取工艺。
1.2.4 总黄酮含量的测定
标准曲线的绘制:用80%乙醇配制0.2 mg·mL-1芦丁标准溶液;分别吸取0.00、0.20、0.40、0.60、0.80、1.00 mL芦丁标准溶液于5支10 mL比色管中,均加入5% NaNO2溶液0.3 mL,摇匀,静置6 min;加入10% Al(NO3)3溶液0.3 mL,摇匀,静置6 min;加入4% NaOH溶液4.0 mL后,80%乙醇定容至10 mL,摇匀,静置15 min;以第一支比色管溶液为空白参比,于510 nm波长下测定吸光度A。绘制芦丁质量浓度与吸光度之间的线性关系。得出回归方程为:Y=10.804X-0.0236,R2=0.999 8,表明芦丁质量浓度为4.0~20.0 μg·mL-1线性关系良好。
总黄酮的测定及得率的计算:取适量体积待测液于比色管中,按上述方法求得待测液总黄酮浓度,总黄酮得率见公式(1)。
式中:C表示待测液中总黄酮浓度,mg·mL-1;V1表示待测液定容体积,mL;V2表示显示取样体积,mL;V表示提取液总体积,mL;m表示提取样品质量,g。
1.2.5 体外抗氧化活性测定
DPPH 自由基清除率测定:参考Laguerre等[21-22]的方法并加以改进。将鼓槌石斛花提取液用蒸馏水稀释成质量浓度分别为2、4、8、12、16、20 μg·mL-1的样品溶液。实验组取样品溶液2 mL,加入2 mL DPPH无水乙醇溶液(0.1 mmol·L-1),混匀,室温避光放置30 min,以50%乙醇为参比测定溶液在517 nm波长处吸光值A样品;对照组以等体积无水乙醇代替DPPH溶液,测定吸光值为A对照;空白组以等体积蒸馏水代替样品溶液,测定吸光值为A空白。以同浓度BHT、L-抗坏血酸为阳性对照。按照公式(2)计算DPPH自由基清除率:
羟自由基清除率测定:参考张黎明等[23]的方法并加以改进。将鼓槌石斛花提取液用蒸馏水稀释成质量浓度分别为0.03、0.06、0.12、0.18、0.24、0.30 mg·mL-1的样品溶液。实验组取样品溶液1 mL,依次加入2.5 mmol·L-1水杨酸溶液1 mL、5.0 mmol·L-1 FeSO4溶液1 mL、5 mmol·L-1 H2O2溶液1 mL,混匀,37℃水浴锅中恒温反应30 min,离心,以蒸馏水为参比测定溶液在510 nm波长处吸光值A,对照组以等体积蒸馏水代替 H2O2溶液,测定吸光值为A1;空白组以等体积蒸馏水代替样品溶液,测定吸光值为A0。以同浓度BHT、L-抗坏血酸为阳性对照。按照公式(3)计算羟自由基清除率:
1.3 数据处理
所有试验均进行3次重复测定。采用SPSS 20、Origin 85和Design-Expert 8.0.6.1软件进行响应面设计和数据分析。
2 结果与分析
2.1 單因素试验结果
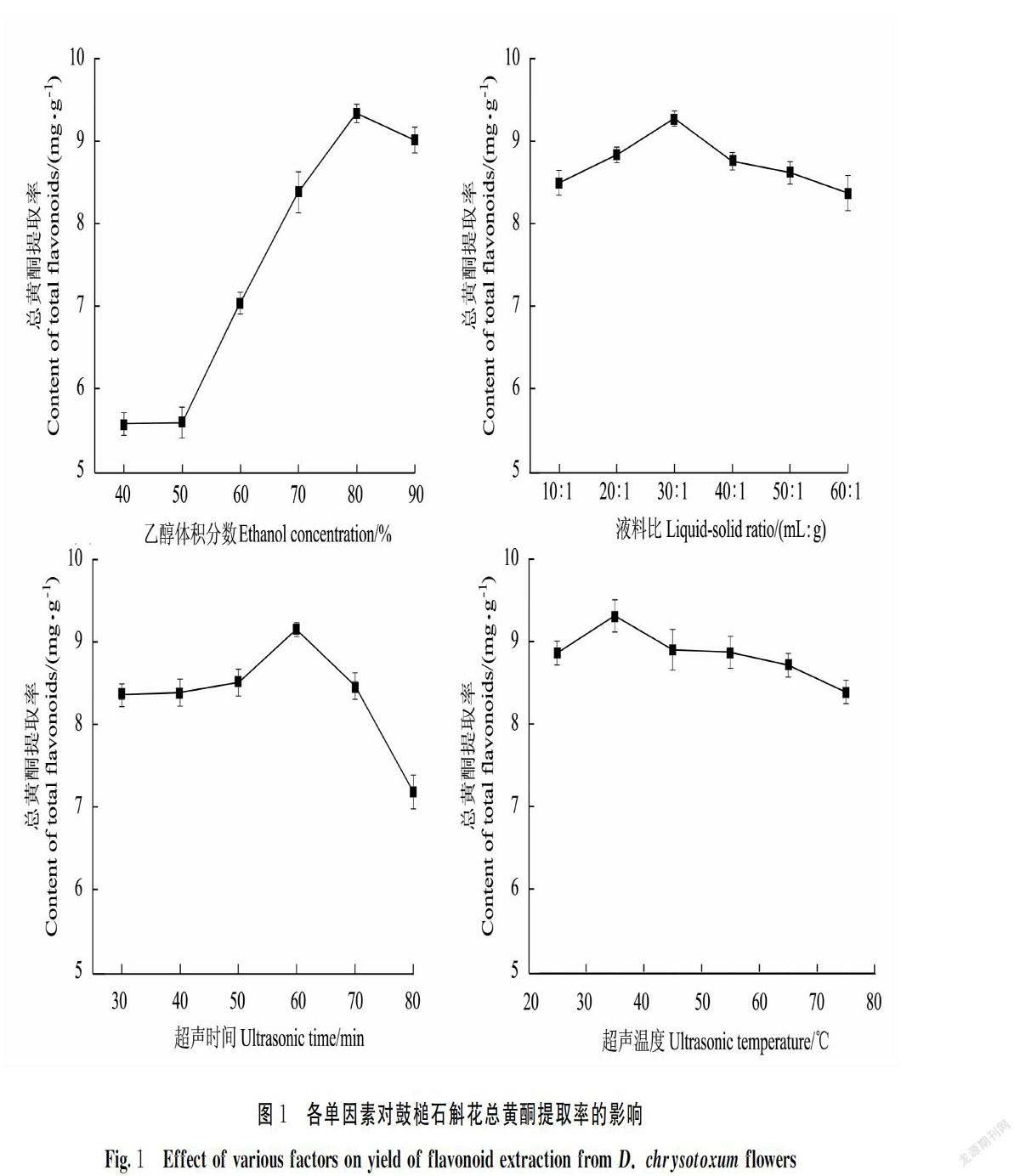
单因素对鼓槌石斛花总黄酮提取率的影响见图1。总黄酮提取率随乙醇体积分数、料液比、超声温度、超声时间变化呈现先增加后减小的趋势。当乙醇体积分数为80%时,总黄酮的提取率最高,为9.33 mg·g-1(P<0.05),因此将乙醇体积分数80%作为鼓槌石斛花总黄酮提取的最佳浓度;液料比为30∶1时提取率最高,为9.16 mg·g-1,因此将液料比30∶1作为鼓槌石斛花总黄酮提取的最佳液料比;温度为60℃时提取率最高,为9.15 mg·g-1;因此将温度60℃作为鼓槌石斛花总黄酮提取的最佳提取温度;超声时间为35 min时总黄酮的提取率最高,为9.34 mg·g-1,故选择超声时间为35 min为佳。
2.2 响应面试验结果
2.2.1 设计方案及结果
依据表1中的因素及水平,应用Design Expert 8.0.6软件,以鼓槌石斛花总黄酮提取率为响应值,根据Box-Benhnken 中心组合设计原理,以乙醇体积分数(A)、液料比(B)、超声温度(C)、超声时间(D)4因素3水平共29个试验点进行响应面分析试验(表2)。2.2.2 回归模型的建立及方差分析
利用Design Expert 8.0.6软件对表2试验数据进行多元回归拟合,得到鼓槌石斛花黄酮提取率(Y)与4个自变量之间四元二次回归模型:Y=-106.96+1.47A+0.36B+1.19C+0.666D+2.75×10-3AB-3.28×10-3AC-1.65×10-3AD+1.30×10-3BC-5.12×10-4BD-4.60×10-3CD-7.91×10-3A2-1.05×10-2B2-6.44×10-3C2-2.77×10-3D2。对表2的方差分析见表3。
由表3可知,模型(P<0.001)极显著,失拟度(P=0.119)不显著,说明该模型成立;相关系数R2=0.9227,说明鼓槌石斛花总黄酮提取率的实验值与预测值之间有较好的拟合度,该模型可描述92%以上的试验值;R2adj=0.8455,表明工艺对提取率的影响达到84.55%;变异系数(C.V. )4.15%<5%,表明该模型重现性较好。
从各因素F值、P值及显著性水平差异可知,对鼓槌石斛花总黄酮提取率的影响次序为:A>D>C>B。一次项A、C、D对响应值的结果达到了极显著水平;交互性CD对响应值的结果达到了显著水平;二次项A2、B2、C2对响应值的结果达到了极显著水平。各因素对响应值的结果影响比较复杂,不是简单的线性关系。
2.2.3 响应面分析
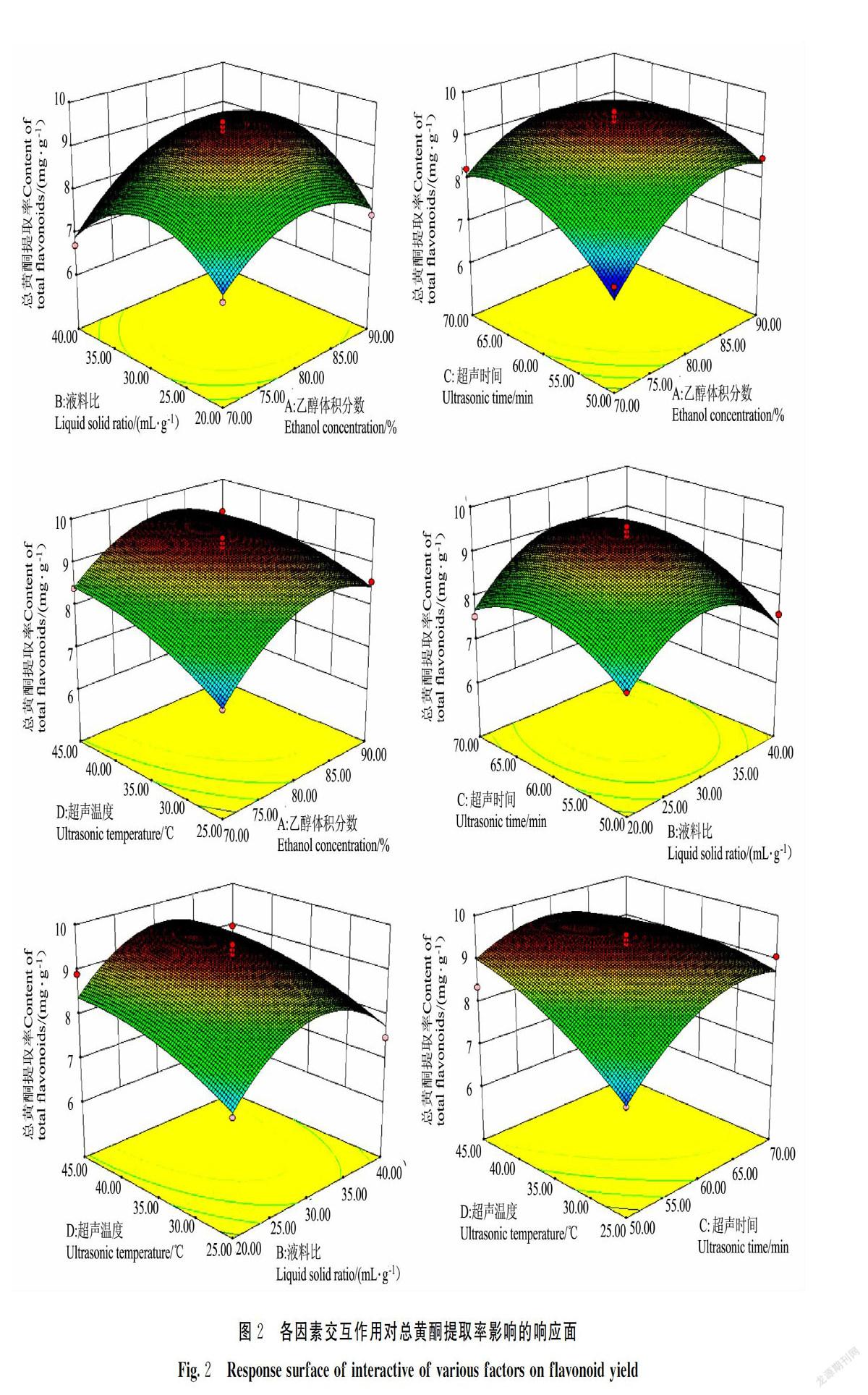
通过Design Expert 8.0.6绘制各因素间响应面(图2)。在试验范围内,总黄酮提取率随着提取乙醇体积分数增加先增大后减小,随着液料比增加先增大后下降,随超声温度增加先增大后减小,随超声时间增加先增大后减小。这与单因素试验分析时的结果相吻合。总黄酮提取率的变化速率:A>D>C>B,与方差分析统计结果相吻合。
2.2.4 最佳工艺条件确定及验证试验
采用响应面优化后的最佳工艺条件为:乙醇体积分数82.52%,液料比30.80 mL·g-1,超声温度58.98℃,超声时间43.65 min,理论提取率9.60 mg·g-1。为检验该模型与实际的复合程度,便于操作,设置乙醇体积分数83%,液料比31 mL·g-1,超声温度59℃,超声时间44 min,在此条件下,得到的实际提取率9.71 mg·g-1。与理论值相对误差为1.15%,说明优化结果可靠,可利用响应面对鼓槌石斛花总黄酮的提取工艺进行预测与分析。
2.3 体外抗氧化活性测定
2.3.1 DPPH自由基清除能力
由图3可知,在2.5~30.0 μg·mL-1范围内,鼓槌石斛花总黄酮、L-抗坏血酸及BHT对DPPH自由基的清除能力量效关系显著,随质量浓度的增加而升高;当质量浓度为30.0 μg·mL-1时,清除率分别为85.2%、93.1%、74.5%;其对羟自由基的IC50分别为11.3、5.8、16.1 μg·mL-1,提取液总黄酮羟自由基清除能力分别是L抗坏血酸的0.51倍、BHT的1.42倍。
2.3.2 羟自由基清除能力
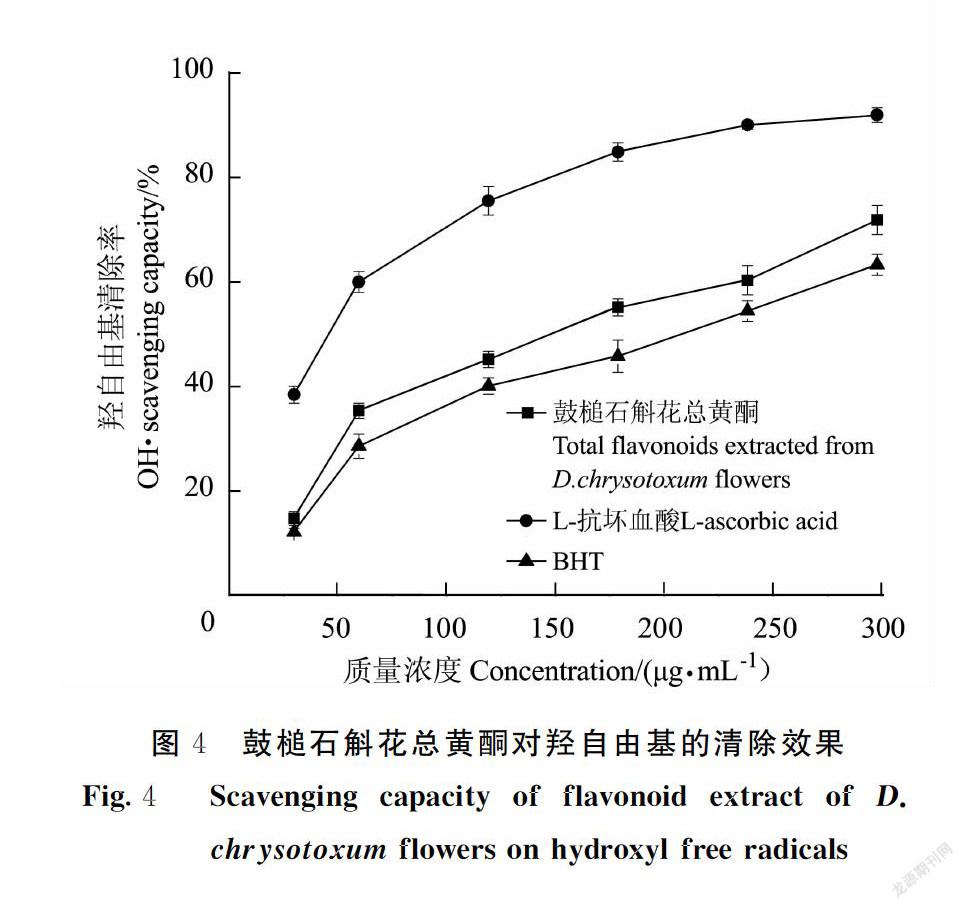
由图4可知,在25.0~300.0 μg·mL-1范围内,鼓槌石斛花总黄酮、L-抗坏血酸及BHT对羟自由基的清除能力量效关系显著,随质量浓度的增加而升高,当质量浓度为300.0 μg·mL-1时,清除率分别为72.1%、92.3%、63.5%、;其对羟自由基的IC50分别为137.3、44.2、185.8 μg·mL-1,提取液总黄酮清除羟自由基的能力分别是L抗坏血酸的0.70倍、BHT的1.95倍。
3 讨论与结论
黄酮类化合物的提取以醇法提取为主,本研究综合考虑环境因素及经济效益选取乙醇作为提取剂。乙醇溶液浓度与其极性呈负相关,当乙醇溶液与提取物质极性相同时,提取物析出量最大[24]。在乙醇溶液浓度增大过程中,溶液极性随浓度的增加而减小,与提取物极性接近时,其总黄酮提取率最高。本研究中鼓槌石斛花总黄酮提取的最佳乙醇体积分数为80%。在一定范围内,黄酮有效溶出率随溶剂增加而增加,随着溶剂的持续增加,杂质溶出亦增加,而有效溶出降低[25],鼓槌石斛花总黄酮提取的最佳液料比为30 mL·g-1。一定范围内温度升高可以加快黄酮溶出,但温度过高,黄酮结构易受破坏,同时杂质溶出率增加,导致其有效溶出降低[26],鼓槌石斛花总黄酮提取的最佳温度为60℃。在一定范围内,黄酮溶出随超声时间增加而增加,可能是超声有利于黄酮溶出,但超声时间过长,持续受热及杂质溶出增多,使黄酮有效提取率降低[27],鼓槌石斛花总黄酮超声提取的最佳提取时间为35 min。
在单因素试验的基础上,利用Design Expert 8.0.6软件,通过响应面法对超声辅助提取鼓槌石斛花总黄酮工艺进行了优化,建立了鼓槌石斛花总黄酮提取率的四元二次多项式回归模型,该回归模型拟合度高,重現性好,各工艺对总黄酮提取率的影响次序为:乙醇体积分数>超声时间>超声温度>液料比。其中,乙醇体积分数、超声温度及超声时间对鼓槌石斛花总黄酮提取率有极显著影响(P<0.01)。通过该模型得到的最佳工艺条件为:乙醇体积分数83%,液料比31 mL·g-1,超声温度59℃,超声时间44 min。在此条件下,鼓槌石斛花总黄酮含量为9.71 mg·g-1,与预测值相比,其相对误差为1.15%。与已报到的工艺未优化超声辅助提取(总黄酮提取率8.90 mg·g-1)、热回流提取法(总黄酮提取率2.70 mg·g-1)相比[9],总黄酮提取率明显提高,表明超声-加热辅助可提高鼓槌石斛花总黄酮提取率。
自由基与肿瘤及心血管疾病密切相关,近年来筛选天然抗氧化剂已逐渐成为医学、生物学、材料学、食品科学及药学等学科的研究热点[28]。介于体内实验费时费力,目前抗氧化活性筛选主要集中于体外模拟测定[29]。测定结果表明,鼓槌石斛花总黄酮对DPPH自由基及羟自由基具有一定的清除能力,且量效关系显著。其DPPH自由基清除能力是L抗坏血酸的0.51倍、BHT的1.42倍;羟自由基的清除能力是L抗坏血酸的0.70倍、BHT的1.95倍。该研究结果为鼓槌石斛活性物质的深入开发提供了一定的理论基础。
参考文献:
[1]肖春宏, 黄飞燕, 杨波. 鼓槌石斛研究进展[J]. 山西农业科学, 2014, 42(6): 647-649.
XIAO C H, HUANG F Y, YANG B. Study progress in Dendronbium chrysotoxum Lindl[J]. Journal of Shanxi Agricultural Sciences, 2014, 42(6): 647-649.(in Chinese)
[2]龚庆芳, 黄宁珍, 何金祥, 等. 不同光照强度对鼓槌石斛生长特性和化学成分的影响[J].北方园艺, 2015(23): 155-159.
GONG Q F, HUANG N Z, HE J X, et al. Effect of different light intensity on the growth characteristics and chemical constituents of Dendrobium chrysotoxum Lindl[J]. Northern Horticulture, 2015(23): 155-159.(in Chinese)
[3]唐德英, 马洁, 张丽霞, 等. 鼓槌石斛种质资源调查研究[J]. 中国中药杂志, 2010, 35(12): 1529-1532.
TANG D Y, MA J, ZHANG L X, et al. Research and investigation in germplasm resource of Dendrobium chrysotoxum[J]. China Journal of Chinese Materia Medica, 2010, 35(12): 1529-1532.(in Chinese)
[4]赵燕宜, 范志霞, 黄坤, 等. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2015: 282-283.
ZHAO Y Y, FAN Z X, HUANG K, et al. Pharmacopoeia of the people's republic of china(part I)[S]. Beijing: China Medical Science Press, 2015: 282-283.(in Chinese)
[5]MA G X, LEBlANC G A. The activity of erianin and chrysotoxine from Dendrobium chrysotoxum to reverse multidrug resistance in B16/h MDR-1 cells[J]. Journal of Chinese Pharmaceutical Sciences, 1998, 7: 142-146.
[6]PAN L H, WANG J, YE X Q, et al. Enzyme-assisted extraction of polysaccharides from Dendrobium chrysotoxum and its functional properties and immunomodulatory activity[J]. LWT-Food Science and Technology, 2015, 60(2): 1149-1154.
[7]余增洋, 盛雨辰, 周玲玉, 等. 鼓槌石斛對小鼠非增殖性糖尿病视网膜病变的改善作用及其机制研究[J]. 中草药, 2016, 47(11): 1908-1913.
YU Z Y, SHENG Y C, ZHOU L Y, et al. Study on amelioration of Dendrobium chrysotoxum on STZ-induced non-proliferative diabetic retinopathy and its engaged mechanism[J]. Chinese Traditional and Herbal Drugs, 2016, 47(11): 1908-1913.(in Chinese)
[8]文小玲, 王娅娟, 徐俊驹, 等. 云南鼓槌石斛提取物体外自由基清除活性研究[J]. 昆明医科大学学报, 2014, 35(12): 4-6.
WEN X L, WANG Y J, XU J J, et al. In vitro radical scavenging activity of extracts from Dendrobium chrysotoxum in Yunnan[J]. Journal of Kunming Medical University, 2014, 35(12): 4-6.(in Chinese)
[9]张冬英, 范黎明, 龚舒静, 等. 鼓槌石斛花总黄酮及挥发性成分研究[J]. 食品科技, 2014, 39(10): 198-202.
ZHANG D Y, FAN L M, GONG S J, et al. Total flavonoids and essential oil of Dendrobium chrysotoxum flower[J]. Food Science and Technology, 2014, 39(10): 198-202.(in Chinese)
[10]黄秀红, 王再花, 李杰, 等. 不同花期石斛花主要营养成分分析与品质比较[J]. 热带作物学报, 2017, 38(1): 45-52.
HUANG X H, WANG Z H, LI J, et al. Comparative analysis of quality properties and main nutrients in Dendrobium flowers during different flowering phases[J]. Chinese Journal of Tropical Crops, 2017, 38(01): 45-52.(in Chinese)
[11]王毅, 孙永玉, 李昆, 等. 一种鼓槌石斛花茶的制作方法: CN103689169A[P]. 2014-04-02.
WANG Y, SUN Y Y, LI K, et al. Dendrobium chrysotoxum Lindl. Flowers tea production method: CN103689169A[P]. 2014-04-02.(in Chinese)
[12]LI H, HAO Z, WANG X, et al. Antioxidant activities of extracts and fractions from Lysimachia foenum-graecum Hance[J]. Bioresource technology, 2009, 100(2): 970-974.
[13]赵美莲, 于春艳, 史晓晶. 水蜡树果实总黄酮提取工艺优化及其抗氧化活性[J]. 福建农业学报, 2018, 33(2): 206-211.
ZHAO M L, YU C Y, SHI X J, et al. Optimization and antioxidant activity of flavonoids extracted from fruits of Ligustrum obtusifolium[J]. Fujian Journal of Agricultural Sciences, 2018, 33(2): 206-211.(in Chinese)
[14]周锦业, 孙明艳, 邓杰玲, 等. 品种、干燥和贮存方式对铁皮石斛花氨基酸含量的影响[J]. 食品科技, 2019, 44(2): 88-93.
ZHOU J Y, SUN M Y, DENG J L, et al. Effects of different factors on the amino acid content of Dendrobium officinale flower[J]. Food Science and Technology, 2019, 44(2): 88-93.(in Chinese)
[15]梁凯伦, 方萍, 施秋秋, 等. 铁皮石斛花对高糖高脂饮酒致高血压大鼠的降压作用及机制研究[J]. 中国中药杂志, 2018, 43(1): 147-153.
LIANG K L, FANG P, SHI Q Q, et al. Antihypertensive effect and mechanism of Dendrobium officinale flos on high-blood pressure rats induced by high glucose and high fat compound alcohol[J]. China Journal of Chinese Materia Medica, 2018, 43(1): 147-153.(in Chinese)
[16]何曉艳, 吴人照, 龙华晴, 等. 铁皮石斛花对自发性高血压大鼠的降压作用及机制研究[J]. 中华中医药杂志, 2017, 32(4): 1836-1840.
HE X Y, WU R Z, LONG H Q, et al. Study on antihypertensive effect and mechanism of Dendrobium flowers in spontaneously hypertensive rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(4): 1836-1840.(in Chinese)
[17]张聪, 刘守金, 杨柳, 等. GC-MS法检测云南产细茎石斛花中挥发性成分[J]. 云南农业大学学报(自然科学), 2017, 32(1): 174-178.
ZHANG C, LIU S J, YANG L, et al. Determination of volatile components from flowers of Dendrobium moniliforme (L.) Sw in Yunnan by GC-MS[J]. Journal of Yunnan Agricultural University(Natural Science), 2017, 32(1):174-178.(in Chinese)
[18]李文静, 李进进, 李桂锋, 等. GC-MS分析4种石斛花挥发性成分[J]. 中药材, 2015, 38(4): 777-780.
LI W J, LI J J, LI G F, et al. Determination of volatile components from 4 Dendrobium flowers by GC-MS[J]. Journal of Chinese Medicinal Materials, 2015, 38(4): 777-780.(in Chinese)
[19]唐静月, 颜美秋, 齐芳芳, 等. 铁皮石斛花总黄酮提取工艺优化及体外抗氧化活性研究[J]. 浙江中医药大学学报, 2017, 41(3): 235-242.
TANG J Y, YAN M Y, QI F F,et al. Study on optimum extraction of total flavones in Dendrobium officinale flowers and its antioxidant activity in vitro[J]. Journal of Zhejiang Chinese Medical University, 2017, 41(3): 235-242.(in Chinese)
[20]缪园欣, 廖明星, 孙爱红, 等. 超声-乙醇法提取铁皮石斛花总黄酮及其体外抗氧化性的研究[J]. 中国酿造, 2019, 38(4): 155-159.
MIAO Y X, LIAO M X, SUN A H, et al. Extraction of total flavonoids from Dendrobium officinale flowers by ultrasonic-ethanol synergistic and its antioxidant activity[J]. China Brewing, 2019, 38(4): 155-159.(in Chinese)
[21]LAGUERRE M, HUGOUVIEUX V, CAVUSOGLU N, et al. Probing the micellar solubilisation and inter-micellar exchange of polyphenols using the DPPH free radical[J]. Food chemistry, 2014, 149: 114-120.
[22]符群, 吳桐, 王梦丽. 负压超声法提取刺玫果黄酮及其抗氧化性研究[J]. 现代食品科技, 2019, 35(1): 165-172.
FU Q, WU T, WANG M L. Study on extraction and antioxidant activity of flavonoids from Rosa davurica Pall. by negative pressure ultrasound[J]. Modern Food Science and Technology, 2019, 35(1): 165-172.(in Chinese)
[23]张黎明, 李瑞超, 郝利民, 等. 响应面优化玛咖叶总黄酮提取工艺及其抗氧化活性研究[J]. 现代食品科技, 2014, 30(4): 233-239.
ZHANG L M, LI R C, HAO L M, et al. Response surface methodology for optimization of extracting total flavonoids from Maca leaves and antioxidant evaluation[J]. Modern Food Science and Technology, 2014, 30(4): 233-239.(in Chinese)
[24]WANG Y, GAO Y, DING H, et al. Subcritical ethanol extraction of flavonoids from Moringa oleifera leaf and evaluation of antioxidant activity[J]. Food chemistry, 2017, 218: 152-158.
[25]李加兴, 陈选, 邓佳琴, 等. 黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J]. 食品科学, 2014, 35(10): 121-125.
LI J X, CHEN X, DENG J Q, et al. Extraction and antioxidant activity in vitro of Okra flavonoids[J]. Food Science, 2014, 35(10): 121-125.(in Chinese)
[26]磨正遵, 商飞飞, 潘中田, 等. 响应面法优化超声波辅助提取广西大果山楂叶黄酮工艺[J]. 南方农业学报, 2018, 49(5): 986-992.
MO Z Z, SHANG F F, PAN Z T, et al. Optimization of ultrasonic-assisted extraction of flavonoids from Guangxi big fruit hawthorn leaves by response surface methodology[J]. Journal of Southern Agriculture, 2018, 49(5): 986-992.(in Chinese)
[27]WANG Y, CHEN P, TANG C, et al. Antinociceptive and anti-inflammatory activities of extract and two isolated flavonoids of Carthamus tinctorius L[J]. Journal of ethnopharmacology, 2014, 151(2): 944-950.
[28]LI J, LIU Y, FAN L, et al. Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus Jujuba cv. Jinsixiaozao[J]. Carbohydrate Polymers, 2011, 84(1): 390-394.
[29]熊双丽, 卢飞, 史敏娟, 等. DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J]. 食品工业科技, 2012, 33(8): 380-383.
XIONG S L, LU F, SHI M J, et al. Advanement of evaluation methods about DPPH radical scavenging activity in Screening Antioxidant[J]. Food Science, 2012, 33(8): 380-383.(in Chinese)
(责任编辑:黄爱萍)
