自毒胁迫下外源硅对甜瓜幼苗生长和叶绿素荧光的影响
2019-09-10樊佳茹章丽珍王景荣张贝贝GefuWang-Pruski张志忠
樊佳茹 章丽珍 王景荣 张贝贝 GefuWang-Pruski 张志忠


摘 要:【目的】通过筛选可以有效缓解甜瓜幼苗自毒胁迫的硅酸钠浓度,对不同处理条件下幼苗生长指标和叶绿素荧光参数的变化进行测定,初步明确外源硅缓解甜瓜自毒胁迫的形态学和光合基础,以期为克服甜瓜连作障碍提供有益参考。【方法】以甜瓜2叶1心幼苗为材料,利用质量浓度为0.03 g·mL-1的植株浸提液模拟自毒胁迫,分别添加不同浓度硅酸钠(0、1、2、4、8、16 、32 mmol·L-1)溶液进行复合处理;通过观测幼苗生长状态,测量株高、根长、鲜重、茎粗及根系表面积等形态学指标,筛选出能有效缓解自毒胁迫的硅酸钠浓度。采用筛选出的最佳硅酸钠浓度处理自毒胁迫条件下的甜瓜幼苗,于不同取样时间点测定幼苗株高、叶面积、鲜重、地上部分干重和叶绿素荧光特征,分析这一缓解作用的形态学和光合基础。【结果】4 mmol·L-1的硅酸钠可以有效缓解甜瓜幼苗的自毒胁迫。自毒胁迫显著抑制了幼苗株高,减少了叶面积,Fv′/Fm′、Y(II)、qP和Y(NPQ)值均表现出不同程度的下降,NPQ和Y(NO)有所升高。添加硅酸钠可以明显缓解自毒胁迫对幼苗生长的影响,Fv’/Fm’、Y(Ⅱ)、NPQ、qP、Y(NPQ)和Y(NO)等参数接近或优于对照。【结论】适当浓度的外源硅处理可以改善自毒胁迫条件下甜瓜幼苗的生长状态,在一定程度上维持叶片光合系统的稳定,进而提高甜瓜植株对自毒胁迫的抵抗能力。
关键词:甜瓜;硅;自毒作用;叶绿素荧光
中图分类号:S 652文献标识码:A文章编号:1008-0384(2019)06-638-08
Abstract: 【Objective】To determine the sodium silicate concentration that could effectively mitigate the autotoxicity stress, which is one of the main factors causing difficulties on continuous cropping and seriously economic loss, on melon farming. 【Method】 Seedlings of Cucumis melo L. with two true leaves and one bud were used in this study. The 0.03 g·mL-1 water extract of the plant was used to simulate the autotoxicity stress. Sodium silicate solutions at different concentrations (0, 1, 2, 4, 8, 16 and 32 mmol·L-1) were added as treatments to determine the effectiveness in the stress alleviation through observations on the growth, plant height, root length, fresh weight, dry weight of shoot, stem diameter, and root surface area of the seedlings. Changes on chlorophyll fluorescence parameters of the seedlings were monitored as well for the analysis. 【Result】 The imposed autotoxicity significantly inhibited the increases on seedling height and leaf area. In varying degrees, the Fv'/Fm', Y (II), qP, and Y (NPQ) of the plants decreased, while NPQ and Y (NO) increased. However, the presence of sodium silicate at 4mM effectively reduced the stress with the Fv'/Fm', Y (II), NPQ, qP, Y (NPQ), and Y (NO) as they became closer to or better than those of control. 【Conclusion】 Appropriate exogenous silicon treatment appeared to enable the melon seedlings under autotoxicity stress to grow normally with a stable photosynthetic function.
Key words: melon (Cucumis melo L.); silicon; autotoxicity; chlorophyll fluorescence
0 引言
【研究意義】植物可以通过地上部分淋溶,根系分泌物和植株残茬分解等途径来释放一些物质对同茬或下茬同种及同科植物的生长产生抑制作用,这种现象被称为自毒作用[1]。甜瓜Cucumis melo L.是重要的园艺植物,营养丰富,经济价值较高,在全世界均有广泛的种植。近年来,包括甜瓜在内的园艺作物生产基地化和设施化比例不断提高,栽培制度和栽培环境的改变使得连作障碍已成为制约甜瓜等园艺作物生产可持续发展的重大问题[2]。外源硅作为可以增强植物抗逆性的有益添加物,近年来对其应用的研究广受重视,但在甜瓜自毒胁迫方面尚未见报道,分析外源硅处理对自毒胁迫下甜瓜幼苗的生长特性及叶绿素荧光的影响,可以为克服甜瓜连作障碍提供有益的参考。【前人研究进展】外源物质在缓解旱涝[3]、寒冷[4]、高温[5]等逆境对植物造成的伤害方面具有广泛的应用价值,其中硅元素作为植物生长发育的有益元素[6-7],在促进植物生长,提高植物抗逆性等方面得到广泛关注[8],如外源硅对于盐胁迫下葡萄幼苗植株[9]、自毒胁迫下黄瓜[10]幼苗及NaCl胁迫下番茄幼苗[11]等的抗逆性都起到了较为明显的增强效应,缓解胁迫对植物光系统PSI和PSII的伤害,增强根系活力,提高叶绿素含量和光合速率,并可显著增强植物叶片光合器官性能和光合作用质子驱动力,促进同化产物的积累,提高干物质积累量。这种缓解或增强效应在大田作物中也广泛存在,如外源硅对水稻[12]、小麦[13]等作物遭受胁迫时的生长及光合作用也会产生积极影响。【本研究切入点】植物叶绿素荧光信号能快速有效地反映植物自身的生理状态,当植物遭受胁迫时,光合效率会下降,光合色素、PSII光化学反应、叶绿体超微结构以及光合电子传递等方面受到抑制或损伤[14-16],从而引起植物生长受到抑制,干物质积累也会受到影响,会对植物后期生长的产量和品质产生直接影响[17]。目前,已有研究显示硅对黄瓜[10]、番茄[11]、水稻[12]等多种植物的生长特性及叶绿素荧光特性会产生积极影响。但尚未见关于外源硅对甜瓜自毒胁迫影响的报道。【拟解决的关键问题】本试验通过植株浸提液处理模拟甜瓜自毒胁迫,研究硅酸钠对自毒胁迫下甜瓜幼苗的生长特性和叶绿素荧光特性的影响,筛选可以有效缓解自毒胁迫的硅酸钠浓度,并分析这种缓解作用的形态学和光合基础,为甜瓜抗逆栽培提供参考。
1 材料与方法
1.1 试验材料与处理方法
植物材料:甜瓜品种新银辉,购于福建省农嘉种业股份有限公司。
植株浸提液制备:挑选均匀饱满的甜瓜种子置于铺有珍珠岩的培养皿中,于28℃ 人工气候箱中进行浸种催芽,种子露白1 cm左右后种植于营养钵中,待甜瓜植株生长至5~6片真叶时从中挑选健康新鲜的植株,清洗干净后将其剪成小段放于托盘中于黑暗的烘箱(60℃)48 h之后取出将其用研钵磨成粉末,每4 g样品加入100 mL蒸馏水中,置于温度为28℃,速度为200 r·min-1的恒温振荡箱中振荡浸提48 h后取出,用双层纱布过滤1次,之后用双层滤纸过滤2 次,再用 0.2 μm 孔径 47 mm 直径的微孔滤膜(Supor-200)过滤1次,最后用无菌双蒸水定容,制得0.04 g·mL-1的甜瓜植株浸提液母液,于4℃ 冰箱中保存。使用前取出先将母液放置于实验室一段时间,使其自然冷却至室温,以免骤冷对蔬菜种子、幼苗造成伤害。
硅酸钠浓度筛选:硅酸钠(Na2SiO3)设置0、1、2、4、8、16、32 mmol·L-1,共7个浓度梯度,分别将不同浓度硅酸钠溶液与0.04 g·mL-1甜瓜植株浸提液以1∶3的比例混合,混合液中植株浸提液的质量浓度为0.03 g·mL-1,作为复合处理液,4℃保存备用。挑选均匀饱满的甜瓜种子置于铺有3张无菌滤纸的培养皿中进行催芽,滤纸事先用10 mL蒸馏水充分浸透,置于人工气候箱中28℃黑暗条件培养,每天观测种子发芽情况,待80%的种子露白后播于装有营养土∶珍珠岩∶蛭石(3∶1∶1)的塑料盆中,到第2片真叶露尖后挑选长势一致的健壮幼苗用40 mL不同浓度的硅酸钠进行灌根处理,常温条件下继续培养。处理96 h后对幼苗株高、根长和鲜重等指标进行测定,筛选出可以有效缓解甜瓜自毒胁迫的外源硅处理浓度,筛选结果为4 mmol·L-1。
硅处理对甜瓜幼苗形态的影响:在前期筛选出硅酸钠处理浓度的基础上,设置4组处理:蒸馏水、植株浸提液0.03 g·mL-1(前期研究发现此浓度可对甜瓜幼苗生长产生明显自毒抑制,但不會致死[18-19];超过这一浓度可能产生渗透胁迫,影响试验准确性[20])、植株浸提液+4 mmol·L-1硅酸钠和4 mmol·L-1硅酸钠,培养方法同前述浓度筛选,测定其0、12、24、48和96 h的生长情况。
硅处理对甜瓜幼苗叶绿素荧光特性的影响:处理培养方法同上,分别于0、12、24、48和96 h采用叶绿素荧光仪测定第2片完全展开功能叶(由根部到植株顶部)的荧光参数:Fv′/Fm′、Y(Ⅱ)、NPQ、qP、Y(NPQ)、Y(NO)。
上述所有试验均设置3组独立重复。
1.2 测定方法
1.2.1 形态学指标 株高用直尺量取从根茎交接处到顶叶叶柄基部,并拍照记录;根长用直尺进行测定;鲜重用电子秤直接测定;茎粗利用普通游标卡尺测定;干物重将植株置于烘箱(80℃)烘至恒重之后测定;叶面积测定扫描仪为Epson perfection 4990 PHOTO;根系表面积测定利用扫描仪Epson perfection 4990 PHOTO完成。
1.2.2 叶绿素荧光参数 利用IMAGING-PAM叶绿素荧光成像系统对活体甜瓜幼苗叶片的叶绿素荧光进行测定。每棵植株均以第2片真叶(由根部到植株顶部)为测量对象,测量前进行30 min的暗适应。叶绿素荧光参数主要包括:光适应条件下(PSⅡ)最大光化学效率(Fv′/Fm′)、PSⅡ的实际光化学效率[Y(II)]、非光化学淬灭(NPQ)、光化学淬灭(qP)、非调节性能量耗散的量子产量[Y(NO)]、调节性能量耗散的量子产量[Y(NPQ)]。
1.3 数据处理
数据采用WPS Excel统计分析软件进行处理,用SPSS 17.0软件进行方差分析,以单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)分析,数据表示为(±SE)。
2 结果与分析
2.1 不同浓度硅酸钠处理对自毒胁迫下甜瓜幼苗生长的影响
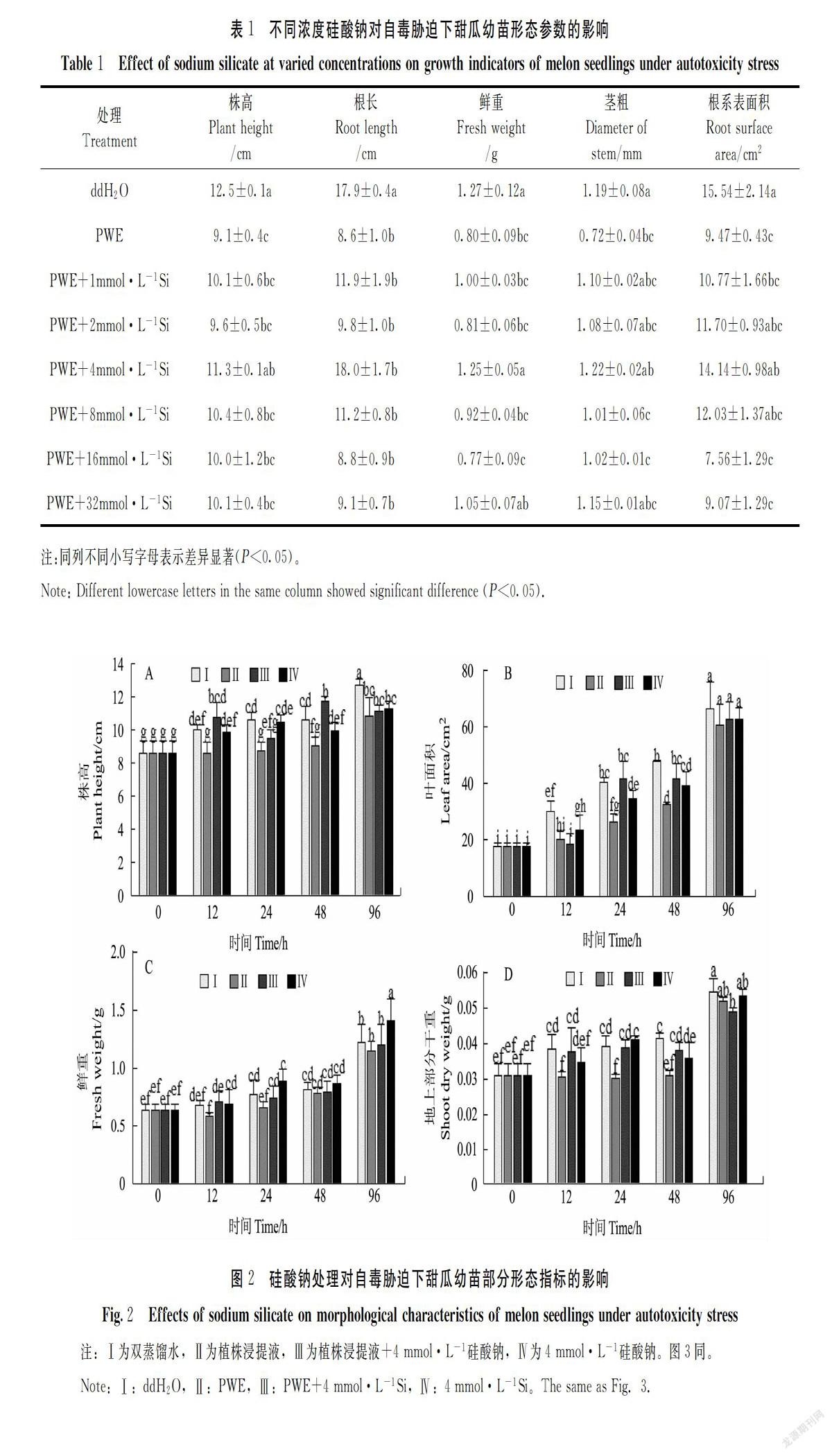
植株浸提液处理抑制了甜瓜幼苗生长,生物量积累缓慢,叶片出现一定程度的黄化现象(图1)。添加不同浓度的硅酸钠后植株浸提液的抑制作用得到一定程度缓解(表1),其中4 mmol·L-1硅酸钠处理对根系生长的促进作用最为明显,较空白对照高109.3%,1 mmol·L-1硅酸钠也有一定效果,较对照高38.37%,这一处理浓度条件下株高增加了24.18%。8 mmol·L-1的硅酸钠也有助于自毒胁迫下株高的增长。对于鲜重而言,硅酸钠缓解自毒胁迫的效果由强到弱依次为4 mmol·L-1>32 mmol·L-1>1 mmol·L-1>8 mmol·L-1>2 mmol·L-1>16 mmol·L-1。自毒胁迫下对茎粗的缓解有效浓度依次是4 mmol·L-1>32 mmol·L-1>1 mmol·L-1>2 mmol·L-1>16 mmol·L-1>8 mmol·L-1。总体而言,当硅酸钠浓度超过4 mmol·L-1后随浓度升高对自毒胁迫的缓解作用会逐渐减弱,后续试验采用硅酸钠处理浓度均为4 mmol·L-1。
与蒸馏水处理相比较,植株浸提液处理的甜瓜幼苗植株矮小(图2-A)、叶面积变小(图2-B)、鲜重(图2-C)及地上部干重(图2-D)也受到了限制,株高分别比对照低12.12%、16.98%、14.81%、12.8%;叶面积在处理12 h后抑制作用最强烈;处理24 h时鲜重减少了16.03%;地上部干重抑制率达到28.42%。与植株浸提液处理相比,添加4 mmol·L-1硅酸钠后甜瓜幼苗株高和叶面积均有所增加。其中4 mmol·L-1硅酸钠对自毒胁迫下甜瓜幼苗株高的促进作用在96 h时最为明显。鲜重则是在硅酸钠处理24 h时后相较对照增幅最大,这一测定点也是地上部干重和对照最大的差异点,4 mmol·L-1硅酸钠处理较对照高出29.63%。同时试验发现没有自毒胁迫的情况下,4 mmol·L-1硅酸钠处理对甜瓜的幼苗生长也具有一定的促进作用(图1~2)。
2.2 硅酸钠对自毒胁迫下甜瓜幼苗叶绿素荧光特性的影响
自毒胁迫导致甜瓜幼苗叶片在光适应条件下PSⅡ最大光化学效率Fv′/Fm′(图3-A)和PSⅡ的实际光化学效率Y(Ⅱ)(图3-B)降低(图3-A~B)。与蒸馏水处理相比,植株浸提液处理抑制了甜瓜植株叶片的Fv′/Fm′值,各个取样测定点的抑制率分别为5.65%、0.94%、9.16%和10.51%,表示实际光化学效率的Y(Ⅱ)值同样在自毒胁迫后大幅下降,二者均在处理96 h降幅达到最大值。添加外源硅缓解了Fv′/Fm′和Y(Ⅱ)的下降,48 h时 Fv′/Fm′值高出植株浸提液处理的植株19.89%,Y(Ⅱ)值则高出自毒胁迫植株76.29%。
自毒胁迫导致甜瓜叶片光化学淬灭qP(图3-C)相比蒸馏水对照在不同取样点分别减少了37.21%、26.06%、11.01%和52.52%,非光化学淬灭NPQ与光化学淬灭系数qP呈现相反的变化趋势(图3-D)。自毒胁迫条件下添加硅酸钠处理的植株qP值在一定程度上下降了,NPQ值相应增加,其变化趋势和蒸馏水培养的对照基本一致。甜瓜幼苗叶片的非调节性耗散的量子产额Y(NO)(图3-E)在自毒胁迫下表现始终较高,48 h时增加了30.05%,为所有测定点最高值。调节性耗散的量子产额Y(NPQ)在自毒胁迫24 h时高于蒸馏水对照(图3-F),其他测定点均低于对照。添加硅酸钠之后明显缓解了自毒胁迫对Y(NO)的影响,96 h时的测定值较胁迫株低34.98%;与之对应的叶片Y(NPQ)值增加了。单独硅酸钠处理的变化趋势与蒸馏水对照趋于一致。
3 讨论与结论
植物受到胁迫时会影响幼苗生长与能量代谢,抑制幼苗株高、根长、鲜干重和叶面积等各项生长指标[21-22]。本试验中植株浸提液模拟的自毒胁迫对甜瓜幼苗的正常生长表现出明显抑制作用,其株高降低,根长变短,鲜重和干重相较对照明显下降;叶面积、根系表面积大幅下降。这些结果和自毒胁迫下的黄瓜[10]表现一致。番茄受到干旱胁迫[16]时也有类似表现,说明植物应对胁迫有一定的通用机制。硅能促进胁迫条件下幼苗的生长,改善植物生长状况,提高植物对逆境胁迫的抗性[5-9]。本试验中4 mmol·L-1硅酸钠可以有效缓解自毒对于甜瓜幼苗的抑制,幼苗株高、叶面积、鲜重及地上部干重等形态指标有明显改善,这与外源硅缓解低温胁迫下的水稻[12]、受到干旱胁迫的野生酸枣[17]及盐胁迫下的甘草幼苗[23]等的研究结果一致。
叶绿素荧光是光合作用研究的探针,能够反映植物自身的生理状态[14]。PSⅡ有效光化学量子产量Fv′/Fm′反映开放的PSII反应中心原初光能捕获效率[24]。Y(Ⅱ)则反映叶片的实际光化学效率,即光下植物叶片用于电子传递的能量占所捕获光能的比例[24-25]。与对照相比,自毒胁迫对甜瓜叶片Fv′/Fm′和Y(Ⅱ)产生了抑制作用,即抑制了PSII反应中心捕获光能的效率,对叶片进行电子传递的能量产生了负面影响,添加外源硅使得Fv′/Fm′和Y(Ⅱ)下降,降低了自毒作用对光合系统的损伤,在生菜[26]、长春花[27]和葡萄[9]中的研究也有类似的结论。
光化学淬灭qP在一定程度上反映了PSⅡ反映中心的开放程度,使PSⅡ反应中心处于“开放状态”才会保持高的光化学淬灭。qP与PSⅡ光化学电子传递的份额有关,因此qP愈大,PSⅡ的电子传递活性愈大[25]。当受到自毒胁迫时,甜瓜叶片的qP相比蒸馏水处理在每个时间段都有所抑制,说明从PSⅡ氧化侧向PSⅡ反应中心的电子流动受到抑制。甘蔗[29]、长春花幼苗[27]在受到逆境胁迫时有类似的变化。非光化学淬灭NPQ表示的是植物耗散过剩光能为热的能力,不能及时耗散必定会对植物的光合机构造成破坏[24-25]。自毒胁迫显著影响了甜瓜叶片NPQ,光合机构受损,抑制了PSII和PSI的电子传递,这与葡萄[7]相关研究中的结论一致。叶绿素荧光产量的下降(淬灭)有可能是由光合作用的增加或热耗散的增加引起的,自毒胁迫下叶片吸收的光能主要以热耗散形式消耗,加入硅酸钠后,叶片吸收的光能被用来进行碳固定的能量显著增加,而用来热耗散的相应减少,增加自毒作用下甜瓜叶片的光合效率,对甜瓜幼苗起到了一定的保护作用。
非调节性耗散的量子产额Y(NO)表示光系统Ⅱ吸收的激发能,被动的耗散为热量和发出荧光的那部分能量,主要由关闭态的光系统Ⅱ反应中心贡献[25]。自毒胁迫时甜瓜叶片的Y(NO)始终高于其他处理的值,水稻[12]和番茄[11]在遭遇胁迫时也有类似反应。这一结果显示甜瓜幼苗光量转换和自我保护调节机制较弱,自毒胁迫时甜瓜幼苗无法很好地消散过多的光能。外源硅处理降低Y(NO)值,提高了甜瓜叶片的光量转换和自我保护能力。调节性耗散的量子产额Y(NPQ)指的是光系统Ⅱ吸收的激发能,通过调节性的光保护机制耗散为热的那部分能量[24-25]。12~24 h 时Y(NPQ)值在对照和处理间没有显著差异,48~96 h时经过自毒胁迫处理的Y(NPQ)明显降低,外源硅的添加改变了这一趋势。这与部分类似研究[29-30]的结果不一致,这可能与植物品种差异有关。处理前期甜瓜幼苗Y(NPQ)没有明显变化,可能是幼苗应对胁迫的反应机制启动滞后所致,后期硅酸钠的加入激活了调节机制,使其耗散过剩光能的能力增强,强化了自我保护功能。外源硅处理对Y(NO)和Y(NPQ)的缓解效应,提高了PSII的实际光化学效率Y(Ⅱ)。
硅酸钠对甜瓜自毒胁迫的缓解具有浓度效应,4 mmol·L-1的浓度对缓解甜瓜幼苗自毒胁迫的效果较为理想,幼苗株高、根长、鲜重、茎粗等各项形态学指标接近甚至优于对照。叶绿素荧光参数的变化显示自毒胁迫损害了甜瓜幼苗的光合能力,添加硅酸钠提高了自毒胁迫下叶绿素荧光参数Fv′/Fm′、Y(II)、qP和Y(NPQ)的值,减弱了NPQ和Y(NO)的值,维持了正常的光合作用。试验结果显示,外源硅處理可以明显改善自毒胁迫下甜瓜幼苗的生长和光合能力,缓解自毒胁迫的伤害。
参考文献:
[1]KATO-NOGUCHI H, NAKAMURA K, OKUDA N. Involvement of an autotoxic compound in asparagus decline[J]. Journal of Plant Physiology, 2018, 224: 49-55.[2]
徐小军, 张桂兰, 周亚峰, 等. 甜瓜设施栽培连作土壤的理化性质及生物活性[J]. 果树学报, 2016, 33(9): 1131-1138.
XU X J, ZHANG G L, ZHOU Y F, et al. Studies on the physical-chemical and biological properties of soils cropped continuously with melon under protected cultivation condition[J]. Journal of Fruit Science, 2016, 33(9): 1131-1138. (in Chinese)[3]
SARUHAN N, SAGLAM A, KADIOGLU A. Salicylic acid pretreatment induces drought tolerance and delays leaf rolling by inducing antioxidant systems in maize genotypes[J]. Acta Physiologiae Plantarum, 2012, 34(1): 97-106.[4]
FAROOQ M, AZIZ T, BASRA S M A, et al. Chilling tolerance in hybrid maize induced by seed priming with salicylic acid[J]. Journal of Agronomy and Crop Science, 2008, 194(2): 161-168.[5]
TALANOVA V V, TOPCHIEVA L V, TITOV A F. Effect of abscisic acid on the resistance of cucumber seedlings to combined exposure to high temperature and chloride[J]. Biology Bulletin, 2006, 33(6): 619-622.[6]
NEUMANN D, ZUR N U. Silicon and heavy metal tolerance of higher plants[J]. Phytochemistry, 2001, 56(7): 685-692.[7]
BAKHAT H F, BIBI N, ZIA Z, et al. Silicon mitigates biotic stresses in crop plants: a review[J]. Crop Protection, 2018, 104:21-34.[8]
YAN G, NIKOLIC M, YE M, et al. Silicon acquisition and accumulation in plant and its significance for agriculture[J]. Journal of Integrative Agriculture, 2018, 17(10): 2138-2150.[9]
雷玉娟. 外源硅對盐胁迫下赤霞珠葡萄幼苗的影响[D]. 杨凌:西北农林科技大学, 2008.
LEI Y J. The influence of silicon on cabernet sauvignon seedling under salt stress[D]. Yangling: Northwest Agriculture & Forestry University, 2008. (in Chinese)[10]
BU R, XIAO X, LIAO W, et al. Exogenous Si alleviation of autotoxicity in Cucumber (Cucumis sativus L.) seed germination is correlated with changes in carbohydrate metabolism[J]. Journal of Plant Growth Regulation, 2018:1-10
[11] 吴雪霞, 于力, 朱为民. 外源一氧化氮对NaCl胁迫下番茄幼苗叶绿素荧光特性的影响[J]. 中国生态农业学报, 2009, 17(4): 746-751.
WU X X, YU L, ZHU W M. Effect of exogenous nitric oxide on chlorophyll fluorescence characteristics in tomato seedlings under NaCl stress[J]. Chinese Journal of Eco-Agriculture, 2009, 17(4): 746-751. (in Chinese)[12]
陈海燕. 外源硅对低温胁迫下苗期水稻生理生化特性的影响[D]. 哈尔滨:东北农业大学, 2018.
CHEN H Y. Effects of exogenous silicon on physiological and biochemical characteristics of rice under low temperature stress at seedling stage[D]. Harbin: Northeast Agricultural University, 2018. (in Chinese)[13]
郑世英, 郑芳, 徐建, 等. 外源硅对NaCl胁迫下小麦幼苗生长及光合特性的影响[J]. 麦类作物学报, 2015, 35(1): 111-115.
ZHENG S Y, ZHENG F, XU J, et al.Effect of silicon on the biomass and photosynthetic characteristics of wheat seedling under NaCl stress[J].Journal of Triticeae Crops, 2015, 35(1): 111-115. (in Chinese)[14]
李鹏民. 快速叶绿素荧光诱导动力学在植物逆境生理研究中的应用[D]. 泰安:山东农业大学, 2007.
LI P M. Application of chlorophyll a fluorescence transient in study of plant physiology under stress conditions[D]. Tai′an: Shandong Agricultural University, 2007. (in Chinese)[15] 高昆, 張明阳. 干旱胁迫对番茄种子萌发和幼苗生长的影响[J]. 山西大同大学学报(自然科学版), 2017, 33(6): 56-59.
GAO K, ZHANG M Y. Effects of drought stress simulated by PEG-6000 on seed germination characters and seedling growth of lycopersicon esculentum[J]. Journal of Shanxi Datong University (Natural Science Edition), 2017, 33(6): 56-59. (in Chinese)[16]
杨锐, 郎莹, 张光灿, 等. 野生酸枣光合及叶绿素荧光参数对土壤干旱胁迫的响应[J]. 西北植物学报, 2018, 38(5): 922-931.
YANG R, LANG Y, ZHANG G C, et al. Responses of photosynthesis and fluorescence of ziziphus jujuba var. spinosato soil drought stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(5): 922-931. (in Chinese)[17]
MAXWELL K, JOHNSON G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany, 2000, 51(345): 659-668.[18]孙志浩. 甜瓜化感自毒作用研究[D].福州:福建农林大学,2012.
SUN Z H. Study on allelopathic autotoxicity of melon[D].Fuzhou: Fujian Agriculture and Forestry University, 2012. (in Chinese)[19] 高强. 甜瓜化感作用生理生化机制及主要化感物质的鉴定[D]. 福州:福建农林大学,2014.
GAO Q. Physiological and biochemical mechanism of melon allelopathy and identification of main allelochemicals[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014. (in Chinese)
[20]耿广东. 辣椒(Capsicum annuum L.)化感作用及其机理研究[D].杨凌:西北农林科技大学,2005.
GENG G D.Research on allelopathy and its mechanism in hot pepper[D]. Yangling: Northwest Agriculture & Forestry University, 2005. (in Chinese)
[21]王财丽, 边琦, 李婷婷, 等. 外源Si对NaCl胁迫下肥皂草种子萌发及幼苗生长的影响[J].东北林业大学学报, 2016, 44(11): 41-44.
WANG C L, BIAN Q, LI T T, et al. Effects of exogenous silicon on soapwort seed germination and growth of seedlings under NaCl stress[J]. Journal of Northeast Forestry University, 2016, 44(11): 41-44. (in Chinese)
[22]REN Y F, HE J Y. Effects of NaCl stress on growth and photosynthetic characteristics of Lettuce (Lactuca sativa L.) Seedlings[J]. Acta Agriculturae Boreali-Sinica, 2008, 23(4): 149-153.
[23]张新慧, 郎多勇, 白长财, 等. 外源硅对不同程度盐胁迫下甘草种子萌发和幼苗生长发育的影响[J]. 中草药, 2014, 45(14): 2075-2079.
ZHANG X H, LANG D Y, BAI Z C, et al. Effects of silicon on seed germination and seedling growth of Glvarrhiza uralensis under salt stress[J]. Chinese Traditional and Herbal Drugs, 2014, 45(14): 2075-2079. (in Chinese)
[24]尤鑫, 龚吉蕊. 叶绿素荧光动力学参数的意义及实例辨析[J]. 西部林业科学, 2012, 41(5): 90-94.
YOU X, GONG J R. Significance and application of chlorophyll fluorescence dynamics process parameters [J]. Journal of West China Forestry Science, 2012, 41(5): 90-94. (in Chinese)
[25]TAN D X, REITER R J, MANCHESTER L C, et al. Chemical and physical properties and potential mechanisms: melatonin as a broad spectrum antioxidant and free radical scavenger[J]. Current Topics in Medicinal Chemistry, 2002, 2(2): 181-197.
[26]FU W, LI P, WU Y. Effects of different light intensities on chlorophyll fluorescence characteristics and yield in lettuce[J]. Scientia Horticulturae, 2012, 135: 45-51.
[27]胡凡波, 刘玲, 隆小华, 等. 外源NO对NaCl胁迫下长春花幼苗生物量和叶绿素荧光的影响[J]. 生态学杂志, 2011, 30(8): 1620-1626.
HU F B, LIU L, LONG X H, et al. Effects of silicon nitric oxide on biomass and chlorophyll fluorescence of Catharanthus roseus seedling under under NaCl stress[J]. Chinese Journal of Ecology, 2011, 30(8): 1620-1626. (in Chinese)
[28]李长宁, 农倩, 李杨瑞. 水分胁迫下外源ABA提高甘蔗抗旱性的作用机制[J].作物学报, 2010, 36(5):863-870.
LI C N, NONG Q, LI Y R. Mechanism of tolerance to drought in sugarcane plant enhanced by foliage dressing of abscisic acid under water stress[J]. Acta Agronomica Sinica, 2010, 36(5):863-870. (in Chinese)
[29]陈罡, 樊平声, 冯伟民, 等. 外源硅对盐胁迫下黄瓜幼苗生长和光合荧光特性的影响[J].江苏农业学报, 2014, 30(6):1402-1409.
CHEN G, FAN P S, FENG W M, et al.Effects of exogenous silicon on growth and chlorophyll fluorescence in cucumber seedling under salt stress[J].Jiangsu Journal of Agricultural Sciences, 2014, 30(6):1402-1409. (in Chinese)
[30]WANG H, YAO C, WANG Y, et al. Effects of Different Combinations of Red and Blue Light on Morphology and Photosynthetic Characteristic of Tomato Seedlings[J]. Agricultural Biotechnology, 2018, 7(5):54-57.
(責任编辑:林海清)
