基于信号通路p38 MAPK探讨疏风宣肺汤对大鼠慢性支气管炎模型TNF-α的影响
2019-09-10凌嫘闵锐范伏元
凌嫘 闵锐 范伏元


〔摘要〕 目的 观察疏风宣肺汤对慢性支气管炎大鼠血清以及肺组织中肿瘤坏死因子(tumor nercrosis factor-α, TNF-α)的影响。方法 将60只SPF级大鼠,随机分为空白组、生理盐水组、宣肺止咳合剂组和疏风宣肺汤组,每组15只;空白组正常饲养,余组采用脂多糖-香烟烟雾诱导法造模成功后分别予以生理盐水、宣肺止咳合剂、疏风宣肺汤灌胃,1周后行腹主动脉采血,剪下右肺,检测血清中TNF-α浓度,肺组织中TNF-αmRNA、TNF-α蛋白以及p-p38 MAPK蛋白的表达。结果 在药物干预7 d后,各组大鼠血清中TNF-α浓度以及肺组织中的TNF-α mRNA、TNF-α蛋白、p-p38 MAPK蛋白的表达差异性均有统计学意义(P<0.05)。与空白组相比,疏风宣肺汤组,生理盐水组、宣肺止咳合劑组中各检测指标差异有统计学意义(P<0.05);与生理盐水组相比,疏风宣肺汤组和宣肺止咳含剂组差异有显著性统计学意义(P<0.01或P<0.05)。结论 疏风宣肺汤能显著降低慢支大鼠血清中TNF-α浓度以及肺组织TNF-α mRNA、TNF-α蛋白、p-p38 MAPK蛋白表达,减少p38 MAPK信号通路的活化可能是疏风宣肺汤有效防治慢性支气管炎的机制之一。
〔关键词〕 疏风宣肺汤;慢性支气管炎;肿瘤坏死因子-α;p38 MAPK信号通路;动物实验
〔中图分类号〕R285.5;R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.06.007
〔Abstract〕 Objective To observe the effects of Shufeng Xuanfei Decoction on tumor nercrosis factor-α (TNF-α) in serum and lung tissue of rats with chronic bronchitis. Methods A total of 60 SPF rats were randomly divided into a blank group, a normal saline group, a Xuanfei Zhike Mixture group and a Shufeng Xuanfei Decoction group, with 15 rats in each group. The blank group was fed normally, while the rest groups were given with normal saline, Xuanfei Zhike Mixture and Shufeng Xuanfei Decoction after successful modeling by lipopolysaccharide-cigarette smoke induction method. After 1 week, blood was collected from the abdominal aorta, the right lung was cut off, and the concentration of TNF-α in serum and the expressions of TNF-α mRNA, TNF-α protein and p-p38 MAPK protein in lung tissue were detected. Results After 7 d of medical intervention, the differences in the concentration of TNF-α in serum and the expressions of TNF-α mRNA, TNF-α protein and p-p38 MAPK protein in lung tissue of rats in each group were statistically significant (P<0.05). Furthermore, compared with the blank group, the differences of indexes in the Shufeng Xuanfei Decoction group, the normal saline group and the Xuanfei Zhike Mixture group were statistically significant (P<0.05). Compared with the normal saline group, the difference in the Shufeng Xuanfei Decoction group and the Xuanfei Zhike Mixture group was statistically significant (P<0.01 or P<0.05). Conclusion Shufeng Xuanfei Decoction can significantly reduce the concentration of TNF-α in serum of rats with chronic bronchitis and the expressions of TNF-α mRNA, TNF-α protein and p-p38 MAPK protein in lung tissue. Reducing the activation of p38 MAPK signaling pathway may be one of the effective mechanisms for preventing and treating chronic bronchitis by Shufeng Xuanfei Decoction.
〔Keywords〕 Shufeng Xuanfei Decoction; chronic bronchitis; TNF-α; p38 MAPK signaling pathway; animal experiment
慢性支气管炎(chronic bronchitis, CB),是以反复咳嗽、咳痰或伴有喘息为主要临床症状的常见慢性非特异性呼吸系统疾病[1],多因各种理化因素、长期感染引起的气管、支气管黏膜及其周围组织的炎症[2]。早期发作次数少且症状一般较轻微,晚期症状可长年存在,炎症反应明显,可并发阻塞性肺气肿,更甚者并发肺源性心脏病、肺动脉高压[3-4]。近年来,国内外有研究显示肿瘤坏死因子-α(TNF-α)作为人体重要的炎症因子,可通过激活信号通路p38 MAPK对慢性支气管炎炎症进展起重要作用[5],故本研究从信号通路p38 MAPK出发,观察疏风宣肺汤对慢性支气管炎大鼠模型血清以及肺組织中TNF-α的影响,并阐明其可能作用机制,现报道如下。
1 材料与仪器
1.1 动物
选用SPF级SD大鼠60只,体质量(200±20)g,雌雄各半,由湖南中医药大学动物实验中心代购,实验动物许可证号:SYXK2013(湘)-0005。实验方案通过医学实验动物伦理委员会批准。
1.2 药物及试剂
疏风宣肺汤(前胡10 g,桔梗10 g,橘红5 g,苦杏仁10 g,薄荷5 g,忍冬藤15 g,紫菀10 g,百部10 g,浙贝母10 g,蝉蜕5 g,蓝布正15 g,甘草 3 g)饮片均购自湖南中医药大学第一附属医院,一煎加800 mL水,取汁300 mL;二煎加500 mL水,取汁200 mL;将2次煎汁混合,文火煎至膏状(含生药2 g/mL),冷藏备用。宣肺止嗽合剂(甘肃普安制药有限公司,批号:CP002180309);戊巴比妥钠(上海浦山化工有限公司,250 g/瓶,批号:20151023);脂多糖(美国Sigma公司,10 mg/瓶,用无菌注射用水制成水溶液,1 mg/mL);生理盐水(湖南科伦制药有限公司,100 mL∶0.9 g,产品批号:H16100902);免疫组化试剂盒(bioss公司);RT-PCR试剂盒(Invitrogen公司);引物由上海生物工程有限公司合成。
1.3 主要仪器
FA-2004N型电子天平(上海精密科学仪器机械有限责任公司天平制造厂);智能恒温培养箱(上海冠森有限公司);台式离心机(上海离心机械研究所);酶标检测仪(美国Bio-Tek);电泳仪(美国Bio-rad);7500荧光定量PCR仪(Applied Biosystems公司)。
2 方法
2.1 分组与造模
适应性喂养1周记录所有大鼠的体质量,按完全随机表法将60只SPF级大鼠分成空白组、生理盐水组、宣肺止咳合剂组和疏风宣肺汤组,每组15只。空白组正常饲养;造模组采用脂多糖-香烟烟雾诱导法建立模型[6],每天在15 m3的密闭烟室中,以锯末110 g,烟叶10 g,辣椒4 g,硫磺0.5 g点燃进行烟熏,浓度约为200 ng/m3,持续30 min,共49 d。分别在第28、40天时,以2%戊巴比妥钠腹腔注射麻醉成功后行气管前正中皮肤小切口,钝性分离皮下组织,暴露气管,将预装在1 mL注射器中的200 μg(200 μL)脂多糖注入气管内,缝合肌肉及皮肤。造模49 d,参照剂量-体表面积换算公式(大鼠剂量=成人每日剂量×大鼠体质量与体表面积比值/人体质量与体表面积比值,单位为克)计算大鼠给药量,疏风宣肺汤组、生理盐水组、宣肺止咳合剂组每次给药剂量为10 mL/kg[7]。3组均采用灌胃法给药,每日2次,连续7 d。空白组正常饲养。
2.2 造模成功评判标准
大鼠见皮肤欠光泽、毛发凌乱或枯槁,精神倦怠、自主活动减少、食欲食量减少,2/3的大鼠可以闻及气道痰鸣音,并且出现咳嗽,哮鸣以及喘息气促等呼吸困难症状表示造模成功[6]。
2.3 标本采集及指标检测
2.3.1 标本采集 末次灌胃前禁食12 h,评估大鼠一般情况,如:体质量、皮毛色泽、呼吸、精神状态、食欲适量、自主活动情况。灌胃后2 h,3%戊巴比妥钠(1.5 mL/kg)腹腔麻醉成功后固定大鼠于鼠板,常规消毒后行腹主动脉采血,分离出血清,56 ℃水浴30 min灭活,用0.22 μm微孔滤膜过滤,除菌,分装,-80 ℃冰箱保存,双抗体夹心酶联免疫吸附法(ELISA法)检测血清TNF-α浓度。打开胸腔,暴露气管及肺组织,以棉线结扎右肺门,剪下右肺,分成两部分,一部分放入装有4%多聚甲醛的EP管内固定,余下右肺装入冻存管,-70 ℃保存。
2.3.2 ELISA法[8]检测血清TNF-α浓度 (1)准备工作:双蒸水稀释浓缩洗涤液,配制标准品,稀释生物素化抗体、酶结合物;(2)ELISA检测:取出所需板条,除空白孔外,在其它各孔中分别加入血清上清液稀释20倍,用封板胶纸封住反应孔,37 ℃水域孵育90 min,洗板4次,每孔加生物素化抗体工作液100 L,用封板胶纸封住反应孔,37 ℃水域孵育60 min,洗板4次,加酶结合物工作液100 L,封住板孔,37 ℃水域孵育30 min,洗板4次,每孔加显色剂100 L,避光37 ℃水域孵育15 min,每孔加终止液林,混匀,即刻读数,数值为吸光值;(3)计算样品浓度(C),公式为
C=A/Kb
其中A为吸光值,K为吸收系数,b为吸收层厚度。
2.3.3 RT-PCR法[8]检测各组肺组织中TNF-αmRNA的表达 取出装有肺组织的EP管,对肺组织行破碎细胞处理裂解,将裂解后的均匀液移至离心管内,放入高速离心机,调整参数为12 000 r/min,4 ℃离心5 min,取上清液入新的离心管中,加入0.2 mL三氯甲烷,离心15 min,取上清液至预处理的EP管中加入等体积异丙醇,颠倒混匀,室温沉淀10 min,离心10 min,弃上清液,加入75%乙醇,颠倒混匀,离心5 min,弃上清液再离心,弃上清液,取一定量样品在紫外分光度计上测OD值,估算RNA纯度及含量,将产物室温干燥沉淀2~5 min,加入适量的RNase-free水溶解沉淀,置于-80 ℃冰箱备用。按逆转录试剂盒说明将总RNA逆转录为cDNA。引物根据GenBank中大鼠的基因序列,使用Primer 5.0软件设计TNF-α引物(正向引物:5’-TCCAGACCTCCAGGCGGTGTC-3’;反向引物:5’-GTTCAGACAGAAGAGCGTGGTG-3’;产物:269 bp),在ABI7500荧光定量扩增仪上完成荧光实时监测PCR扩增,作出溶解曲线,收集荧光得到的曲线图,用ABI7500荧光定量仪自带的实时荧光定量PCR分析程序分析。
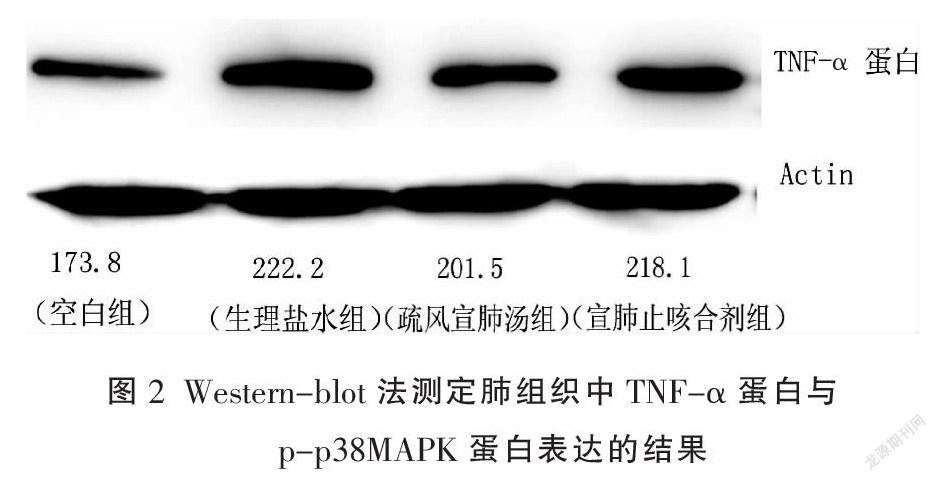
2.3.4 Western-blot检测[9]肺组织TNF-α、p-p38
MAPK蛋白的表达 将冻存管中肺组织通过破碎细胞处理裂解后放入无菌塑料离心管中,加入0.5 mL冷Lysis Buffer,手动匀浆10次,移至预冷的离心管中,4 ℃离心(10 000 r/min)5 min,取上清液至新的离心管中,分装保存于-80 ℃冰箱,用PBS稀释冻干标准品为2 000 L/mL的储存液,将25 uL的标准品和样本分别添加于微孔中,加入200 uLBCA工作液,盖上孔板盖,在37 ℃下孵育30 min后冷却至室温,测样品的吸光值OD,根据标准曲线查得相应的蛋白含量。SDS-聚丙稀酰胺凝胶电泳,转膜,封闭,封闭结束后TBS/T(1×TBS,1%tween-20)洗3次,5 min/次。一抗1∶1 000稀释于抗体稀释液中,膜于一抗4 ℃孵育过夜,TBS/T洗3次,5 min/次;二抗1∶1 000稀释于封闭液中,膜于二抗室温孵育1 h,TBS/T洗3次,5 min/次,TMB显色5~10 min,用扫描仪扫描记录PVDF膜上的蛋白条带,红外荧光扫描系统扫描图像及相对定量,以积分吸光度(峰面积)代表蛋白条带的信号强弱,以此对目的蛋白表达水平进行半定量比较,观察TNF-α蛋白、p-p38 MAPK蛋白水平情况。
2.4 数据统计分析
采用SPSS 21.0软件对所得数据进行统计学分析,采用平均数“x±s”表示,各组均数的比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为有统计学差异。
3 结果
3.1 一般情况观察
空白组大鼠精神状态良好、活动敏捷、皮肤毛发光泽、食欲食量正常,呼吸频率规整、无喘息气促,体重无明显变化。造模各组在第一次注入LPS一周以后,大鼠陆续出现痰鸣症状,背毛蓬松,偶尔有喘息、咳嗽症状,在第二次注入药物后行动迟缓、皮肤欠光泽、毛发凌乱、呼吸急促逐渐明显。灌胃过程中痰鸣、咳嗽症状仍存在,且生理盐水组大鼠症状有加剧的趋势,出现精神萎靡,食欲下降等表现;疏风宣肺汤组经灌胃治疗后观察到大鼠气促、喘息、食量情况有减轻趋势;宣肺止咳合剂组症状亦有所改善。
3.2 各组大鼠血清TNF-α浓度水平
与空白组相比,生理盐水组、宣肺止咳合剂组、 疏风宣肺汤组大鼠血清中TNF-α浓度明显增高,差异具有统计学意义(P<0.05)。宣肺止咳合剂组、疏风宣肺汤组两组与生理盐水组比较差异有统计学意义(P<0.05),且疏风宣肺汤组与宣肺止咳合剂组比较血清中TNF-α浓度更低,两组存在差异,提示宣肺止咳合剂组与疏风宣肺汤组均能降低血清中TNF-α浓度水平,而疏风宣肺汤效果更明显。见表1。
3.3 各组大鼠肺组织中TNF-α mRNA、TNF-α蛋白、p-p38 MAPK蛋白表达含量
与空白组比较,生理盐水组、宣肺止咳合剂组、疏风宣肺汤组大鼠肺组织中TNF-α mRNA、TNF-α蛋白、p-p38 MAPK蛋白表達明显增高,差异有统计学意义(P<0.05),提示造模后大鼠肺组织中各观察指标明显增多。宣肺止咳合剂组、疏风宣肺汤组两组肺组织中TNF-α mRNA、TNF-α蛋白、p-p38 MAPK蛋白表达含量均低于生理盐水组,差异具有统计学意义(P<0.05),疏风宣肺汤组各指标含量更低则提示疏风宣肺汤效果更明显。结果见表2,图1-2。
4 讨论
慢性支气管炎是一种气道炎症性疾病,是由于慢支气道中中性粒细胞数显著升高、过度激活细胞因子TNF-α等的释放[10],在中医属“内伤咳嗽”“喘证”等范畴[11],内伤外感均可伤肺而引起咳嗽,但风为百病之长,故肺受邪侵首为风,明·李梴著《医学入门》咳嗽总论中言“风乘肺咳,则鼻塞声重,口干喉痒”,咳嗽一病,病初常以“风邪犯肺”,久则为慢性咳嗽阶段[12],以“风邪伏肺,肺气上逆”为基本,故治当疏风宣肺、止咳化痰,疏风宣肺汤现代药理学研究证明[13]疏风宣肺汤中大多数药物均具有缓解气道炎症,减少气道损伤程度。
大量研究表明[14-16]通路p38 MAPK与慢性支气管炎有着密切的关系,表现为其激活与中性粒细胞、巨噬细胞数目及活性增加紧密相关,中性粒细胞的信号传导中p38 MAPK是一个关键的参与者,可加剧中性粒细胞等炎性细胞在炎症部位的聚集,从而加重炎症反应,使气道防御力降低,致使呼吸道感染不断进展或反复发作。Snvegnago等[17]和svensson等[18]在不同的疾病模型中发现正常情况下TNF-α体内一般活性极低,但受各种生物、理化等刺激后如机体组织受损,尤其是急性感染性疾病的发作阶段,前炎症因子TNF-α可大量持续释放至局部组织和血液中,可强烈激活胸腺细胞中的信号通路p38 MAPK,诱导多种细胞因子的释放。Sen等[19]进一步深入研究发现组织细胞损伤后活化的p38 MAPK激活的信号转导通路又会继续产生大量前炎性因子TNF-α,进一步又推动p38 MAPK信号通路的活化,形成“瀑布效应”即正反馈循环。目前实验资料均证实[20-23]TNF-α与慢性支气管炎的发展有着紧密的关联,其机制可能为TNF-α通过激活信号通路p38 MAPK,产生级联反应激活中性粒细胞,致中心粒细胞大量趋化、黏附、集聚于气道粘膜以及肺组织,加重慢性支气管炎炎症的进展。孙希[24]在研究隔药饼灸改善大鼠慢支的实验中也证实经治疗后的大鼠肺组织和血清中TNF-α含量与模型组比较均降低,且呈正相关,提示隔药饼灸改善了慢支大鼠的症状,减轻了炎症反应,其机制为隔药饼灸通过降低血清TNF-α浓度以及肺组织中的TNF-α蛋白表达减少其对p38 MAPK的激活,从而改善慢性支气管炎炎症的发生,成为防治慢性支气管炎的重要机制之一。通过本实验结果疏风宣肺汤组能明显减少慢支模型大鼠血清中TNF-α浓度、肺组织中TNF-α mRNA的表达及TNF-α蛋白的表达,同时肺组织中p-p38 MAPK蛋白的表达亦降低,综上所述大胆推测疏风宣肺汤可以明显改善慢性支气管炎患者的主要症状,具有明显的临床疗效,可能是通过降低血清TNF-α浓度以及肺组织中TNF-α mRNA的表达及TNF-α蛋白含量,而减少对信号通路p38 MAPK的激活,实现慢支炎症的控制。
参考文献
[1] 葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2013:19-19.
[2] 淦克职.中医治疗慢性支气管炎肺气肿63例[J].中国中医药现代远程教育,2016,14(8):90-92.
[3] 甘学军,汪小华,胡 刚.慢性支气管炎急性发作期患者血清肿瘤坏死因子α、白介素6水平变化及其临床意义[J].实用心脑肺血管病杂志,2016,24(5):127-12.
[4] 程 越,邱志新,李为民.慢性支气管炎发病机制研究进展[J].华西医学,2017,32(4):606-611.
[5] 张金波,王新陆,孙 丽,等.清肺化浊行血宽中方对PM2.5引起慢性支气管炎大鼠肺组织病理学及血清IL-8、TNF-α的影响[J].中华全科医学,2017,15(12):2028-2031.
[6] 欧阳金生.脂多糖—烟雾诱导慢性支气管炎大鼠模型水通道蛋白5表达与肿瘤坏死因子α、白介素13、白三烯B4的变化[D].厦门:福建医科大学,2006:34-37.
[7] 徐 杰.宣肺止咳颗粒的药效学研究[J].中国民族民间医药,2011,15:37-38.
[8] 周晓霞,程 敏,杨 琳,等.宣肺止咳合剂抗小鼠肺组织损伤及NO水平的研究[J].中华中医药学刊,2014,32(5):1096-1098.
[9] 李 军.蜕皮甾酮对急性肺损伤大鼠肺组织中TNF-α mRNA及SP-A表达的影响[D].广州:南方医科大学,2013.
[10] 蒋 叶,吕 伟,余书勤,等.艾拉莫德对脂多糖激活大鼠肺泡巨噬细胞系TNF-α产生及NF-κB活性的抑制作用[J]. 药学学报,2006,41(5):401-405.
[11] 彭先祝.止咳平喘软胶囊治疗慢性妨詹炎急性发作期的临床观察及对血清一的影响从而造成支气管肺组织的损伤[D].黑龙江中医药大学,2011:17-19.
[12] 闵 锐.疏风宣肺汤治疗单纯型慢性支气管炎迁延期风邪伏肺证的临床观察[D].长沙:湖南中医药大学,2017:12-13.
[13] 王志超,李 晶.从风论治咳嗽变异性哮喘[J].世界中西医结合杂志,2018,13(2):289-291.
[14] 梅全喜.现代中药药理[M].北京:中国中医出版社,2016:43-72.
[15] HUANG C, J ACOBSON K, SCHALLER M D. MAP kinase and cell migration[J]. Journal of Cell Science, 2004,117(20):4619-4628.
[16] LILIA SC, VALERIE F, FRANCO P, et al. Dual effects of P38MAPK on tnf-depende bronchoconst riction and tnf-independent neut rophil recruitment in lipopolysaccharide.induced acute respiratory dist ress syndrome[J]. Journal of Immunology,2005,175(1):262-269.
[17] 吕小琴.p38 MAPK特异性抑制剂SB 239063[J].国外医学(呼吸系统分册),2004(1):38-39.
[18] SNVEGNAGO L. PINTO I G, JESSE C R, et al. Spinal mechanisms of antinociceptive action caused by diphenyl diselenide[J]. Brain Research, 2007,116(2):32-37.
[19] SVENSSON C L, SCHAFER M, JONES T L, et al. Spinal blockade of TNF blocks spinal nerve ligation-induced increases in spinal p-p38[J]. Neuroscience Letters, 2005,379(3): 209-213.
[20] 丛培玮.肺气虚模型大鼠介导TNF-α/p38MAPK信号转导途径对肾组织AQPs表達影响[D].沈阳:辽宁中医药大学,2012:31-32.
[21] 李原青,李 逊.加减补肺汤对肺气虚证大鼠血清及含量变化的影响[J].江西中医药,2004,8(35):57-58.
[22] 陈永兰.p38 MAPK信号通路对小胶质细胞功能及NGF、TNF-α分泌的影响[D].大连:大连医科大学,2012.
[23] 程 越,邱志新,李为民,等.慢性支气管炎发病机制研究进展[J],华西医学,2017,4(32):606-611.
[24] 孙 希.基于P38MAPK探讨隔药饼灸对慢性支气管炎模型大鼠肺组织TNF-α的影响及作用机理[D].长沙:湖南中医药大学,2013.
