EDTA对猪肉12-脂肪氧合酶构象及酶活力的影响
2019-09-10王晶晶张新笑卞欢耿志明李鹏鹏王道营徐为民
王晶晶 张新笑 卞欢 耿志明 李鹏鹏 王道营 徐为民


摘要:【目的】探究乙二胺四乙酸鈉(EDTA)对猪肉12-脂肪氧合酶(12-LOX)构象和酶活力的影响,为猪肉加工贮藏过程中控制12-LOX活性提供参考依据。【方法】采用EDTA处理猪肉12-LOX,测定其酶活力,并分析EDTA对猪肉12-LOX的储藏稳定性、热稳定性、催化亚油酸反应、荧光光谱和圆二色谱(Circular dichrosim spectra,CD)的影响。【结果】添加EDTA可抑制猪肉12-LOX的酶活力,随EDTA浓度的增加,抑制作用逐渐增强,当EDTA浓度为10.0 mmol/L时,猪肉12-LOX活力约下降60%。EDTA能提高猪肉12-LOX的热稳定性和贮藏稳定性,使其比正常条件下保持较高酶活力。随着EDTA浓度的增加,猪肉12-LOX分子内部的α-螺旋和β-折叠含量降低,引起其二级结构发生明显变化;猪肉12-LOX的荧光强度不断减弱,EDTA浓度为20.0 mmol/L时,酶的内源荧光发射峰强度下降13%,但最大发射峰(λmax)的位置未发生变化。【结论】EDTA能引起猪肉12-LOX的构象变化进而抑制其酶活力。
关键词: 猪肉;12-脂肪氧合酶(12-LOX);乙二胺四乙酸钠(EDTA);活力;构象
中图分类号: S879.2;TS251 文献标志码: A 文章编号:2095-1191(2019)09-2052-06
Abstract:【Objective】To investigate the effects of sodium ethylene diamite tetracetate(EDTA) on the conformation and enzyme activity of porcine 12-lipoxygenase(12-LOX), and provide reference for controlling 12-LOX activity during pork processing and storage. 【Method】Porcine 12-LOX was treated with EDTA to determine the enzyme activity of porcine 12-LOX, and the storage stability, thermal stability, catalytic linoleic acid reaction, fluorescence spectroscopy and circular dichroism spectra(CD) of EDTA effects on porcine 12-LOX were analyzed. 【Result】The results showed that EDTA inhibited the activity of porcine 12-LOX and the inhibitory effect increased with the increasing of EDTA concentration. When the concentration of EDTA was 10.0 mmol/L, the activity of porcine 12-LOX decreased by 60% approximately. The addition of EDTA could increase the thermal stability and storage stability of porcine 12-LOX and make porcine 12-LOX retain enzyme activity for a longer time than normal conditions. As the concentration of EDTA increased, the content of α-helix and β-sheet inside the porcine 12-LOX molecule decreased, causing obvious change in its secon-dary structure and the fluorescence intensity of porcine 12-LOX was continuously weakened. When the concentration of EDTA was 20.0 mmol/L, the intensity of the endogenous fluorescence emission peak of the enzyme decreased by 13%, but the position of the maximum emission peak(λmax) did not change. 【Conclusion】Collectively, this study indicates that EDTA can cause conformational change of porcine 12-LOX and result in the activity change of porcine 12-LOX, which may providereference for the control of LOX activity during meat processing and storage.
Key words: porcine; 12-lipoxygenase(12-LOX); sodium ethylene diamite tetracetate(EDTA); activity; conformation
0 引言
【研究意义】肉制品在加工过程中易发生脂质氧化,影响肉制品风味。脂类物质的氧化分为自动氧化和酶促氧化(张迎阳,2014),脂肪氧合酶(Lipoxygenase,LOX)是酶促氧化最主要的内源酶,其专一性作用于多不饱和脂肪酸(PUFA)的顺,顺-1,4-戊二烯基位置,通过分子内加氧,生成具有共轭双键的氢过氧化物。氢过氧化物极不稳定,进一步反应生成多种挥发性化合物,这些物质一方面形成食品的主要风味物质(郇延军,2005;Roldan et al.,2014);另一方面,食品中脂質的过度氧化产生刺激性气味物质,不仅引起食品风味劣变,还造成PUFA含量下降,导致食品营养品质降低,增加储藏难度(曹锦轩等,2015;Mashima and Okuyama,2015;Stephany et al.,2015;吴宝森等,2017;Navicha et al.,2017)。因此,研究乙二胺四乙酸钠(EDTA)对猪肉中LOX活性的影响,以期在实际应用中控制酶活力,从而使肉制品呈现良好风味。【前人研究进展】Gata等(1996)从猪的股二头肌中分离得到一种LOX,研究发现其可能参与伊比利亚火腿的风味形成。Fu等(2009,2015)研究发现,白鲢鱼体内的LOX能快速催化降解不饱和脂肪酸,产生与腥味相关的各种醛类物质,从而导致白鲢鱼在贮藏和加工过程中出现腥味增强问题。Jin等(2011)的研究结果表明,LOX在干腌培根加工过程中的脂肪氧化起重要作用,酸度、温度和盐含量是影响LOX活性的主要因素。因此,LOX的催化活性和影响因素成为肉品加工的研究热点。LOX属于氧化还原酶(闫静芳等,2013),广泛存在于动植物界中,是一种含非血红素铁的双加氧酶,其金属辅基的活化态为氧化性三价铁离子,非活化态为二价铁离子。猪肉12-LOX分子量约62 kDa,其X-射线衍射结果显示猪肉12-LOX包括2个结构域,即氨基端的PLAT结构域和羧基端的催化结构域(汪晓鸣,2014;张爽,2014)。外源物质引入会导致LOX的构象变化从而影响其催化行为。Cai等(2004)研究表明,外源铁离子以电子传递方式与大豆LOX活性中心铁发生作用,促进酶促反应进程。蔡燕(2011)、蔡燕等(2015)的研究结果表明,外源铜离子和钡离子均能与大豆LOX活性中心铁离子发生交换作用,从而抑制催化氧化豆油的反应。因此,在肉品加工和贮藏过程中控制和添加某些无机盐、有机电解质等物质可调控肉制品LOX活性,从而控制肉品风味。【本研究切入点】EDTA是一种金属离子螯合剂,能与12-LOX活性中心的铁离子结合,从而影响12-LOX活力。但目前未见有关EDTA对猪肉LOX活性影响的研究报道。【拟解决的关键问题】将EDTA加入到猪肉12-LOX的催化反应体系中,观察外源EDTA对猪肉12-LOX的催化活性、圆二色谱(Circular dichrosim spectra,CD)和荧光光谱的影响,研究EDTA与猪猪肉12-LOX的相互作用,为猪肉加工贮藏过程中控制12-LOX活性提供参考依据。
1 材料与方法
1. 1 试验材料
猪肉12-LOX为前期课题组制备,亚油酸购自Sigma公司,盐酸、柠檬酸、柠檬酸三钠、EDTA、磷酸氢二钠和磷酸二氢钠等均为国产分析纯,购自生物工程(南京)股份有限公司。主要设备仪器:BioTek-Synergy2多功能酶标仪(美国BioTek公司)、M124A分析天平(意大利BEL公司)、HH-1数显恒温水浴锅(普析通用,常州国华电器有限公司)、MOS-450圆二色谱仪(法国Biologic公司)、LS-55 Fluorescence Spectrometer(美国PerkinElmer公司)。
1. 2 试验方法
1. 2. 1 酶活力测定
1. 2. 1. 1 底物溶液配制 将0.5 mmoL亚油酸溶于5 mL脱氧重蒸水(含180 μL Tween-20)中,使其充分混匀;逐滴加入1 mol/L氢氧化钠充分混匀直至体系清澈透明,再用1 mol/L盐酸调pH至9.0,直至亚油酸完全溶解,最后用脱氧重蒸水定容至50 mL。准备数支4 mL EP管,将该亚油酸储备液分装保存在EP管中,于-20 ℃下储存备用(何立超等,2016)。
1. 2. 1. 2 猪肉12-LOX活力测定 猪肉12-LOX活力测定方法在Kermasha和Metche(1986)的基础上有所改进。将20 μL亚油酸底物储备液与160 μL 50 mmol/L柠檬酸缓冲液(pH 5.5)充分混匀,再加入20 μL酶液迅速混匀,于234 nm处测定其1 min内吸光值的增加量。以不加酶液(20 μL亚油酸底物与180 μL柠檬酸缓冲液)为空白。LOX活力定义(Szymanowska et al.,2009):在一定温度和pH条件下,反应体系在234 nm波长处吸光值每分钟增加0.001表示为1个酶活力单位(U)。
1. 2. 2 EDTA对猪肉12-LOX活力的影响 按照酶活力测定方法,在反应总体系中加入EDTA溶液,使其终浓度分别为0(空白对照)、0.5、1.0、5.0、10.0和20.0 mmol/L,测定其酶活力,以酶活力最高值为100%,即纵坐标为相对酶活力。
1. 2. 3 EDTA对猪肉12-LOX储藏稳定性的影响 猪肉12-LOX酶液在4 ℃下储藏7 d,分别测定0~7 d的酶活力;另外,在猪肉12-LOX酶液中加入EDTA,相同条件下测定酶活力,以酶活力最高值为100%。
1. 2. 4 EDTA对猪肉12-LOX热稳定性的影响 取100 μL猪肉12-LOX酶液在50 ℃水浴中分别水浴0、1、2、3、4、6和8 min,取出后置于冰上,测酶活力,以0 min的酶活力为100%;在酶液中加入EDTA后,按照上述方法测定酶活力。
1. 2. 5 EDTA对猪肉12-LOX催化亚油酸反应的影响 在酶活反应体系中,加入20 μL EDTA,测定30 min内酶活力的变化。以未加入EDTA的酶活力反应体系为对照。
1. 2. 6 EDTA对猪肉12-LOX CD光谱的影响 CD光谱能有效分析蛋白质二级结构的变化,常用于蛋白质二级结构测定(Kouassi et al.,2007)。以50 mmol/L磷酸盐缓冲液(pH 7.6)为空白对照,CD光谱的扫描波长范围为200~250 nm,光源为氙灯,液池光径1 mm,在范围内扫描累加3次。扫描速度50 nm/min,猪肉12-LOX酶液浓度0.1 mg/mL。用平均椭圆率[θ]表示CD数据,单位為deg·cm2/dmol(Parker and Rees,1960)。
1. 2. 7 EDTA对猪肉12-LOX荧光光谱的影响 蛋白质分子中的芳香族氨基酸如色氨酸、酪氨酸和苯丙氨酸基团具有内源荧光性,在一定波长照射下会产生荧光,且荧光的产生会随着外界条件的改变而变化,因此蛋白质三级结构的变化可通过荧光光谱分析(Zhong et al.,2009)。具体方法:在1 mL EP管中加入不同浓度EDTA ,然后加入50 μL猪肉12-LOX酶液(稀释至0.1 mg/mL),混匀后测定其在290~450 nm的荧光光谱,所有试验重复3次,以50 mmol/L磷酸盐缓冲液(pH 7.6)为空白对照。激发波长280 nm,激发及发射光栅狭缝宽5 nm,激发狭缝宽度设为3 nm,速率240 nm/min。
2 结果与分析
2. 1 EDTA对猪肉12-LOX活力的影响
由图1可知,随着EDTA的加入,猪肉12-LOX活力逐渐降低。EDTA浓度较低时,对猪肉12-LOX活力影响不明显,其酶活力基本没有变化,随着EDTA浓度的增加,猪肉12-LOX活力快速下降。当EDTA浓度为5.0 mmol/L时,猪肉12-LOX活力降至原来的80%;当EDTA浓度为10.0 mmol/L时,猪肉12-LOX活力已下降至40%左右;而EDTA浓度为20.0 mmol/L时,LOX完全失去活性。LOX是一种含非血红素铁的蛋白质,EDTA作为一种金属离子螯合剂能与铁离子结合,从而使猪肉12-LOX活力降低甚至消失。
2. 2 EDTA对猪肉12-LOX储藏稳定性的影响
液态酶在常温条件下容易失活,即使在4 ℃下,酶活也不易保持。如图2所示,猪肉12-LOX在4 ℃下酶活力不稳定,储藏5 d后酶活力丧失30%左右,7 d后酶活力丧失55%左右。在加入EDTA后,猪肉12-LOX活力较稳定,储藏5 d后酶活力丧失20%左右,7 d后酶活力丧失40%左右。可见,EDTA对猪肉12-LOX的稳定性有一定促进作用。
2. 3 EDTA对猪肉12-LOX热稳定性的影响
LOX是一种热不稳定性酶,在受热条件下易失活。由图3可知,在50 ℃受热条件下,猪肉12-LOX的酶活力一直下降,水浴8 min时酶活力已降至原来的20%左右;在加入EDTA后,水浴8 min时酶活力下降至原来的30%左右,猪肉12-LOX对热变性的抵抗能力有所提高,失活率有所下降,酶活残余量略有增加。
2. 4 EDTA对猪肉12-LOX催化亚油酸反应的影响
如图4所示,在0~15 min内,两种反应体系中猪肉12-LOX活力均呈逐渐升高趋势,其中加入EDTA的反应体系中酶活力有所降低。在随后的反应中,加入EDTA的反应体系中猪肉12-LOX活力不再升高,达到反应平衡,而未加EDTA的反应体系中其酶活力略有升高后达反应平衡,进一步证实EDTA能抑制LOX活力。
2. 5 EDTA对猪肉12-LOX CD光谱的影响
蛋白质二级结构中主要的光活性基团是肽键,其吸收峰分布在蛋白质CD的远紫外区段(190~240 nm),一般α-螺旋特征吸收峰在208和222 nm左右,β-折叠在215 nm左右有一特征吸收负峰(Greenfield,1996,2006;Li et al.,2013)。如图5所示,天然状态的LOX远紫外CD在208和222 nm处显示负双峰曲线,在215 nm处显示1个负肩峰。加入EDTA后,猪肉12-LOX在208、222和215 nm处的特征吸收峰强度下降,表明猪肉12-LOX的ɑ-螺旋和β-折叠含量降低,EDTA的加入使其二级结构发生变化,且随EDTA浓度的增加,二级结构的变化越明显。
2. 6 EDTA对猪肉12-LOX荧光光谱的影响
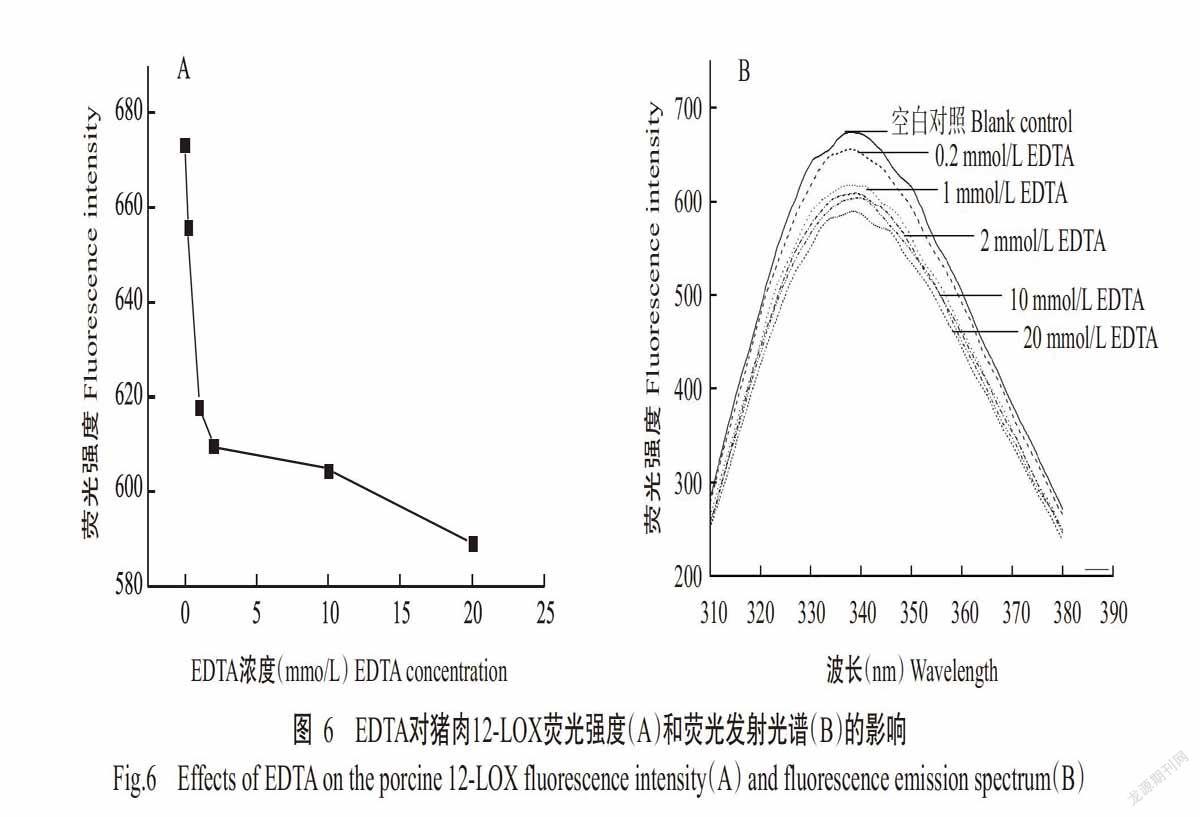
EDTA的加入会影响蛋白质所处的微环境,改变氨基酸中内源性荧光生色基团的位置和微环境,从而使其荧光光谱发生变化,因此可通过内源性荧光光谱来检测EDTA对蛋白质构象的影响。通过研究EDTA处理对猪肉12-LOX蛋白荧光性质的影响,可得出其构象变化信息。EDTA与猪肉12-LOX相互作用后其荧光发射光谱的变化如图6所示,随着EDTA浓度的增加,猪肉12-LOX的荧光强度逐渐降低,在EDTA浓度为20 mmol/L时,酶的内源荧光发射峰强度下降了13%,但最大发射峰(λmax)的位置未发生变化。有研究表明,λmax与色氨酸(Trp)残基所处微环境紧密相关,Trp残基位于蛋白质分子内部的非极性环境或外部的极性环境时,对应λmax小于330 nm或大于330 nm(Lefevre et al.,2007)。本研究中λmax在340 nm附近,说明其Trp残基主要分布在蛋白质分子外部的极性环境中。EDTA的加入使猪肉12-LOX在340 nm处的荧光强度降低,说明二者发生相互作用,导致猪肉12-LOX的内源荧光淬灭,但Trp残基仍处在极性环境中。
3 讨论
EDTA是一种金属离子螯合物,蔡燕(2011)研究了外源铜离子与铁离子加入对LOX酶活体系的影响,沈洁等(2017)研究了EDTA对大豆LOX活性和催化体系的影响,而本研究探讨EDTA加入对猪肉12-LOX酶活体系的影响。结果显示,在猪肉12-LOX酶活体系中加入EDTA后,其酶活力逐渐下降,当EDTA浓度为10.0 mmol/L时,猪肉12-LOX活力约下降60%,是因为EDTA与酶活性中心的铁离子结合,使酶变为非活性态,从而酶活力下降。EDTA对猪肉12-LOX的稳定性有一定促进作用,加入EDTA 5 d后酶活力丧失约20%,7 d后酶活力丧失40%左右,均比未加EDTA组的酶活性提高10%左右;EDTA也能提高猪肉12-LOX的热稳定性,在50 ℃受热条件下,水浴8 min时其活力已下降至原来的20%左右,在加入EDTA后,水浴8 min时酶活力下降至原来的30%左右,酶活力提高10%,与沈洁等(2017)的研究结果一致。这可能是因为EDTA作为一种金属离子螯合剂,能够与LOX活性中心的铁离子结合,从而使酶活降低,使其储藏稳定性和热稳定性有所提高。CD光谱结果表明,EDTA的加入能降低猪肉12-LOX内部的α-螺旋和β-折叠含量,引起其二级结构发生变化。荧光强度随着EDTA的加入逐渐降低,在EDTA浓度为20.0 mmol/L时,酶的内源荧光发射峰强度下降13%,说明EDTA与猪肉12-LOX相互作用引起LOX的内源荧光淬灭。这与沈洁等(2017)的研究结果存在差异,可能是由于酶源及实验条件的不同所致。
本研究仅添加单一的EDTA,分析其对猪肉12-LOX活性的影响,下一步将研究其他外源物质的加入及EDTA组合对猪肉12-LOX活性的影响,从而更好地控制肉品加工过程中的LOX活性。
4 结论
EDTA能抑制猪肉12-LOX活性,降低LOX荧光强度及内部α-螺旋和β-折叠含量,引起其二级结构发生变化。此研究可为肉制品贮藏和加工过程中LOX的调控提供参考。
参考文献:
蔡燕. 2011. 大豆脂氧酶催化过程的关键性问题研究及其产品的合成与应用[D]. 無锡:江南大学. [Cai Y. 2011. Study on key problems of soybean lipoxygenase catalytic process and synthesis and application of its products[D]. Wuxi:Jiangnan University.]
蔡燕,周红波,鞠剑锋,吴锦明. 2015. 外源钡离子对脂肪氧合酶好氧催化体系的影响[J]. 大豆科学,34(6):1053-1056. [Cai Y,Zhou H B,Ju J F,Wu J M. 2015. The effect of exogenous Ba2+ on the lipoxygenase catalytic system[J]. Soybean Science,34(6):1053-1056.]
曹锦轩,吕彤,王颖,孙杨赢,曾小群,潘道东,欧昌荣,干宁. 2015. 脂肪相关酶类在干腌肉制品风味形成过程中的作用[J]. 现代食品科技,31(1):254-258. [Cao J X,Lü T,Wang Y,Sun Y Y,Zeng X Q,Pan D D,Ou C R,Gan N. 2015. The role of fat-related enzymes in the process of flavor formation in dry-cured meat products[J]. Modern Food Science & Technology,31(1):254-258.]
何立超,马素敏,李成梁,靳国锋,章建浩. 2016. 温度、盐分以及pH值对鸭肉脂肪氧合酶活性的交互影响[J]. 江苏农业学报,32(6):1404-1409. [He L C,Ma S M,Li C L,Jin G F,Zhang J H. 2016. The interactive influence of temperature,salt concentration and pH on LOX activity of duck breast meat[J]. Jiangsu Journal of Agricultural Sciences,32(6):1404-1409.]
沈洁,田丹,蔡燕,陈娇,赵勤,吴锦明. 2017. EDTA对大豆脂氧酶的活性和催化体系的影响[J]. 大豆科学,36(2):305-308. [Shen J,Tian D,Cai Y,Chen J,Zhao Q,Wu J M. 2017. Effects of EDTA on the soybean lipoxygenase catalytic system[J]. Soybean Science,36(2):305-308.]
汪晓鸣. 2014. 重组鱼腥藻脂肪氧合酶催化小麦蛋白质氧化的机理[D]. 南京:南京农业大学. [Wang X M. 2014. Mechanism of recombinant anabaena lipoxygenase catalyzed oxidation of wheat protein[D]. Nanjing:Nanjing Agricultural University.]
吴宝森,孙玥晖,刘姝韵,王桂瑛,程志斌,谷大海,徐志强,廖国周. 2017. 肉和肉制品中脂质氧化的研究进展[J]. 食品安全质量检测学报,8(3):814-818. [Wu B S,Sun Y H,Liu S Y,Wang G Y, Cheng Z B,Gu D H,Xu Z Q,Liao G Z. 2017. Research progress on lipid oxidation in meat and meat products[J]. Journal of Food Safety & Quality,8(3):814-818.]
郇延军. 2005. 金华火腿加工过程中脂类物质及风味成分变化的研究[D]. 南京:南京农业大学. [Xun Y J. 2005. Study on the changes of lipids and flavor components in Jinhua ham processing[D]. Nanjing:Nanjing Agricultural University.]
闫静芳,王红霞,郭玉鑫,陆兆新,吕凤霞,王昱沣. 2013. 脂肪氧合酶的研究及应用进展[J]. 食品安全质量检测学报,(3):799-805. [Yan J F,Wang H X,Guo Y X,Lu Z X,Lü F X,Wang Y F. 2013. Application and research progress of lipoxygenase[J]. Journal of Food Safety & Quality,(3):799-805.]
张爽. 2014. 重组脂肪氧合酶改良面粉品质的研究[D]. 南京:南京农业大学. [Zhang S. 2014. Effect of recombinant lipoxygenase on wheat flour quality[D]. Nanjing:Nanjing Agricultural University.]
張迎阳. 2014. 干腌肉制品中脂质自动氧化机理及调控机制研究[D]. 南京:南京农业大学. [Zhang Y Y. 2014. Study on the influencing factors and regulation mechanism of lipid autooxidation during dry-cured meat products processing[D]. Nanjing:Nanjing Agricultural University.]
Cai K,Fang Y,Xia Y M,Yu Y F. 2004. Effect of exogenous iron on aerobic catalytic mechanism of soybean lipoxygenase[J]. Journal of Molecular Catalysis B:Enzymatic,32(1-2):21-26.
Fu X J,Lin Q L,Xu S Y,Wang Z. 2015. Effect of drying methods and antioxidants on the flavor and lipid oxidation of silver carp slices[J]. LWT-Food Science and Technology,61(1):251-257.
Fu X J,Xu S Y,Wang Z. 2009. Kinetics of lipid oxidation and off-odor formation in silver carp mince:The effect of lipoxygenase and hemoglobin[J]. Food Research International,42(1):85-90.
Gata J L,Pinto M C,Macías P. 1996. Lipoxygenase activity in pig muscle:Purification and partial characterization[J]. Journal of Agricultural and Food Chemistry,44(9):2573-2577.
Greenfield N J. 1996. Methods to estimate the conformation of proteins and polypeptides from circular dichroism data[J]. Analytical Biochemistry,235(1):1-10.
Greenfield N J. 2006. Using circular dichroism spectra to estimate protein secondary structure[J]. Nature Protocols,1(6):2876-2890.
Jin G J,Zhang J H,Yu X,Lei Y X,Wang J M. 2011. Crude lipoxygenase from pig muscle:Partial characterization and interactions of temperature,NaCl and pH on its acti-vity[J]. Meat Science,87(3):257-263.
Kermasha S,Metche M. 1986. Characterization of seed lipo-xygenase of Phaseolus vulgaris cv,Haricot[J]. Journal of Food Science,51(5):1224-1227.
Kouassi G K,Anantheswaran R C,Knabel S J,Floros J D. 2007. Effect of high-pressure processing on activity and structure of alkaline phosphatase and lactate dehydrogenase in buffer and milk[J]. Journal of Agricultural and Food Chemistry,55(23):9520-9529.
Lefevre F,Fauconneau B,Thompson J W,Gill T A. 2007. Thermal denaturation and aggregation properties of atlantic salmon myofibrils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry,55(12):4761-4770.
Li Y X,Wang J P,Jiao A Q,Xu X M,Jin Z Y. 2013. A study on the potential interaction between cyclodextrin and lipoxygenase[J]. Journal of Inclusion Phenomena & Macrocyclic Chemistry,76(1-2):107-111.
Mashima R,Okuyama T. 2015. The role of lipoxygenases in pathophysiology;new insights and future perspectives[J]. Redox Biology,6:297-310.
Navicha W B,Hua Y F,Masamba K G,Kong X Z,Zhang C M. 2017. Optimization of soybean roasting parameters in developing nutritious and lipoxygenase free soymilk[J]. Journal of Food Measurement & Characterization,11(4):1899-1908.
Parker C A,Rees W T. 1960. Correction of fluorescence spectra and measurement of fluorescence quantum efficiency[J]. Analyst,85:16-27.
Roldan M,Antequera T,Armenteros M,Ruiz J. 2014. Effect of different temperature-time combinations on lipid and protein oxidation of sous-vide cooked lamb loins[J]. Food Chemistry,149:129-136.
Stephany M,Bader-Mittermaier S,Schweiggert-Weisz U,Carle R. 2015. Lipoxygenase activity in different species of sweet lupin(Lupinus L.) seeds and flakes[J]. Food Che-mistry,174:400-406.
Szymanowska U,Jakubczyk A,Baraniak B,Kur A. 2009. Characterisation of lipoxygenase from pea seeds(Pisum sativum var. Telephone L.)[J]. Food Chemistry,116(4):906-910.
Zhong K,Hu X S,Wu J H,Chen F,Liao X J. 2009. Effects of high pulsed electric field on the secondary and tertiary structure of lipoxygenase[J]. Spectroscopy and Spectral Analysis,29(3):765-768.
(責任编辑 罗 丽)
