丹酚酸B治疗增生性瘢痕的多靶点分析
2019-09-10许小琪杨松林王军赖建辉郭思旖王芳陈求芳时军
许小琪,杨松林,王军,赖建辉,郭思旖,王芳,陈求芳,时军,3*
(1.广东药科大学中药学院,广东 广州 510006; 2.广州安诺科技股份有限公司, 广东 广州 510530; 3.广东省局部精准递药制剂工程技术研究中心,广东 广州 510006)
增生性瘢痕(Hypertrophic scar,HS)是皮肤深度创伤后创面组织过度修复导致细胞外基质(extracellular matrix,ECM)异常沉积形成的皮肤纤维化疾病。HS局部表现为皮肤潮红色,高于正常皮肤组织,质坚硬并常伴有瘙痒疼痛。除影响患者面貌外观,HS严重者还会引起瘢痕附近的器官或关节变形,导致运动功能障碍,给患者带来沉重的精神压力[1]。增生性瘢痕的形成因素多样,发生发展的分子机制尚不明确,治疗多采用手术切除,复发率较高[2]。
丹酚酸B(Salvianolic acid B,SAB)化学式为C36H30O16,是活血化瘀中药丹参中含量最高的水溶性成分,由三分子丹参素与一分子咖啡酸缩合而成[3]。研究表明,SAB具有抗炎、抗氧化、清除自由基等作用[4],可促进缺血心肌血管再生,抑制心、肺、肾纤维化进程[5-8]。丹参(或与其他中药配伍)治疗增生性瘢痕多有报道[9-10],SAB是否在抑制HS发生发展过程中起重要作用,亟待从分子机制上探明。
网络药理学融合了系统生物学和计算生物学等多学科理论知识和技术,从整体角度探索药物与疾病之间的关联性,与中医药辨证施治的整体观念不谋而合,在系统阐释药物多靶点协同作用、发现中药组效关系和提高药物研发效率等方面具有一定作用[11]。本研究基于网络药理学技术,构建“丹酚酸B-靶点-通路-增生性瘢痕”复杂网络,进一步阐明丹酚酸B防治增生性瘢痕的分子作用机制,以期为丹参治疗HS提供候选靶标和候选药物。
1 方法
1.1 SAB相关靶点的收集与筛选
本实验中SAB的靶点基于反向药效团匹配法预测药物分子靶点、数据库文本挖掘、文献检阅。登录TCMSP数据库(http://lsp.nwsuaf.edu.cn/tcmsp.php)检索并下载SAB的3D化学结构[12],储存为mol2格式并上传至SIB、SEA、ChEMBL活性成分服务器(https://www.sib.swiss/、http://sea.bkslab.org/、https://www.ebi.ac.uk/chembl/)中进行反向分子对接,下载药物成分的反向对接预测结果,利用Genecards数据库检索SAB相关靶点,对相关信息进行逐条检查及筛选,获得SAB相关靶点。检索近10年来SAB抗纤维化疾病的相关文献(Pubmed)[13-20],并进行筛选后,补充SAB相关靶点。将上述所得靶点进行汇总,利用UniProt数据库中Retrieve/ID Mapping功能,选择物种为“Homo sapiens”,将靶点标准化,去重。
1.2 HS相关靶点的收集与筛选
利用Genecards数据库[21](https://www.genecards.org/)及DisGeNET数据库[22](http://www.disgenet/org)检索与HS相关的靶点,以烧伤、外伤和手术所致皮肤创面增生性瘢痕作为筛选依据,对相关靶点信息进行逐条检查及筛选,以确保数据的可靠性。汇总所得结果后,利用UniProt将靶点标准化,去重。
1.3 SAB治疗HS的网络模型构建和分析
利用Cytoscape 3.6.1软件对整理后所得SAB相关靶点信息、HS相关靶点信息进行网络构建,并运用“Network Analysis”中Merge功能对2个网络进行映射分析,其中网络中交集靶点即为SAB治疗HS的潜在靶点,并以节点(Node)表示药物分子、疾病及潜在靶点,节点之间以边(Edge)相连接,得到“SAB-靶点-HS”网络。
1.4 靶蛋白互作网络的构建与分析
利用STRING平台[23](https://string-db.org/)构建潜在靶点之间的互相作用网络(protein protein interactionnetwork,PPI network),其参数设置如下——Organism:Homo sapiens(人类),minimum required interaction score:medium confidence(0.400),其余参数保持默认设置。下载PPI网络相关文件并导入Cytoscape 3.6.1中,根据度值(Degree)设置节点颜色深浅及形状大小,根据靶点相互作用分值(combine score)设置边的粗细,进行靶点蛋白互作网络构建。
1.5 GO富集分析
使用Cytoscape 3.6.1中的“ClueGO”插件对潜在靶点进行基因本体(gene ontology,GO)细胞组分(cellular component,CC)、分子功能(molecular function,MF)、生物过程(biological process,BP)富集分析[24],其主要参数设置如下—— Organism:Homo sapiens(人类),勾选GO术语整合选项以减少冗余富集结果,Kappa Score默认为0.4,pV<0.05,取各簇中最为显著富集的GO术语(GO Terms)作为该簇名称并绘制条形图。
1.6 KEGG通路富集分析
R是一款拥有丰富工具包的免费开源统计分析软件,其强大的统计分析及绘图功能在数据挖掘方面具有独特的优势。但注释文件更新较慢,分析结果过时是目前多数富集分析工具所存在的问题[25]。R语言软件中clusterProfiler是一款功能强大的工具包,可通过实时获取KEGG最新版本注释做富集分析,从而得到更具有时效性的注释结果[26]。使用clusterprofiler 3.8对潜在靶点进行KEGG通路分析,设定基因类型为“Homo sapiens(人类),阈值为P<0.05,并绘制条形图,其中节点颜色表示该信号通路P.adjust值的大小,节点长度表示该信号通路有关靶点数量的多少,红色节点越长说明该信号通路的富集显著性越高。
2 结果
2.1 潜在靶点预测结果
收集得到SAB相关靶点89个,HS相关靶点323个,网络映射分析结果显示共得到42个潜在靶点,其“SAB-靶点-HS”网络如图1所示,左边粉色节点为SAB,中间蓝色节点为潜在靶点,右边紫色节点为HS。
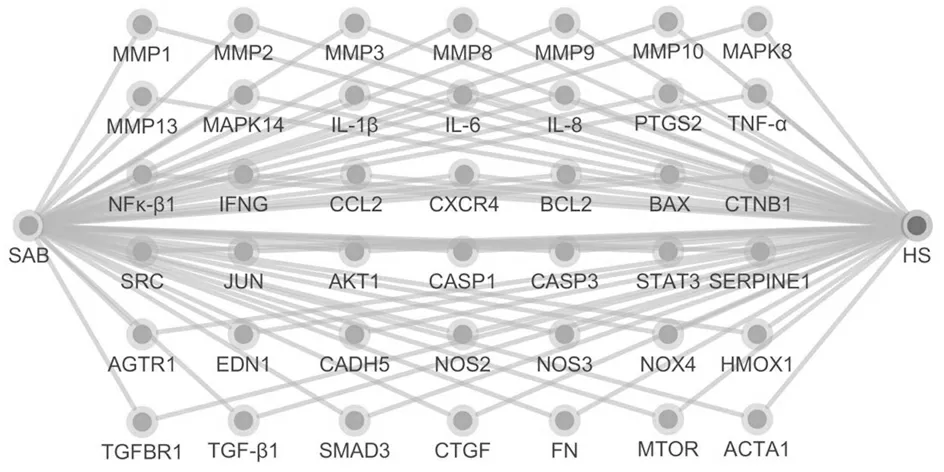
图1“SAB-靶点-HS”网络
Figure1Network of “SAB-Targets-HS”
2.2 靶点相互作用网络构建与分析
将上述42个靶点蛋白信息上传至STRING平台并进行PPI网络分析,获得靶点蛋白之间相互作用关系,导入Cytoscape 3.6.1进行可视化处理,以节点表示靶点,以边表示各靶点之间的相互作用关系,所构建的PPI网络中包含42个节点,无孤立节点,525条相互作用连线,聚类系数为0.83。PPI网络如图2所示,其中节点颜色越深,节点越大,表示该靶点的度值越大,反之表示度值越小。边的线条越粗,表示靶点之间的相互作用分数值越大,反之表示其越小。
2.3 GO分析结果
GO分析结果表明,在细胞组分方面,这些靶点主要为胞膜窖(caveola)、SMAD异源复合物(heteromeric SMAD protein complex)、常染色质(nuclear euchromatin)、核孔复合体(pore complex)等。分子功能GO分析表明,这些靶点主要富集于TGF-β受体结合(transforming growth factor beta receptor binding )、金属肽酶的正向调节(positive regulation of metallopeptidase activity)、趋化因子受体结合(CCR chemokine receptor binding)、磷脂酶激活剂活性(phospholipase activator activity)、前列腺素内过氧化物合酶活性(prostaglandin-endoperoxide synthase activity)等16个方面。通过分析生物过程结果发现,这些靶点涉及60个生物学过程中,主要包括:活性氧代谢过程(reactive oxygen species metabolic process)、上皮细胞迁移的正向调节(positive regulation of epithelial cell migration)、内皮细胞增殖的调节(positive regulation of epithelial to mesenchymal transition)、配体缺失的外源性凋亡信号通路上皮间质转化的正向调节(extrinsic apoptotic signaling pathway in absence of ligand)等(如图3所示)。

图2靶点PPI网络
Figure2PPI network of targets
2.4 KEGG分析结果
KEGG富集分析得到128条信号通路,如图4所示(列举前20条通路)。其中,如白介素-17信号通路(IL-17 signaling pathway)、松弛素信号通路(relaxin signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)、Toll样受体(Toll-like receptor signaling pathway)等通路均与HS密切相关,体现了SAB多途径的作用特点。
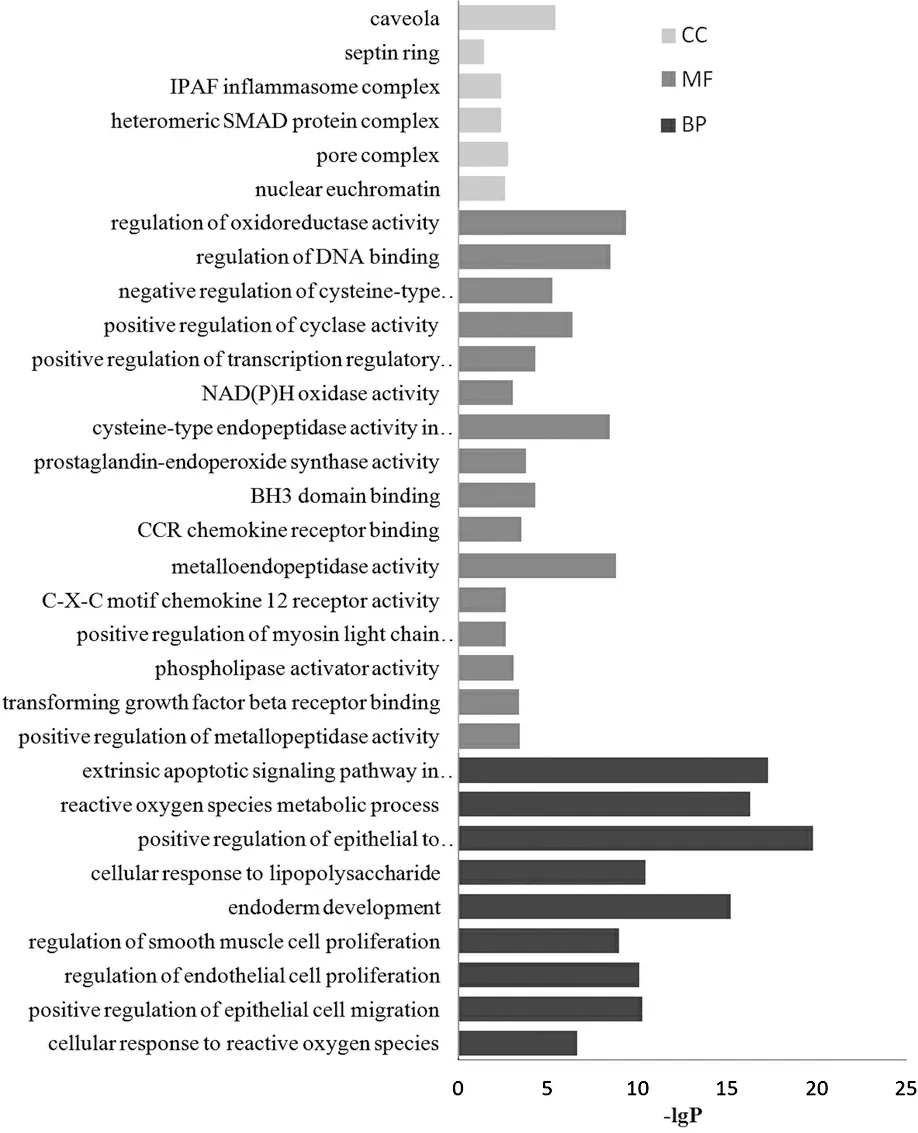
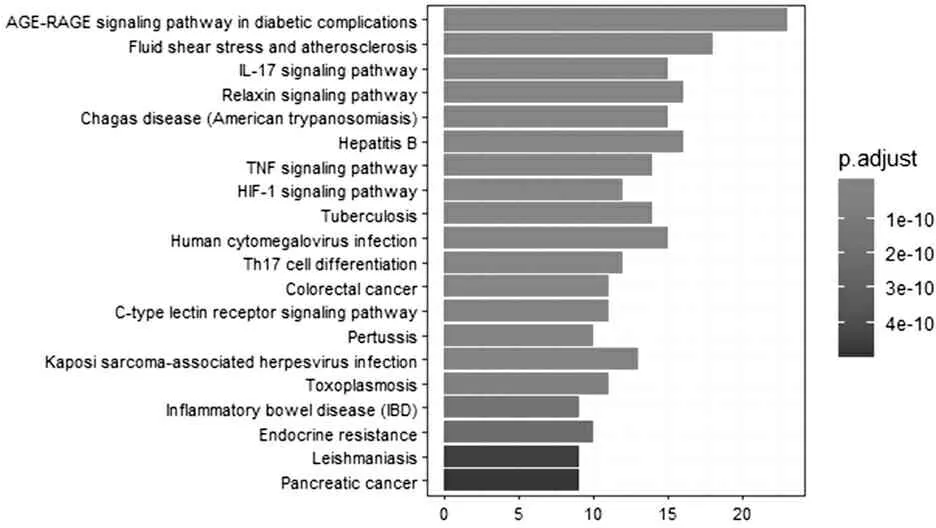
图3 靶点的GO分析结果Figure 3 Gene ontology analysis of targets
图4靶点KEGG通路富集结果(前20条)
Figure4Enrichment of target KEGG pathway (top 20)
3 讨论
SAB是活血化瘀中药丹参的主要水溶性成分之一,显著抑制心、肺等器官纤维化进程,SAB在治疗皮肤纤维化疾病方面具有较大的潜力[4]。Liu等[27]研究发现,SAB能够减轻博莱霉素诱导的小鼠皮肤纤维化程度,抑制人皮肤成纤维细胞(human skin fibroblast,HSF)增殖,下调细胞外基质相关基因的转录和胶原蛋白的表达,可能与其抑制TGF-β/SMAD和MAPK/ERK信号通路,且具有抗氧化活性有关。另外,本课题组通过前期研究发现[28-29],穿膜肽TAT修饰载丹酚酸B脂质体(SAB-TAT-LIP)在体外能够显著抑制HSF的增殖、迁移及侵袭,且呈现剂量和时间依赖性,可能通过将细胞周期阻滞于G0/G1期,诱导HSF凋亡,从而达到治疗HS的效果。通过运用网络药理学技术,对SAB治疗HS进行靶点预测及分析,对于进一步揭示其作用机制具有重要的意义。
本研究通过反向分子对接预测、数据库挖掘结合文献进行相关补充,找到SAB治疗HS的潜在作用靶点TGF-β1、MMP2、IL-1β、SMAD3、MAPK8等共42个,发现这些靶点均存在相互作用关系。同时,通过GO富集分析和KEGG信号通路富集分析,发现这些靶点主要分布于胞膜窖、SMAD异源复合物、常染色质、核孔复合体等部位,具有与TGF-β受体结合、与趋化因子受体结合、正向调节金属肽酶、调节磷脂酶激活剂活性、调节前列腺素内过氧化物合酶活性等功能,参与活性氧代谢过程、上皮细胞迁移的正向调节、内皮细胞增殖的调节、配体缺失的外源性凋亡信号通路、上皮间质转化的正向调节等多种生理过程,参与调控IL-17、TNF、HIF-1/VEGF等信号通路,表明SAB经多靶点、多通路发挥抑制HS作用。
上述靶点中,MMP1、MMP2、MMP3、MMP8、MMP9、MMP10、MMP13均为基质金属蛋白酶(matrix metalloproteinase,MMPs)家族成员,是一类锌离子依赖性的内肽酶,在损伤修复、炎症过程、组织形成、器官重塑等方面均发挥着重要的作用[30]。皮肤创面胶原(以Ⅰ、Ⅲ胶原为主)合成与降解速度之间的失衡是伤口异常愈合为HS的重要原因之一,而以MMP2、MMP9为主的MMPs是胶原降解的关键成分。有研究认为,MMP-9在伤口愈合初期主要由上皮细胞分泌,能够刺激成纤维细胞、内皮细胞等相关细胞的迁移、分化,促进上皮再生[31]。MMP2可能通过改变细胞局部微环境,促进新血管形成和成纤维细胞增殖、迁移起到重塑皮肤的作用[32]。基质金属蛋白酶组织抑制剂1和2(TIMP-1,2)是MMPs合成过程的主要调节因子,当MMPs与TIM-1,2表达失衡时,肉芽组织过度增生,胶原结构转变等均造成了HS的形成[33]。因此,调控相关MMPs的表达与活性可能是抑制HS的重要手段。预测结果提示SAB可能通过作用于多种MMPs靶点发挥抗HS作用。
转化生长因子-β(TGF-β1)在HS的发病机制中发挥着重要的作用,通过与其细胞表面受体的结合触发Smad依赖性或Smad非依赖性途径的细胞内信号转导,诱导炎性因子分泌,上调纤维化关键基因的转录水平,刺激成纤维细胞分裂增殖,导致胶原蛋白过度合成及ECM沉积[34]。Wang等[35]通过siRNA抑制TGFBR1基因表达试验,证明TGFBR1-siRNA能够显著抑制TGF-β/Smad信号通路介导的HSF增殖,降低Ⅰ型胶原、Ⅲ型胶原、纤连蛋白(fibronectin,FN)和结缔组织生长因子(connective tissue growth factor,CTGF)的mRNA表达水平,减少I型胶原和纤连蛋白的蛋白质表达量。还有研究发现SAB在体外能够抑制TGF-β1、TGFBR1表达,下调Smad2/3磷酸化,发挥抗纤维化疾病的药理作用,预测结果揭示SAB通过作用于TGF-β/Smad通路产生抑制瘢痕增生作用[36]。
Nauta T等[37]研究发现,当皮肤受创时,创面血管损伤,血流受阻,血液供应中断导致局部组织缺氧,影响了组织正常的代谢需求。血管内皮生长因子(VEGFA)、TGF-β和肿瘤坏死因子ɑ(TNF-ɑ)等炎性因子和生长因子受到激活后,刺激内皮细胞和成纤维细胞的迁移与增殖,诱导血管增生。当创面因长时间供氧不足形成慢性缺氧时,易导致伤口愈合不全或愈合时间缓慢,引起瘢痕增生。研究发现,SAB可通过抑制血管内皮生长因子(VEGF)和ERK的活性从而保护内皮细胞免受炎症因子的破坏[38]。另外,SAB可能通过下调JNK的表达以及阻断ERK、MAPK磷酸化过程,能够显著减少体内外PTGS2的表达,减少前列腺素E2(PGE2)的生成[39]。本预测结果提示SAB可能通过调控HIF-1/VEGF信号通路,参与创口处微血管生成过程与炎症反应,发挥防治瘢痕增生的作用。
本研究基于网络药理学方法,对SAB进行靶标预测和通路分析,多角度探索丹酚酸B防治增生性瘢痕的潜在作用机制,发现SAB可能通过抑制成纤维细胞增殖、抗内皮细胞过度分化、减少炎症反应等机制发挥抗瘢痕增生作用,以期为丹参治疗增生性瘢痕提供候选靶标和候选药物。本研究网络药理学预测结果需要后续研究中进一步的验证和支持。
