盐酸文拉法辛缓释胶囊的中试放大试验与体外释放特性研究
2019-09-10赵荣军苏诗娜陈祝霞苏朝芬刘英梁超峰
赵荣军,苏诗娜,陈祝霞,苏朝芬,刘英,梁超峰
(1.江苏省泰兴市人民医院药学科,江苏泰兴 225400; 2.广州市药物一致性评价技术联盟,广东 广州 510663; 3.广州科琅医疗科技有限公司,广东 广州510530; 4.广州市番禺区中心医院,广东 广州511400; 5.广州医药工业研究院广州市药物制剂新型释药技术重点实验室,广东 广州510240; 6.中山大学新华学院,广东 广州510520; 7.广东岭南职业技术学院,广东 广州510663; 8.广东药科大学附属第一医院,广东 广州510080)
盐酸文拉法辛(venlafaxine hydrochloride)作为第三代抗抑郁药,在临床上被广泛应用于治疗各种类型抑郁症、强迫症、精神分裂症、社交恐惧症、创后应激障碍等疾病,具有起效快、不良反应少、耐受剂量范围更大,对重性抑郁症患者有更高的临床治愈率的优点[1]。盐酸文拉法辛缓释胶囊由惠氏公司首先研发并于1997年10月首获美国FDA批准上市,商品名为“怡诺思”(EFFEXOR XR),是全球第一个上市的5-羟色胺-去甲肾上腺素再摄取抑制剂,实现了一天一次给药且能更快地改善症状,得到临床广泛认可[2]。
本研究在前期研究[3]和其他文献[4]的基础上,对盐酸文拉法辛缓释胶囊产业化的关键,即中试放大环节(特别是对关键工艺—缓释层流化床包衣的关键参数的控制)和产品在不同释放条件(介质、方法、转速)的释药特性进行研究,为建立缓释制剂的产业化过程质量评价与控制、研发及中试平台打下基础。
1 仪器与试药
1.1 仪器
流化床[可行性试验型:Midi-Glatt;小试型:GPCG-1;预中试型:GPCG-5,德国Glatt GmbH;中试型:FLZB-30,创志(上海)有限公司];Agilent HPLC 1100高效液相色谱仪(安捷伦科技公司);UV-2450型紫外可见分光光度计(日本岛津公司);ADFC8E自动溶出取样系统(天津市天大天发科技有限公司)。
1.2 药品与试剂
盐酸文拉法辛缓释胶囊(批号:1112014,规格:75 mg/粒,爱尔兰惠氏药厂);盐酸文拉法辛对照品(批号:20111114,质量分数:99.74%,湖北巨顺宏生物化工有限公司);MCC PH101(批号:C1206065,湖州展望药业有限公司);HPMC E5(批号:PD371004)、HPMC E6(批号:PD340380A)、乙基纤维素 EC 10CP(批号:PD303969)均由上海卡乐康包衣技术有限公司提供;滑石粉(批号:0904011A,桂林桂广滑石开发有限公司)。
2 方法与结果
2.1 盐酸文拉法辛的测定方法
见本课题组的前期研究[3]。
2.2 释放度测定方法
2.2.1 色谱条件[5]色谱柱:Agilent C8(150 mm × 4.6 mm,5 μm);流动相:乙腈-缓冲液(体积比3∶7);流速:1.0 mL/min;检测波长:274 nm;柱温:30 ℃。
2.2.2 方法学考察 按2015年版《中国药典》(四部)通则9101相关要求进行方法学考察。结果显示:盐酸文拉法辛质量浓度(ρ)对峰面积(A)的回归方程为A= 2.513 5ρ+1.700 5(r2=1.000 0,n=6),线性范围为2~120 μg/mL;平均回收率为99.9%(RSD=1.42%,n=15);取盐酸文拉法辛缓释胶囊6粒,置37 ℃、900 mL脱气纯化水的溶出杯中,采用《中国药典》2015年版四部0931第二法[6],以脱气纯化水作为释放介质,转速为100 r/min,在释放24 h时抽取5 mL,滤过,在室温放置不同的时间(0、2、4、6、8、12、24 h)分别测定吸收度,结果显示过滤后样品的文拉法辛质量分数在24 h内基本保持不变。
2.2.3 释放度测定方法 采用《中国药典》2015年版四部0931第二法[6],采用ADFC8E自动溶出取样系统,取盐酸文拉法辛缓释胶囊12粒,置37 ℃、900 mL的脱气纯化水中,分别于1、2、3、4、5、6、8、10、12、16、20、24 h定时取滤液5 mL,滤过,HPLC法测定释放度;另精密称取盐酸文拉法辛对照品适量,加介质(取相同规格的空胶囊壳,加脱气纯化水900 mL,置37 ℃水浴使溶解,滤过)适量使溶解并定量稀释制成每1 mL中约含文拉法辛70 μg的溶液,计算释放度。
2.3 缓释(小丸)胶囊的制备
2.3.1 制备工艺[3]称取盐酸文拉法辛75 g,MCC 111 g,HPMC 1.88 g,过80目筛,混合均匀,加入纯水,采用快速搅拌制粒机制成湿度适宜的软材。将软材加入挤压机中,经0.8 mm筛孔筛板,以35 r/min的螺杆转速挤出成条状;再将其置于圆化机内,以滚圆速度1 000 r/min滚化9 min,制得含药湿丸;置于60 ℃鼓风干燥箱内4.5 h,取出,筛分得含药丸芯。称取1.88 g HPMC和281 g体积分数75%乙醇配制的溶液作为隔离衣层;37.1 g乙基纤维素、0.375 g滑石粉和493 g体积分数75%乙醇配制的溶液作为缓释衣层;含药丸芯投入流化床包衣机(Wurster装置),调节包衣参数包隔离衣、缓释衣,制成缓释小丸,检验、装胶囊。
2.3.2 缓释衣层小试、中试放大研究 根据在可行性试验型流化床Midi-Glatt上的实验结果,采用流化床批量递增(可行性试验型Midi-Glatt→小试型GPCG-1→预中试型GPCG-5→中试型FLZB-30)设计,检测产品质量分数、收率、效率、释放度和释放曲线,考察、优化中试放大工艺,结果见表1、表2。可见,调整好各参数,特别是控制包衣区温度、隔圈内风速、雾化液滴大小,在小试、中试放大过程中尽量相近后,可以将小试工艺顺利放大到中试,所得产品均符合质量标准,且中试产品的释放度与较小制备规模样品的相似(相似因子f2>50)。

表1 各型流化床参数及实验结果Table 1 Various fluidized bed parameters and experimental results

表2 盐酸文拉法辛缓释胶囊各型流化床制品的释放度Table 2 Release of various fluidized bed products of venlafaxine hydrochloride sustained-release capsules
2.4 影响释放度的因素考察
2.4.1 不同释放方法对药物释放的影响[7]采用《中国药典》2015年版四部0931第一法、第二法进行释放度试验[6],转速为100 r/min,分别于1、2、3、4、5、6、8、10、12、16、20、24 h定时取滤液5 mL,HPLC法测定释放度,考察不同方法对释放度的影响,结果见图1。可见,2种方法均对盐酸文拉法辛胶囊释放度几乎没有影响。

篮法浆法051015202530100806040200t/h释放度/%
图1不同释放方法对药物释放的影响
Figure1The effect of different dissolution methods on drug release
2.4.2 不同转速对药物释放的影响 采用《中国药典》2015年版四部0931第二法[6]进行释放度试验,转速分别为100、75、50 r/min,考察不同转速对释放度的影响,结果见图2。可见,3种转速下盐酸文拉法辛胶囊的释放曲线接近相同。
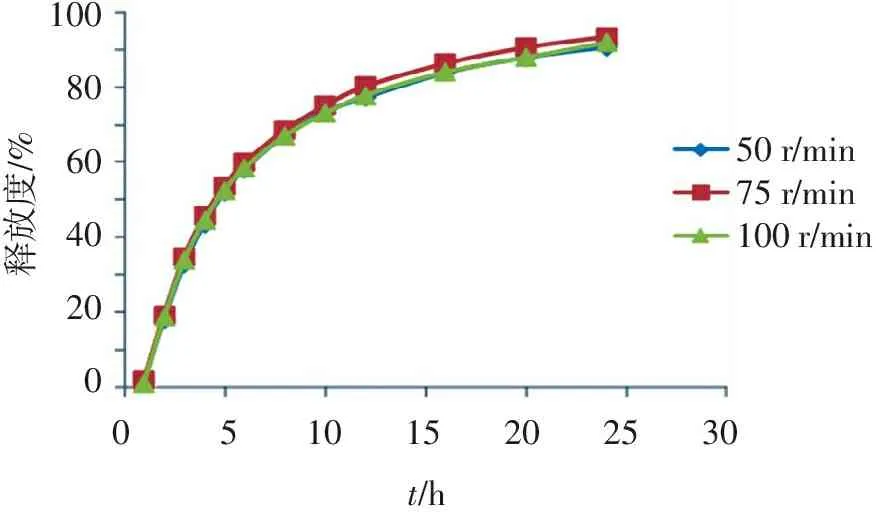
50r/min75r/min100r/min051015202530t/h100806040200释放度/%
图2不同转速对药物释放的影响
Figure2The effect of different rotational speeds on drug release
2.4.3 不同介质对药物释放的影响 采用《中国药典》2015年版四部0931第二法[6]进行释放度试验。配制人工胃液(pH1.2)、人工肠液(pH6.8)、pH4.5缓冲溶液和脱气纯化水分别作为药物释放介质,考察盐酸文拉法辛胶囊在上述4种介质下的释放度情况[8-9],结果见图3。可见,盐酸文拉法辛胶囊在4种pH释放介质下的释放度曲线相似度高,4种pH释放介质对盐酸文拉法辛胶囊释放度均基本没有影响。
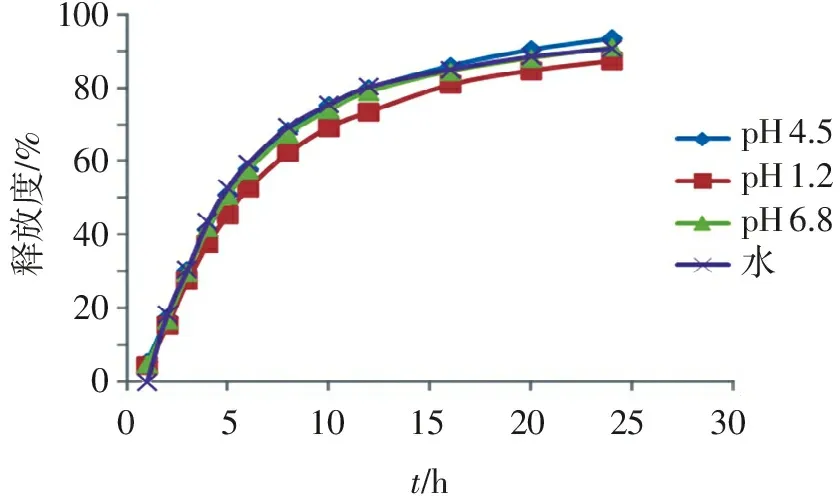
pH4.5pH1.2pH6.8水051015202530t/h100806040200释放度/%
图3不同递质对药物释放的影响
Figure3The effect of different release medium on drug release
2.4.4 体外释药机理的研究 取本品,按照《中国药典》2015年版四部0931第二法[6],以水为释放介质,体积为900 mL,转速为100 r/min,依法操作,经1、2、3、4、5、6、8、10、12、16、20、24 h,各取溶液5 mL,滤过,取续滤液作为供试品溶液,按“2.2.1”项下色谱条件进样检测,计算不同时间的释放度,结果见图4。

051015202530t/h100806040200释放度/%
图4盐酸文拉法辛缓释胶囊释放曲线
Figure4Release curve of Venlafaxine Hydrochloride Sustained-Release Capsules
为了更直观描述盐酸文拉法辛缓释胶囊的体外释药机理,根据上述释放度测定的结果,分别用不同的释放模型(零级方程、一级方程、Higuchi方程、Ritger-Peppas方程、Weibull方程)进行线性拟合,结果见表3。可见,盐酸文拉法辛缓释胶囊的体外释药符合一级释放模型,前期快速释药,后期缓慢释药。
表3 不同释药模型的拟合方程和相关度
Table3The fitting equation and correlation degree of different drug release models

拟合模型拟合方程r零级释放Q=0.035 7t+0.249 10.890 3一级释放ln(1-Q)=-0.051 9t - 0.026 10.995 0HiguchiQ = 0.232t1/2+0.071 40.958 8Ritger-PeppaslnQ=1.699 4lnt - 3.603 50.906 1Weibullln ln11-Q=1.960 6lnt - 3.660.935 2
3 讨论
中试是实验室小试与大生产的桥梁,是在模拟工业化生产的条件下验证实验室工艺可行性所进行的工艺研究,流化床包衣的中试是缓释丸剂研发链条中最关键一环,原因是中试的流化床在喷枪结构原理等方面与小试的不同,但与工业化生产的一致。无论是何种流化床,进口的或是国产的,关键是控制包衣区温度、隔圈内风速、雾化液滴大小在小试、中试、生产放大过程中一致或尽量接近,再调整好其他参数,就可以将小试工艺顺利放大到中试,并使产品质量在生产规模放大过程中保持一致,为进一步大生产奠定基础。
本研究分别考察人工胃液(pH1.2)、人工肠液(pH 6.8)、pH 4.5缓冲溶液和脱气纯化水4种释放介质,结果显示盐酸文拉法辛缓释胶囊在4种释放介质中的释放度曲线相似度高,4种释放介质对盐酸文拉法辛胶囊释放度基本没有影响。相比之下,纯化水简单易得,可以考虑用纯化水代替人工胃液和人工肠液进行释放度测试。
盐酸文拉法辛胶囊在3种转速(100、75、50 r/min)下的释放曲线接近相同,说明药物在身体机能强壮或虚弱者体内均能按要求释放和被吸收,而较低转速(如50 r/min)使药物释放较缓慢且更有区分力,因此,用50 r/min转速来测试释放度,更能准确地反映盐酸文拉法辛缓释胶囊的释药性能和差异。
盐酸文拉法辛胶囊与释放介质接触后,胶囊壳逐渐溶解破裂,其内部含药小丸暴露于释放介质中,释放过程中含药小丸自始至终维持球形且体积和外表没有变化,由此估计含药小丸释放的主要过程为介质从药剂表面的浸入、药物溶解、经孔道扩散及释出。Higuchi方程及一级动力学方程均能较好地描述缓释胶囊的体外释放曲线,药物释放量也与时间的平方根成直线关系,符合水不溶性骨架药物的释药特征,提示本制剂处方工艺制备的丸芯和控释膜控制药物释放是通过孔径很细且错综复杂的孔道进行。
