模拟长期微重力环境下大鼠眼底血流动力学、眼轴长度及血清中IFN-γ、IL-10含量的变化△
2019-09-10宫玉波许永杰仇长宇赵军王媛郭小华高薇司少艳秦亚亚吴斌罗灵赵宏伟
宫玉波 许永杰 仇长宇 赵军 王媛 郭小华 高薇 司少艳 秦亚亚 吴斌 罗灵 赵宏伟
随着航天技术的进步及国际空间站活动的开展,越来越多的航天人员需要进行长期太空工作。长期处于太空失重环境下可以导致视盘水肿、视网膜棉絮斑、神经纤维层增厚等眼部损害[1-2]。眼部损害会进一步导致视功能下降,而良好的视功能对于航天工作人员成功安全地完成空间飞行任务至关重要。关于失重对眼部影响的研究较多,失重引起眼部病变与时间密切相关,这些眼部病变主要与失重状态下的血液头向分布、颅内压增高及静脉淤血有关[3-4]。静脉淤血表示眼部血流动力学异常,目前关于失重对眼部血流研究较少,主要是短期研究[5-6];而对于长期失重状态下眼底血流变化尚未见报道。为此,本研究通过尾吊大鼠模拟长期微重力环境,研究其对大鼠眼部血流及眼轴的影响。还有研究表明[7-8],失重状态亦影响机体细胞免疫功能,太空飞行中Th细胞亚群中Th1/Th2发生漂移,γ-干扰素 (interferon-γ,IFN-γ)白细胞介素-10(interleukin-10,IL-10)的细胞比值降低,即Th2漂移;Th2漂移在空间飞行中持续存在,则有可能发生自身免疫性疾病、超敏反应以及与细胞介导免疫功能下降相关的疾病。因此,本研究中我们通过连续检测失重大鼠血清中IFN-γ(Th1因子)及IL-10(Th2因子)表达,分析其变化规律,探讨失重状态下机体的免疫状态。
1 材料与方法
1.1 材料SPF级SD大鼠40只,雄性,体质量为220~260 g,由斯贝福(北京)生物技术有限公司提供[许可证号:SCXK(京)2016-0002]。本实验方法符合动物伦理学要求。实验过程中对动物的使用和处理符合国家科学技术部颁布的《实验动物管理条例》。IFN-γ、IL-10酶联免疫吸附试剂盒(哈灵生物公司)。
1.2 方法
1.2.1 实验分组取40只SD大鼠按随机数字表法均分为8组:正常对照组、尾吊1 d组、尾吊4 d组、尾吊1周组、尾吊2周组、尾吊1个月组、尾吊2个月组、尾吊3个月组,每组5只大鼠。
1.2.2 模拟微重力环境大鼠失重模型建立采用尾悬吊法建立大鼠失重模型[9]。所有大鼠单笼饲养,尾部悬吊,使后肢悬空,保持头低位,并使身体纵轴与水平线呈-30°夹角,前肢着地可自由活动,所有大鼠自由进食、饮水。
1.2.3 大鼠眼轴长度及视网膜中央动脉血流动力学的检测以大鼠右眼作为实验眼,按3 mL·kg-1体质量腹腔注射100 g·L-1水合氯醛麻醉大鼠。检测前大鼠眼滴表面麻醉剂2次。采用Acuson Sequoia 512型彩色多普勒超声诊断仪进行检测,探头型号:15L8-S,频率10 MHz,彩色多普勒增益固定在50 dB,图像深度调至2.0 cm。
1.2.3.1 各组大鼠眼轴长度测量探头涂适量耦合剂后置于大鼠右眼角膜,以固定物为持探头的手腕部支点,避免探头压迫眼球。轴位扫描,探头标志朝上,二维显示大鼠眼球轮廓,轻微调整探头方向,使视神经暗区在眼球后壁清晰显示,测量各组大鼠眼轴长度,重复测量3次,取平均值。
1.2.3.2 各组大鼠视网膜中央动脉血流动力学检测二维显示眼球轮廓,轻微调整探头方向,使视神经暗区在眼球后壁清晰显示,启动彩色多普勒超声诊断仪。以红、蓝色伴行且垂直于眼球壁或交替出现进入眼球后壁的彩色血流信号作为大鼠视网膜中央动脉(central retinal artery,CRA)和视网膜中央静脉(central retinal vein,CRV)。利用转向角功能,使脉冲多普勒角度尽量<30°。将取样容积调整为1 mm,置于彩色CRA血流最亮处。选择清晰的5个心动周期图像,测定收缩期最大血流速度(peak systolic velocity,PSV)、舒张末期血流速度(end diastolic velocity,EDV)。每个指标重复测量3次,取平均值。所有操作均由同一名医师完成。
1.2.4 大鼠血清中IFN-γ、IL-10含量测定各组大鼠分别于相应时间取材,每组各取3只,心脏采血1.5 mL。室温下静置20 min,待自然凝固后3000 r·min-1离心5 min,取血清-80 ℃储存。按ELISA试剂盒说明书操作,检测各组大鼠血清中IFN-γ、IL-10含量。

2 结果
2.1 CRA的血流动力学各参数变化CRA的PSV比较见表1,结果显示:正常对照组与尾吊1 d、4 d、1周、2周、1个月、2个月、3个月组比较,差异均有统计学意义(均为P<0.05),尾吊各组PSV均较正常对照组下降;尾吊1 d组除与尾吊1个月组、2个月组差异无统计学意义(均为P>0.05)外,与其余各组比较差异均有统计学意义(均为P<0.05);尾吊2周组除与尾吊1周组差异无统计学意义(P>0.05)外,与其余各组比较差异均有统计学意义(均为P<0.05),PSV降至较低;尾吊1个月组同尾吊2周组差异有统计学意义(P<0.05),同尾吊2个月组差异无统计学意义(P>0.05),PSV较2周时部分恢复,但仍低于正常对照组;尾吊3个月组同其余各组比较,差异均有统计学意义(均为P<0.05),PSV降至最低。
CRA的EDV比较见表1:正常对照组除与尾吊1 d组、尾吊1周组及尾吊2个月组差异均无统计学意义外(均为P>0.05),与其余各组差异均有统计学意义(均为P<0.05),尾吊各组EDV均较正常对照组下降;尾吊2周组与尾吊1周组、尾吊1个月组差异均无统计学意义(均为P>0.05),与尾吊2个月组、尾吊3个月组差异均有统计学意义(均为P<0.05),EDV降至较低;尾吊1个月组与尾吊2个月组、尾吊3个月组差异均有统计学意义(均为P<0.05);尾吊2个月组除与尾吊1 d组差异无统计学意义外(P>0.05),与其他尾吊组差异均有统计学意义(均为P<0.05),EDV逐渐恢复;尾吊3个月组与其余各组差异均有统计学意义(均为P<0.05),EDV降至最低。


组别nPSV/cm·s-1EDV/cm·s-1正常对照组50.133±0.0060.083±0.006尾吊1 d组50.107±0.0140.063±0.005尾吊4 d组50.093±0.0100.060±0.009尾吊1周组50.083±0.0100.057±0.005尾吊2周组50.080±0.0080.053±0.005尾吊1个月组50.097±0.0130.057±0.010尾吊2个月组50.103±0.0130.070±0.008尾吊3个月组50.063±0.0130.037±0.005
2.2 眼轴长度变化比较正常大鼠眼轴长(0.542±0.023)cm,尾吊1 d后眼轴长(0.512±0.003)cm,尾吊4 d后眼轴长(0.502±0.003)cm,尾吊1周后眼轴长(0.497±0.006)cm,尾吊2周后眼轴长(0.500±0.003)cm,尾吊1个月后眼轴长(0.488±0.008)cm,尾吊2个月后眼轴长(0.506±0.006)cm,尾吊3个月后眼轴长(0.506±0.003)cm;尾吊1 d组除与正常对照组差异无统计学意义(P>0.05)外,与其余各组比较差异均有统计学意义(均为P<0.05),其余各组均较尾吊1 d组眼轴变短;尾吊1个月同尾吊各组差异均有统计学意义(均为P<0.05),眼轴最短;尾吊3个月组同尾吊2个月组差异无统计学意义(P>0.05)。
2.3 血清中IFN-γ、IL-10含量比较根据IFN-γ、IL-10标准品浓度及其吸光度值,以吸光度值为横坐标,标准品浓度为纵坐标,分别建立标准曲线,并求得回归方程,IFN-γ:Y=1228.2X-53.138(R2=0.999),IL-10:Y=39.241X-0.811(R2=0.997)。
各组大鼠血清中IFN-γ、IL-10含量比较见表2。正常对照组与尾吊1 d、4 d、1周、2周、1个月、2个月、3个月组血清中INF-γ含量差异均有统计学意义(均为P<0.05),尾吊各组IFN-γ表达均较正常对照组增加;尾吊1 d组除与尾吊1个月组差异无统计学意义(P>0.05)外,与其余各组差异均有统计学意义(均为P<0.05),IFN-γ含量升至最高;尾吊2周组与其余各组差异均有统计学意义(均为P<0.05),IFN-γ含量降至最低,但仍高于正常对照组;尾吊1个月组除与尾吊1 d组差异无统计学意义(P>0.05)外,与其余各组差异均有统计学意义(均为P<0.05),IFN-γ含量又逐渐升高;尾吊3个月组同其余各组差异均有统计学意义(均为P<0.05),IFN-γ含量基本稳定。
正常对照组与尾吊1 d、4 d、1周、2周、1个月、2个月、3个月组血清中IL-10含量差异均有统计学意义(均为P<0.05),尾吊各组IL-10含量均较正常对照组降低,尾吊1 d组下降明显;尾吊2周组与其余各组差异均有统计学意义(均为P<0.05),IL-10含量升高,但仍低于正常对照组;尾吊1个月组与其余各组差异均有统计学意义(均为P<0.05),IL-10含量又下降;尾吊2个月组同尾吊1个月组、尾吊3个月组差异均有统计学意义(均为P<0.05),尾吊2个月、3个月IL-10含量逐渐增加。

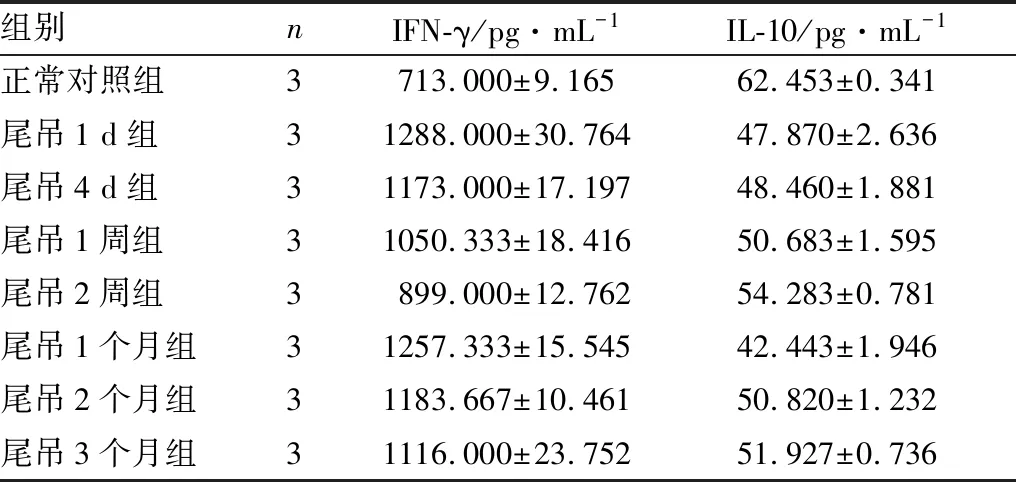
组别nIFN-γ/pg·mL-1IL-10/pg·mL-1正常对照组3713.000±9.16562.453±0.341尾吊1 d组31288.000±30.76447.870±2.636尾吊4 d组31173.000±17.19748.460±1.881尾吊1周组31050.333±18.41650.683±1.595尾吊2周组3899.000±12.76254.283±0.781尾吊1个月组31257.333±15.54542.443±1.946尾吊2个月组31183.667±10.46150.820±1.232尾吊3个月组31116.000±23.75251.927±0.736
3 讨论
失重状态下人体血液向上半身转移,体液重新分配影响头颈部血流;关于失重状态下头颈部血流变化的研究较多,但仍存在异议。有研究表明[10],-6°头低位卧床模拟失重21 d 过程中,双侧椎动脉以及颈内动脉血流参数总体上维持稳态,模拟失重未对椎动脉及颈内动脉血流产生明显影响。但也有研究表明,失重/模拟失重状态下脑血流变化不定,有研究显示脑血流降低[11],有研究则显示脑血流增加[12]。而失重/模拟失重状态下对眼底血流变化研究较少,长期失重状态下眼底血流变化更是未见报道。为此,我们建立失重大鼠模型,连续观察3个月模拟长期微重力环境对大鼠CRA血流动力学的影响及眼轴长度的变化,探讨其变化规律。本研究中CRA的血流动力学指标主要包括PSV、EDV;PSV反映了血管充盈和血流供应强度,EDV反映了远侧组织的血流灌注状态。
本研究发现,尾吊1 d,大鼠PSV较正常对照组下降,随尾吊时间延长,PSV逐渐降低,至尾吊2周时,PSV降至低值;此后PSV部分恢复,至尾吊3个月,PSV下降至最低。本研究结果显示,随尾吊时间延长,EDV逐渐下降,尾吊2周至1个月降至较低值;至尾吊3个月后降至最低。本研究结果表明,长期模拟微重力环境对大鼠眼底血流有明显影响;随尾吊时间延长,眼底血流降低,期间眼底血流部分恢复;眼底血流变化呈负向曲线分布。本研究表明,失重状态下眼底血流总体是降低的,同有关研究相符[13]。但也有研究表明,太空飞行状态下,航天人员眼底血流速度较飞行前是增快的[14]。太空飞行状态下,颅内压增加,为保持眼部血流供应,CRA流速则需要按比例增加。但事实表明,长期失重状态下眼部出现视盘水肿、视网膜棉絮斑、神经纤维层增厚等病变可能与CRA流速不足以适应颅内压致眼部低灌注所致。因此,增加眼部血供对航天员眼部健康至关重要。
本研究中还发现,失重状态亦影响眼轴长度变化。随尾吊时间延长,眼轴渐渐变短,至尾吊1个月时,眼轴最短。本研究结果表明,长期模拟微重力环境对大鼠眼轴长度影响显著;随尾吊时间延长,眼轴变短;眼轴变化呈负向曲线分布,变化较平缓。眼轴长度的变化亦导致了屈光状态的改变。
目前研究显示,航天飞行环境会影响机体的免疫功能,但其具体机制仍未完全阐明[15]。有研究指出,进行长期太空飞行的宇航员,因机体细胞免疫功能降低,导致体内潜伏病毒激活,增加病毒感染风险[16]。为此,本研究分别以IFN-γ、IL-10作为Th1因子、Th2因子代表,通过建立失重大鼠模型,初步探讨长期失重状态下大鼠血清中IFN-γ(Th1因子)及IL-10(Th2因子)表达及变化规律。Th1细胞主要介导与细胞毒性和局部炎症有关的免疫应答,参与细胞免疫及迟发型超敏反应性炎症的形成;Th2细胞的主要功能为刺激B细胞增生并产生抗体,与体液免疫相关。在一定条件下,Th2型细胞因子对Th1型细胞因子的发育与功能起拮抗作用;反之,Th1型细胞因子亦可抑制Th2型细胞因子的表达。Th1细胞和Th2细胞功能的平衡和消长是免疫调节的核心环节,当这个平衡失调并向Th1或Th2转化时,称为Th1/Th2的偏移。
本研究结果显示,尾吊大鼠血清中IFN-γ含量明显增加。尾吊1 d后,大鼠IFN-γ含量明显增加达最高,此后缓慢下降,至尾吊2周降至最低,但仍高于正常对照组,至尾吊3个月后仍保持较高水平;大鼠IFN-γ含量变化呈“M形”正向曲线分布。而尾吊大鼠IL-10含量明显降低,尾吊1 d后,大鼠IL-10含量明显降低,至尾吊3个月后逐渐增加,仍低于正常对照;大鼠IL-10含量变化呈“W形”负向曲线分布。
综上所述,长期模拟微重力环境对大鼠眼底血流及眼轴长度均有影响;随尾吊时间延长,眼底血流流速降低,眼轴长度变短;而尾吊早期大鼠血清中IFN-γ高表达,而IL-10表达下降;随尾吊时间延长,IFN-γ虽下降,但仍高于正常水平,而IL-10表达虽升高,但仍低于正常水平。血清中IFN-γ与IL-10表达相互制约,IFN-γ高表达,IL-10低表达,反之亦然,二者保持动态平衡。
