多形拟杆菌对小鼠急性铅毒性的缓解作用
2019-09-10屈定武翟齐啸于雷雷田丰伟赵建新张灏陈卫
屈定武,翟齐啸,于雷雷,田丰伟,赵建新,张灏,陈卫
(江南大学 食品学院,江苏 无锡,214122)
铅作为一种难以降解的重金属污染物,主要通过摄食(食物)和呼吸[1-2]进入血液循环,最终沉积在软组织和骨骼中,对血液、骨骼、泌尿、免疫和神经[3-7]等多种系统造成破坏。肝脏和肾脏是铅毒性的主要靶器官,铅暴露易导致肝坏死、肾衰竭等多种器官的病变[8-9]。铅对机体造成毒害和损伤的机制包括影响体内必需元素代谢的平衡,破坏线粒体和线粒体膜功能,诱导氧化应激与损伤[10-11]等。其中氧化应激和氧化损伤被认为是铅毒性的主要机制,诸多报道表明,铅会导致机体抗氧化防御系统受到抑制,促使体内产生大量活性氧,并导致脂质过氧化和氧化性DNA损伤,最终损害机体健康。
长期铅暴露后会引起肠道炎症、影响肠上皮细胞紧密连接蛋白的表达[12],对胃肠道与外环境(肠腔内容物)之间的物理屏障及免疫屏障造成损伤。而受损的肠道屏障功能进一步加速了肠腔内金属铅向机体的渗漏和吸收[13]。哺乳动物肠道微生物的平衡被认为是维持宿主健康的一个重要因素。在重金属吸收和排泄的过程中,肠道菌群会不可避免地与重金属直接接触,作为肠道屏障的一部分,肠道菌群很可能在铅等重金属的吸收、分布、排泄和毒性过程发挥着重要调节作用。已有研究表明,肠道微生物限制了机体对重金属的吸收,缓解了有毒金属暴露对小鼠的侵害作用[13],同时,重金属本身亦会对肠道菌群产生毒害作用,过往报道表明汞[14]、镉[15]和铜[16]均会影响肠道菌群的组成。GAO等通过16S rRNA焦磷酸测序技术研究了慢性铅暴露对小鼠肠道细菌组成的影响,结果表明,13周口服10 mg/L的Pb会改变肠道菌群轨迹及系统发育多样性[17]。
诸多体内外实验发现,多种肠道益生菌如植物乳杆菌CCFM8661[18]、魏斯氏乳杆菌、罗伊氏乳杆菌21008[19]在体外具有吸附铅的能力,并在降低机体氧化应激水平,表明它们具有缓解铅毒性的潜力[20]。目前来说,益生菌主要源自于乳杆菌、双歧杆菌属,而其他肠道菌如阿克曼氏菌、柔嫩梭菌、拟杆菌属被报道亦具有多种益生功能,有望成为下一代益生菌的成员[21-23],并且在调节重金属的生物可利用性和毒性方面也可能起着重要作用,最近一项研究表明,肠道厌氧菌普拉氏梭杆菌在肠道中定殖后能缓解无菌小鼠的急性砷毒性[24]。本实验室前期研究结果表明,急性铅暴露后,发现肠道中拟杆菌显著减少。拟杆菌作为人类肠道的主要细菌之一,广泛分布在哺乳动物体内,在糖尿病[25]、肥胖[26]等疾病中发挥有益作用,被报道具有免疫调节等生理功能[27-28]。在DSS诱导的结肠炎小鼠模型中,拟杆菌抑制促炎细胞因子IL-6和TNF-α的表达和增强抗炎IL-10的表达,从而改善结肠炎症状[29]。多形拟杆菌作为一种肠道常驻菌,能够影响机体代谢,降解宿黏液多糖等难被宿主消化的营养物质[30],产生乙酸、丙酸等短链脂肪酸。此外,该菌通过促进杯状细胞分化可以调节结肠细胞传导信号,在体内肠黏液屏障的调节中发挥着重要作用[31-32]。因此,本研究通过急性铅暴露模型,探究多形拟杆菌FTJS-8-K对小鼠对铅的吸收及生理毒性的影响。
1 材料与方法
1.1 材料与试剂
还原性谷胱甘肽、丙二醛及蛋白定量测定试剂盒:南京建成生物技术公司;DX-4000-FITC:美国Sigma公司;脑心浸肉汤培养基(brain heart infusion broth,BHI):青岛海博生物有限公司;乙酸、丙酸、异丁酸、丁酸、戊酸(色谱纯):中国国药化学试剂公司(中国上海);VK1、氯化血红素:上海生物工程有限公司;多形拟杆菌FTJS-8-K、发酵乳杆菌(Lactobacillusfermentum)2016 2-3:江南大学食品生物技术中心菌种保藏库;普拉氏梭杆菌(Faecalibacteriumprausnitzii)A2-165:日本微生物菌种保藏中心。
1.2 仪器与设备
GC-MS,日本岛津公司;原子吸收分光光度计,美国Varian公司;Multiscan Go多功能酶标仪,美国Thermo公司;Whitley DG250 厌氧工作站,英国DWS公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;Milli-Q水净化系统,密理博(中国)有限公司;水平琼脂糖凝胶电泳系统、Bio-Rad S1000 PCR仪,美国伯乐(Bio-Rad)公司;Nano Photometer超微量紫外分光光度计,德国IMPLEN公司;BC-5000 Vet型全自动生化分析仪,深圳迈瑞医疗有限公司;MiSeq第二代高通量测序仪,美国Illumina公司。
1.3 多形拟杆菌的活化培养
将在-80 ℃甘油保存的多形拟杆菌在BHI(含体积分数0.001% VK1和氯化血红素)固体平板进行划线接种,菌种活化后,按2%的接种量接种至BHI液体培养基中,连续活化2代后待用。按 10%的接种量将活化的菌液接入600 mL BHI液体培养基中,37 ℃恒温扩大培养18 h,4 ℃、8 000×g离心15 min,弃去上清液,菌体以无菌PBS洗涤2次,按照前述条件再次离心,收集的菌体重悬于3%(体积分数)的甘油溶液中,-20℃储存备用,同时对菌液进行活菌计数。
1.4 动物实验设计
本研究采用的是购自上海斯莱克公司的C57BL/6小鼠(雄性,6周龄,SPF级,体重16~18 g)。伦理编号为JN.No20181030c0301110,18只小鼠随机分成空白组、染铅组和多形拟杆菌干预组。每组6只,分笼饲养,饲养温度为(23±2)℃,相对湿度为(50±10)%,小鼠自由饮食,采用国家标准啮齿类动物饲料饲养。染铅组一次性灌胃醋酸铅液(每天灌胃0.2 mL,灌胃剂量为1/5 LD50,即1 304 mg Pb2+/kg体重)[33-34],铅暴露1 h后,干预组灌胃多形拟杆菌甘油溶液(每天灌胃0.2 mL,活菌数为1×109CFU的菌悬液),对照组和染铅组灌胃等量3%(体积分数)甘油。铅暴露和干预持续3 d,每天1次。第1次铅暴露后,分别收集小鼠0、4、8、12、24 h的粪便和尿液,4 d后,所有小鼠进行乙醚麻醉,处死小鼠,采集组织及血液样品待测。
1.5 小鼠组织、血液、粪便和尿液中铅元素含量的测定
取适量湿组织、血液、粪便和尿液样品,将其转移至消解罐内,加入适量浓HNO3,在微波消解系统中进行消化,定容。使用火焰或石墨原子吸收分光光度计测定样品中铅元素含量。
1.6 小鼠血常规检测
将全血与抗凝剂充分混匀,在血液细胞分析仪分析系统中选择动物类型为小鼠,血样模式为全血,分析仪的模式为CBC+DIFF(全血细胞计数+白细胞分类)。全血检测的细胞类型为红细胞相关指标8项、白细胞相关指标11项、血小板相关指标4项,共计23项。
1.7 小鼠血清、组织中生理指标的测定
小鼠血清中碱性磷酸酶(alkaline plospatase,ALP)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活性和肌酐(creatinine,Cre)、尿素(Urea)含量,肝肾组织丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)含量,均参照南京建成试剂盒说明书进行测定。
1.8 小鼠粪便微生物总DNA的提取和肠道菌群高通量测序
采集小鼠粪便置于灭菌的2 mL离心管中,利用Fast DNA Spin Kit for Feces试剂盒提取粪便中微生物的总DNA。以16S V3-V4区特异性扩增引物进行PCR扩增,按照QIA Quick Gel Extraction Kit胶回收试剂盒说明书进行目的条带胶回收,根据Pico Green荧光染料的定量结果,按等质量浓度混合样品,构建16S V3-V4区终文库。利用Illumina Miseq高通量测序平台进行高通量测序。剔除掉序列长度<200 bp、引物序列、不能拼接的单序列,按照重叠碱基>10 bp且无错配的序列进行拼接。将相似度>97%序列进行OTUs(operational taxonomic unit)聚类,过滤掉含量<0.01%OTUs,再将剩下的OTUs与Ribosomal Database Project(RDP)数据库进行比对注释。将注释后OTUs进行生物信息学分析,包括Shannon和Chao 1等Alpha多样性指数。
1.9 小鼠肠道中紧密蛋白基因表达量的测定
取小鼠小肠和结肠中段组织(约0.05 g),在液氮下研磨至粉末,加入1 mL Trizol裂解液。利用氯仿和异丙醇提取RNA;凝胶电泳检测RNA完整性后,使用Takara公司试剂盒进行反转录。最后以反转录得到的cDNA为模板,以β-肌动蛋白(β-actin)作为内参基因,采用SYBR Green荧光染料嵌合法检测ZO-1、ZO-2、Occludin和Claudin-1 mRNA。基因序列参照过往文献报道[35]。以 2-△△CT法计算分析数据,每次每个样本重复3次。
1.10 小鼠结肠内容物短链脂肪酸含量的测定
参照过往文献报道的方法[36],取适量小鼠结肠内容物,冻干称重,提取短链脂肪酸,使用GC-MS检测短链脂肪酸(乙酸、丙酸、异丁酸、丁酸及戊酸)的含量。
1.11 铅吸附性质的测定
铅吸附性质测定根据过往文献报道的方法[18],稍有变动。将活化好的菌株按2%接种量接种到2 L液体培养基中,37℃条件下培养至对数期,8 000×g离心15 min,用超纯水清洗沉淀2遍,重复离心以获得菌体。将醋酸铅溶于超纯水中使溶液中铅离子的终浓度达到50 mg/L,并将菌体重悬于该醋酸铅溶液中使菌体浓度达到1 g/L湿菌体重量。将菌悬液pH调节至6.0后,将以上样品置于37 ℃,于恒温摇床上以220 r/min转速培养1 h,8 000×g离心15 min,取上清液,使用火焰原子吸收分光光度计测定铅浓度。并以发酵乳杆菌2016 2-3、普拉氏梭杆菌A2-165作为对照菌株进行上述吸附实验。菌株对铅的吸附能力按公式(1)计算:
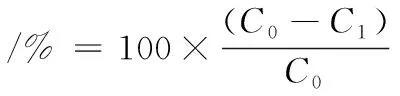
(1)
式中:其中C0和C1分别代表初始体系和吸附后上清液中铅浓度。
1.12 统计与分析
统计分析图通过GraphPad Prism 6和R语言完成。所有统计分析采用SPSS(23版)。计量资料以平均值±标准误差表示,采用T检验进行组间两两比较,采用单因素方差分析检测多组数据,利用Mann-Whitney配对算法分析了分组样本的相对丰度,P< 0.05为差异有统计学意义。
2 结果与分析
2.1 多形拟杆菌对小鼠常规生理指标的影响
连续3 d给小鼠灌胃醋酸铅后,小鼠体重变化及脏器指数如图1及表1所示。与空白组相比,染铅组小鼠体重显著持续下降,肝、肾和脑系数显著增加;灌胃多形拟杆菌后小鼠体重有所恢复,同时改善了由于急性铅暴露引起的肝、肾和脑肿大。
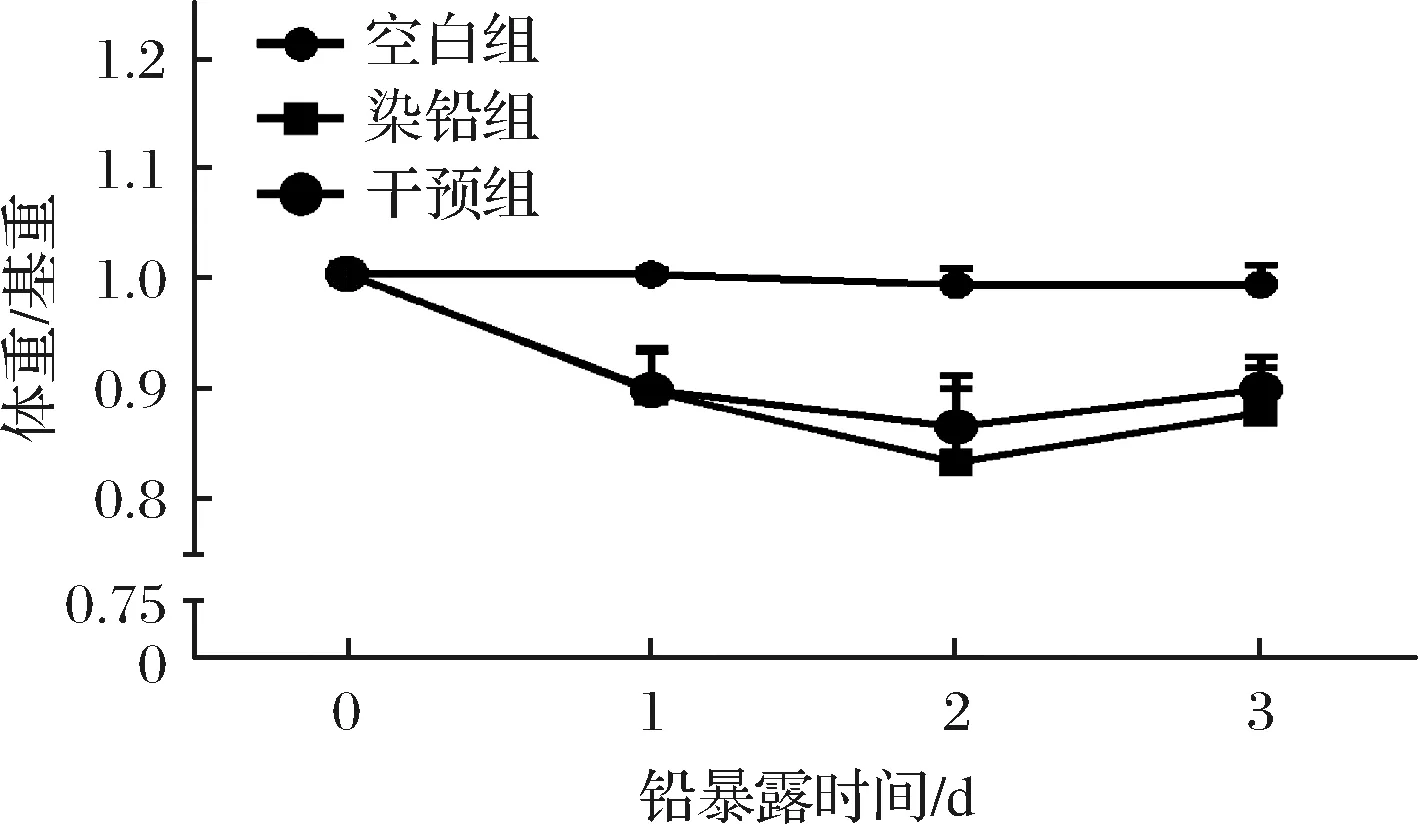
图1 多形拟杆菌对急性铅暴露小鼠体重的影响Fig.1 Effect of B.thetaiotaomicron on body weight of acute lead exposed mice
表1 多形拟杆菌对急性铅暴露小鼠脏体比值的影响Table 1 Effect of B.thetaiotaomicron on visceral body ratio of acute lead exposed mice
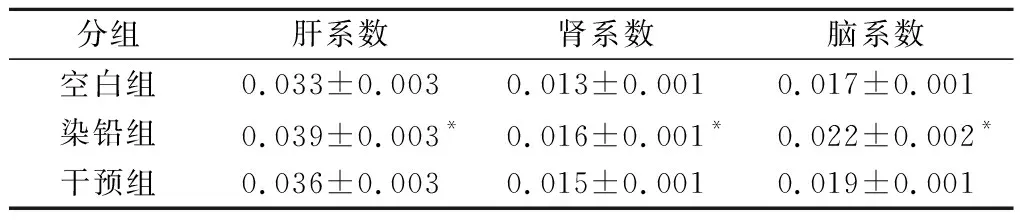
分组肝系数肾系数脑系数空白组0.033±0.0030.013±0.0010.017±0.001染铅组0.039±0.003*0.016±0.001*0.022±0.002*干预组0.036±0.0030.015±0.0010.019±0.001
注:*表示与空白组相比差异显著(P< 0.05);**表示与空白组相比差异极显著(P<0.01)。下同。
2.2 多形拟杆菌对小鼠血液、粪便及组织中铅含量的影响
小鼠尿液及粪便中铅排出量动态变化如图2所示,在第一次铅暴露后的12 h以内,小鼠粪便中铅含量持续上升,而在接下来12 h内开始下降;而尿液中铅含量在铅暴露后24 h内持续缓慢上升。多形拟杆菌干预后,粪便铅含量显著升高,表明多形拟杆菌通过促进粪便铅的排泄,从而减小了机体对铅的吸收。尿液中铅含量显著下降亦表明肾脏中铅蓄积减少。
血液、组织中铅含量是评价铅毒性的重要指标,可以反映机体的铅中毒程度,如图3所示,在本研究中,急性铅暴露结束后,染铅组小鼠的血液、肝、肾和十二指肠中的铅含量显著高于空白组(P< 0.05),而灌胃多形拟杆菌显著降低了血液及肝脏、肾脏、十二指肠中的铅含量。

a-粪便;b-尿液图2 多形拟杆菌对急性铅暴露小鼠不同时间点粪便及尿液中铅含量的影响Fig.2 Effect of B.thetaiotaomicron on feces and urine lead content of acute lead exposed mice at different times注:*表示不同组之间的差异显著(P<0.05);**表示不同组之间的差异极显著(P<0.01)。下同。
2.3 多形拟杆菌对急性铅暴露小鼠肝肾氧化应激及功能的影响
如表2所示,急性铅暴露后,肝脏和肾脏中MDA水平上升、GSH水平下降;相比于造模组,多形拟杆菌干预后恢复了上述氧化应激指标的变化,说明该菌对急性铅暴露导致的组织氧化损伤具有保护作用。
血清ALT和AST是评价肝功能的重要指标,血清中UREA、CREA是评价肾功能的重要指标。急性铅暴露后,血清中ALT、AST水平显著上升,血清中Urea、Cre水平无明显变化(如表3所示)。急性铅暴露对肝脏的损伤先于肾脏,发生在暴露初期,并未达到引发肾脏病变的毒性剂量,这与前人研究结果相似[35],故而本实验中只检测到肝功能的显著变化却没有检测到肾功能的显著变化。灌胃多形拟杆菌在一定程度上恢复了上述生理指标,表明了多形拟杆菌对急性铅毒性的保护作用。
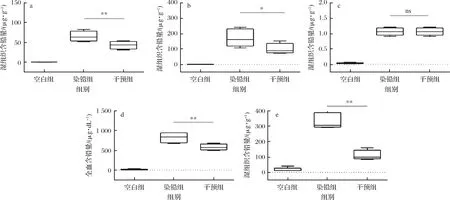
a-肝;b-肾;c-脑;d-血;e-十二指肠图3 多形拟杆菌对急性铅暴露小鼠血液、组织及粪便中铅含量的影响Fig.3 Effect of B.thetaiotaomicron on lead content in blood and tissue of acute lead exposed mice注:ns表示无显著差异。
表2 多形拟杆菌对急性铅暴露小鼠组织中MDA、GSH含量的影响Table 2 Effect of B.thetaiotaomicron on the levels of MDA and GSH in the tissues of acute lead exposed mice

组别肝脏肾脏GSH/(mg·g-1 蛋白)MDA/(nmol·g-1 蛋白)GSH/(mg·g-1 蛋白)MDA/(nmol·g-1 蛋白)空白组4.68±0.3441±115.01±0.4339±9染铅组0.96±0.19** 136±25**1.21±0.22**120±18** 干预组2.30±0.78 94±16##2.24±0.7872±14#
注:#表示与染铅组相比有显著差异(P< 0.05);##表示与染铅组相比有极显著差异(P<0.01)。

表3 多形拟杆菌对急性铅暴露小鼠血清生化指标的影响Table 3 Effect of B.thetaiotaomicron on serum biochemical changes of acute lead exposed mice
2.4 多形拟杆菌对急性铅暴露小鼠血液学参数的影响
如表4、表5所示,急性铅暴露后,血红蛋白含量显著下降,血小板含量、嗜中心粒细胞数量显著上升(P< 0.05),其他血液参数基本无显著变化。多形拟杆菌干预之后,相比于造模组,基本血细胞参数和血液免疫学参数均无显著变化。

表4 多形拟杆菌对急性铅暴露小鼠基本血细胞参数的影响Table 4 Effect of B.thetaiotaomicron on basic hematological parameters of acute lead exposed mice
注:RBC-红细胞;HGB-血红蛋白浓度;MCV-红细胞平均体积;MCHC-平均红细胞血红蛋白浓度;RDW-红细胞分布宽度;CV-变异系数;SD-标准差;PLT-血小板。

表5 多形拟杆菌对急性铅暴露小鼠血液免疫学参数的影响Table 5 Effect of B.thetaiotaomicron on haematogenic immunity paramaters of acute lead exposed mice
注:Neu-嗜中性粒细胞;Lym-淋巴细胞;WBC-白细胞;Mon-单核细胞;Bas-嗜碱性粒细胞;Eos-嗜酸性粒细胞。
2.5 多形拟杆菌对急性铅暴露肠道菌群多形性和组成的影响
2.5.1 多形拟杆菌对急性铅暴露小鼠肠道α多样性的影响
α多样性指数值越大,表示菌群多样性和均匀度越高,菌群多样性指数比较结果如图4所示,急性铅暴露后,染铅组小鼠Chao 1和Shannon指数显著下降,表明染铅后小鼠肠道菌群多样性下降,灌胃多形拟杆菌后,以上系数得到显著恢复。
2.5.2 多形拟杆菌对急性铅暴露小鼠肠道关键菌属相对丰度的影响
在属(genus)水平上,急性铅暴露后,肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、埃希氏杆菌属(Escherichia)和葡萄球菌属(Staphylococcus)的相对丰度显著增加(P<0.05),Rikenellaceae__unclassified、Lachnospiraceae__unclassified、S24-7__unclassified、瘤胃球菌属(Ruminococcus)和拟杆菌属的相对丰度显著下降(P< 0.05),多形拟杆菌干预后,与染铅

a-Chao 1指数;b-Shannon指数图4 多形拟杆菌对急性铅暴露小鼠肠道菌群α多样性的影响Fig.4 Effect of B.thetaiotaomicron on α diversity index of gut microbiota acute lead exposed mice
组相比,肠杆菌属、假单胞菌属、埃希氏杆菌属和葡萄球菌属等条件致病菌的相对丰度显著下降,而肠道中瘤胃菌科、毛螺菌科、拟杆菌等产酸菌的含量得到一定程度的恢复(图5)。
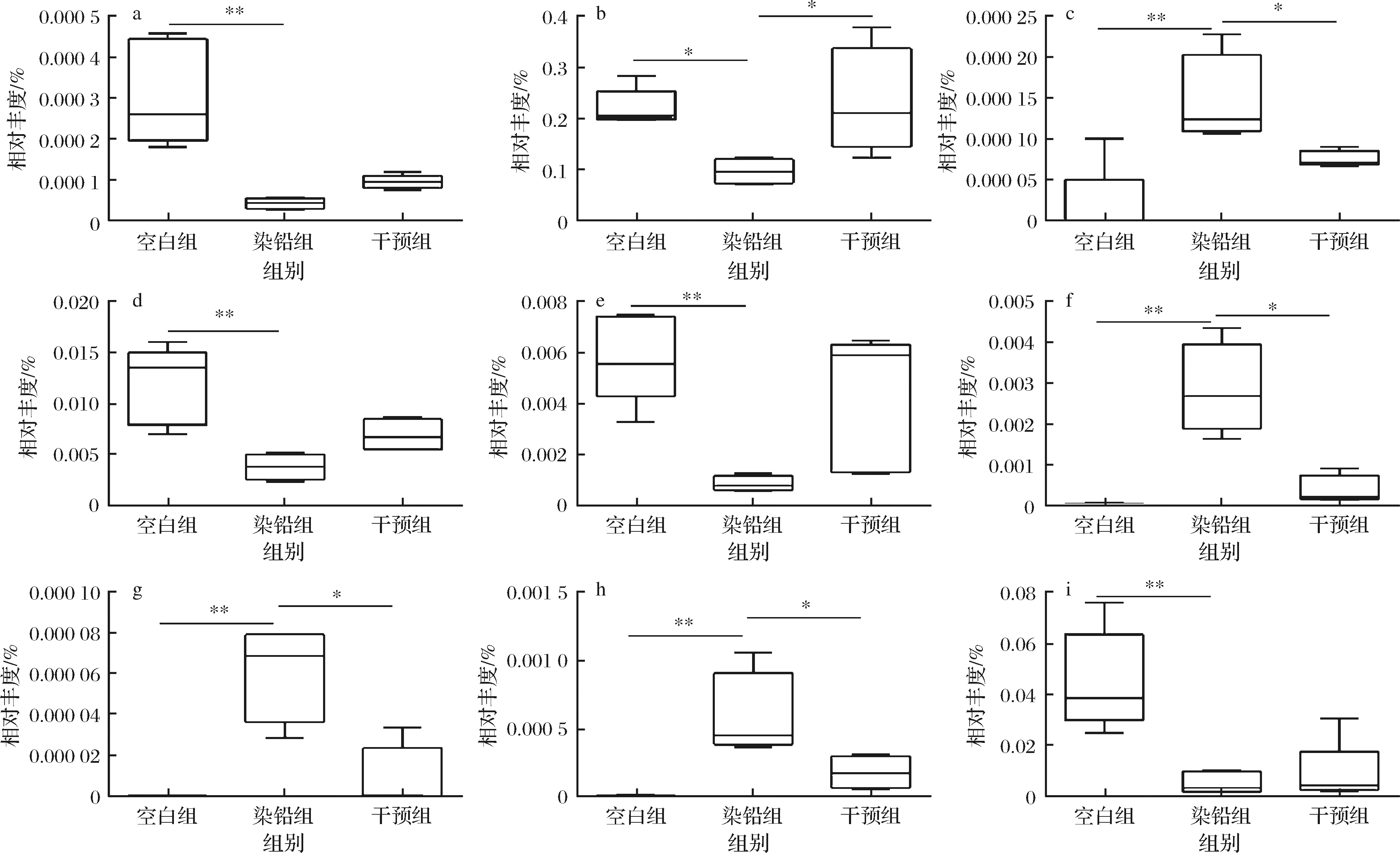
a-Bacteroidales_Other;b-S24-7_unclassified;c-Staphylococcus;d-Lachnospiraceae[Ruminococcus];e-Ruminococcus;f-Enterobacter;g-Escherchiar;h-Pseudomonas;i-Rikenellaceae_unclassfied图5 多形拟杆菌对急性铅暴露小鼠肠道菌群中关键菌属的影响Fig.5 Effect of B.thetaiotaomicron on relative abundance of key bacterial genera in the intestinal flora in acute lead exposed mice
2.6 多形拟杆菌对急性铅暴露小鼠肠道紧密连接蛋白的影响
急性铅暴露24 h后,小鼠空肠与结肠上皮细胞紧密连接蛋白ZO-1、ZO-2、Occludin和Claudin-1 mRNA相对表达量明显下降(P<0.05)。说明急性铅毒性对肠上皮紧密连接功能造成了较大影响。多形拟杆菌干预之后,相比于造模组,空肠与结肠上皮细胞紧密连接蛋白相对表达量明显增加(P<0.05),表明灌胃多形拟杆菌可以防止铅毒性对紧密连接蛋白的损伤(图6)。
2.7 多形拟杆菌对急性铅暴露小鼠肠道短链脂肪酸含量的影响
如图7所示,相比于空白组,染铅组小鼠结肠内容物中总短链脂肪酸(乙酸、丙酸、丁酸、异丁酸及戊酸)的产生量显著减少(P<0.01),多形拟杆菌干预之后,相比于染铅组,结肠内容物中总短链脂肪酸的产生量显著增加(P<0.05),其中乙酸含量显著增加(P<0.05)。
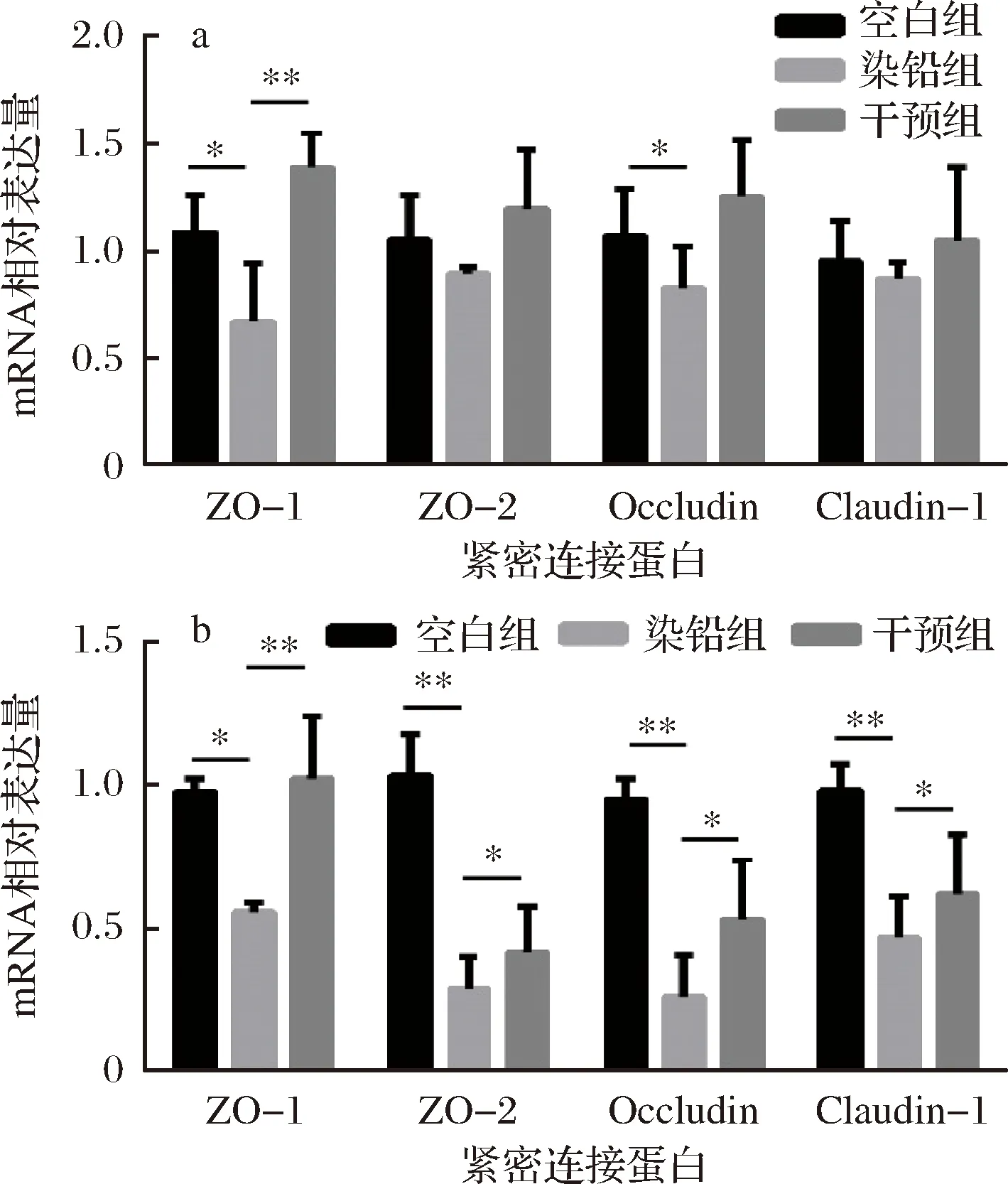
a-结肠;b-空肠图6 多形拟杆菌对急性铅暴露小鼠肠道紧密连接蛋白表达量的影响Fig.6 Effect of B.thetaiotaomicron on mRNA expression of tight junction proteins in representative sections of colon andterminal jejunum of acute lead exposed mice
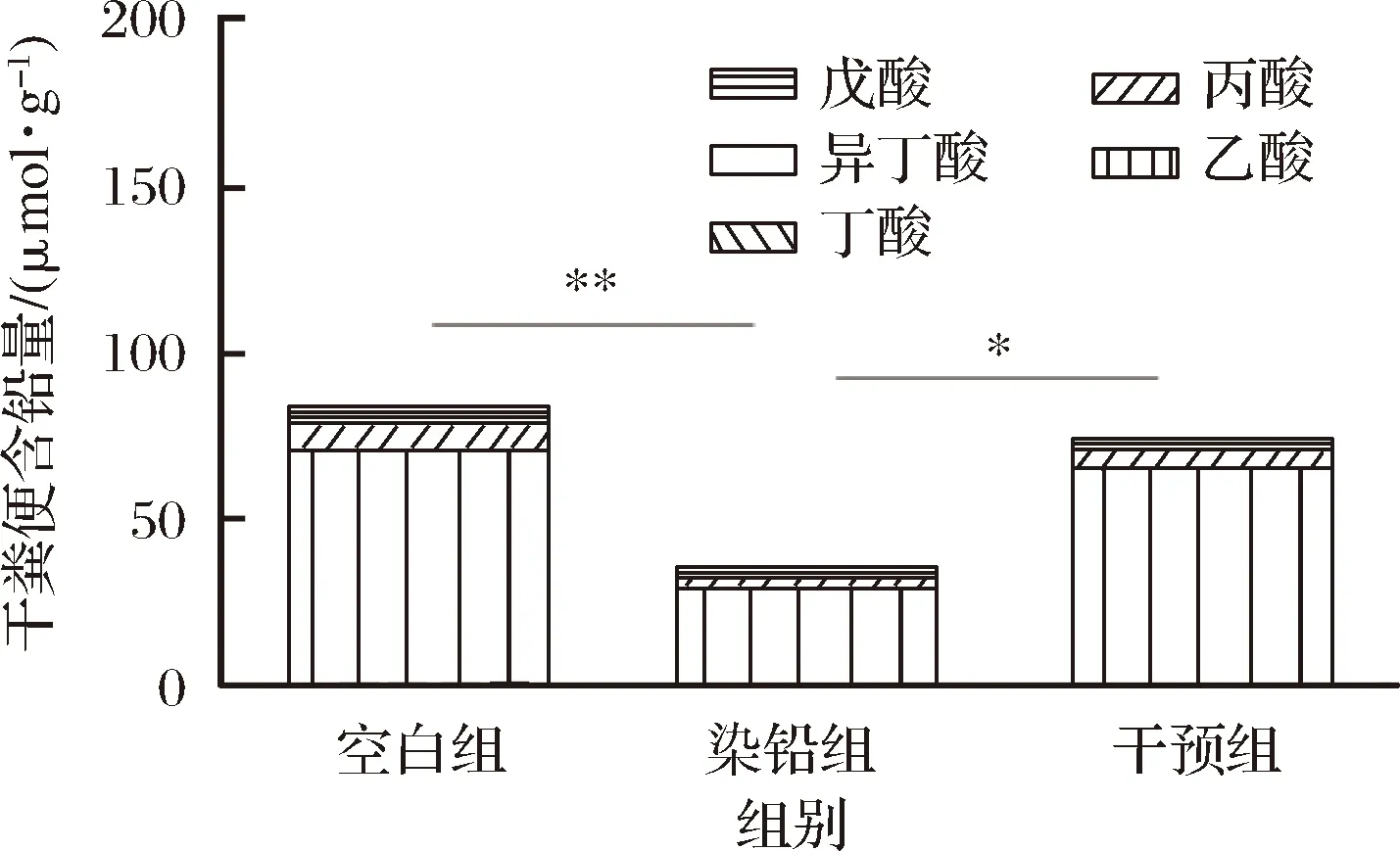
图7 多形拟杆菌对急性铅暴露小鼠肠道中短链脂肪酸含量的影响Fig.7 Effect of B.thetaiotaomicron on the content of intestinal SCFAs of acute lead exposed mice
2.8 多形拟杆菌对铅的吸附性质
如表6所示,测定多形拟杆菌FTJS-8-K在始铅质量浓度为50 mg/L的体系中对铅的吸附能力,以铅的移除率表示,发现其吸附率高于发酵乳杆菌2016 2-3,但低于普拉氏梭杆菌A2-165,此菌作为下一代益生菌,最近被报道均有缓解急性砷毒性的作用[24],以上结果表明多形拟杆菌或其代谢产物对铅离子具备一定的吸附能力。
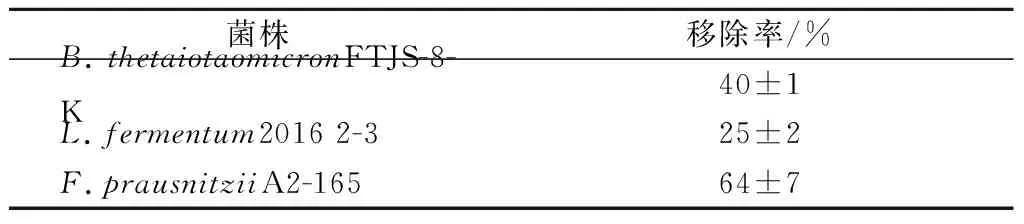
表6 多形拟杆菌对铅的吸附能力Table 6 Pb absorption of B.thetaiotaomicron
3 讨论
本实验利用动物模型分析多形拟杆菌对小鼠急性铅毒性的影响,急性铅暴露导致体内氧化应激增加,氧化还原电位升高,具体表现在肝肾组织中GSH含量显著下降,MDA含量显著上升,并且导致肠道通透性增加,肠道中条件致病菌大量增殖,短链脂肪酸含量下降,多形拟杆菌干预后促进了铅从粪便中排出,限制了铅在组织及血液中的蓄积,减轻了组织中氧化损伤,改善了肠道微环境,保护了肠道屏障,促进肠道中短链脂肪酸的生成,缓解了急性铅暴露对机体组织造成的毒性。
灌胃多形拟杆菌后,多形拟杆菌菌体本身对铅离子具有一定的吸附能力,在机体吸收之前抢先吸附铅离子,促进了粪便中铅元素的排出,从而缓解了铅对机体造成的损伤。同时,有文献报道该菌在恶劣环境中具有较强的定殖能力[37],在一定程度上抑制了葡萄球菌、肠杆菌等条件致病菌的侵袭和定殖,多形拟杆菌在肠道中还具有抗炎作用,改善的肠道微环境也促进肠道中拟杆菌、瘤胃球菌属和毛螺菌等的增殖,强化的生物屏障阻止了肠腔内重金属铅向机体渗漏和转运,限制了铅对机体健康产生更大的危害。
肠道微生物组成的改变导致代谢产物改变,急性铅暴露小鼠结肠内容物中短链脂肪酸含量显著下降,也会进一步影响机体健康,这可能是由于产酸微生物遭到破坏引起的,丁酸盐是肠道上皮细胞的主要能量来源[38],丁酸盐含量的降低会导致能量供应不足,进而导致肠道运输、蠕动和合成等生理功能受损。有文献报道产丁酸菌主要分属于瘤胃菌科、毛螺菌科、理研菌科以及拟杆菌的一些成员,多形拟杆菌在一定程度上促进了瘤胃球菌、S24-7和Rikenellaceae等菌的生长,增强肠道中短链脂肪酸的分泌,从而影响紧密连接蛋白的表达,增强肠道屏障功能[39-40];多形拟杆菌和F.prausnitzii在体内和体外均是代谢互补的,多形拟杆菌能够降解宿主黏液多糖和生产乙酸盐,从而促进产丁酸菌如F.prausnitzii的增殖[41],F.prausnitzii利用由多形拟杆菌产生的醋酸盐,反过来产生丁酸盐,从而触发包括调节黏蛋白的合成和分泌的诸多效应信号[32, 42]。由肠道杯状细胞分泌的黏蛋白、水及无机盐等形成的肠黏膜屏障在维持宿主与微生物体内稳态中起关键作用,能够使肠上皮细胞免受肠腔内容物及异源物质的损害[43]。多形拟杆菌通过修饰体内杯状细胞和黏蛋白糖基化调节肠黏液屏障。有文献报道该菌能诱导无菌大鼠结肠黏蛋白基因表达,增强杯状细胞分化[32]。在另一种小鼠模型中,拟杆菌通过调节紧密连接蛋白和细胞因子表达来强化上皮屏障[44]。
多形拟杆菌参与宿主物质代谢、促进宿主营养物质的消化吸收,在调节免疫、维持正常肠道生理功能等多个方面发挥重要作用,因此,多形拟杆菌有望成为下一代益生菌,本研究表明多形拟杆菌可以促进铅从粪便排出,缓解氧化应激、保护肠道屏障,对机体急性铅毒性具有缓解作用。利用特定肠道微生物调节重金属暴露引起的机体损伤,或可为缓解食源性重金属暴露对机体健康造成的危害提供新的思路和解决方法。但目前对多形拟杆菌的安全性评价尚未进行,在食品中得到实际应用还有待研究,并且其生长条件需严格厌氧,同时,该菌的培养条件尚不明确,还未开发出专用的食用级培养基,需要我们进一步对多形拟杆菌的使用安全性和培养条件进行探讨。
