68Ga标记药物研究进展
2019-09-10郭志德张现忠
郭志德,张现忠,杜 进
(1.中国原子能科学研究院 同位素研究所,北京 102413;2.厦门大学 分子影像暨转化医学研究中心,福建 厦门 361102;3.中国同辐股份有限公司,北京 100045)
正电子发射型计算机断层显像(positron emission tomography, PET) 是重要的影像检测手段,通常其显像所用放射性核素半衰期(T1/2)较短且依赖于加速器生产[1-3]。如加速器生产的18F,其T1/2为110 min。其他PET核素如11C、13N、15O等也依赖于加速器,限制了核素的使用范围。68Ge/68Ga正电子核素发生器可有效解决该问题。68Ga是最早运用于临床医学的正电子核素之一,可追溯到50多年前[4-5],围绕68Ga核素的研究也越来越多。以商业化68Ge/68Ga发生器为基础,68Ga的标记策略、纯化方法得到了不断改进,将68Ga核素通过双功能螯合剂连接到不同的生物分子(靶向分子、多肽、蛋白、纳米颗粒等)上,可赋予探针不同的功能。由于获得途径和标记手段与99mTc核素类似,研究人员希望68Ga标记药物能够广泛应用于正电子显像领域。关于68Ga-DOTA-TOC等显像剂在临床实验中的研究已有多篇文献详细阐述[6-7],本文主要介绍68Ga的产生途径、用于68Ga标记的双功能螯合剂及68Ga标记的放射性药物的临床前研究进展。
1 68Ga发生器
68Ga可以通过68Ge/68Ga发生器获得,具有较高的淋洗频率。母体核68Ge可以利用高能加速器发生69Ga(p,2n)68Ge反应获得,使用寿命较长,T1/2为287 d;子体核68Ga的T1/2较短(68.3 min),作为PET显像核素可有效降低患者所受辐射剂量。
Gleason最早提出了68Ge/68Ga发生器,并利用乙酰丙酮环己烷从68Ge中提取了68Ga核素[8]。色谱型68Ge/68Ga发生器基于Al2O3-EDTA体系,通过Al2O3吸附68Ge,再用EDTA 淋洗68Ga形成Ga-EDTA。但是68Ga与EDTA的络合物十分稳定,需要通过离子交换法或溶剂萃取法得到离子型的68Ga,繁琐的提取步骤限制了68Ga的使用。Kopecky等[9]采用HCl淋洗Al2O3可直接得到离子型的68Ga,促进了68Ga的进一步应用[10]。后期发展中,柱填充材料及淋洗剂的选择更加注重化学分离的特异性及稳定性。68Ge/68Ga发生器使用的无机柱填充染料及淋洗剂包括SnO2(1 mol/L HCl)、TiO2(1 mol/L HCl)、CeO2(0.1 mol/L HCl)、ZrO2(0.1 mol/L HCl)、Zr-Ti陶瓷体(0.5 mol/L NaOH, 4 mol/L HCl, acetate)及Zirconia纳米 (0.01 mol/L HCl);有机柱填充材料及淋洗剂包括N-methylglucamine(0.1 mol/L HCl, NaOH, citrate)、Pyrogalci-fprmaldetryde (0.3 mol/L HCl)、Nanoceria-polyacrylonitride (0.1 mol/L HCl)等。
几种常用商业化的68Ge/68Ga发生器列于表1,对柱填料、淋洗剂、68Ge漏穿、洗出液体积、化学杂质、柱子重量进行比较[11]。由于广泛采用不同浓度的HCl溶液作为淋洗剂,68Ge/68Ga发生器酸性过高及流出体积过大,可采用微阳离子交换柱等方法控制流出液酸度及体积。
2 68Ga标记化学
溶液中的68Ga以68Ga3+形式存在,可通过双功能螯合配体将68Ga3+连接到化学结构中。68Ga的配位性质可简化标记和纯化步骤,有利于药盒化。螯合配体的化学结构涉及N杂环、多元胺、多羧基化合物。常见的68Ga配位基团是以N为配位原子的环多胺多羧基和链多胺多羧基化合物及其衍生物,配位数可为四、五、六多种。几种常见链状及环状的螯合剂结构示于图1[12-17]。其中1,4,7-三氮杂环壬烷-1,4,7-三乙酸(NOTA)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)、二亚乙基三胺五乙酸(DTPA)等多氮类配体,选择性高,可修饰性好,广泛应用于68Ga标记研究中。研究最多的68Ga配位基团为DOTA,代表性的标记药物有68Ga标记的靶向生长激素抑制素受体的一系列探针,如68Ga-1,4,7,10-四氮杂环十二烷-N,N,N,N-四乙酸-D-苯丙氨酸1-酪氨酸3-奥曲肽(68Ga-DOTA-TOC)、68Ga-1,4,7,10-四氮杂环十二烷-N,N,N,N-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸-8-奥曲肽(68Ga-DOTA-TATE)、68Ga-1,4,7,10-四氮杂环十二烷-N,N,N,N-四乙酸-1-萘丙氨酸-奥曲肽(68Ga-DOTA-NOC)等[18]。但DOTA的环半径较大,68Ga-DOTA配位形式并不稳定;且用DOTA标记68Ga时需要加热缩短标记时间,不利于对多肽、蛋白、抗体等温度敏感的生物分子进行标记。NOTA与68Ga的配位条件相对温和,反应时间较短,形成的68Ga-NOTA配合物热力学稳定性高于68Ga-DOTA,故NOTA发展成为性质优良的68Ga配位基团并广受关注。通过68Ga-NOTA配位的代表性标记化合物有靶向整合素ανβ3受体的68Ga-NOTA-RGD2(NOTA修饰的RGD二聚体),ανβ3和胃液素释放肽受体(gastrin-releasing peptide receptor,GRPR)双靶向的68Ga-NOTA-RGD-BBN(NOTA修饰的RGD-蛙皮素融合肽)等。DTPA除了可以标记单光子核素99mTc与111In之外,也可进行68Ga标记。代表性标记物有低密度脂蛋白(68Ga-DTPA-LDL)和半乳糖基血清蛋白(68Ga-DTPA-GSA)等[19-20]。

表1 商业化68Ge/68Ga发生器[11]Table 1 Examples of commercial 68Ge/68Ga generators[11]

图1 常见的用于放射性核素68Ga标记的开链及大环多胺双功能螯合剂[12-17]Fig.1 Chemical structures of chelators for 68Ga labeling[12-17]
虽然DOTA与NOTA使用广泛,但其他金属离子对其干扰较大。Jakub等[17]验证了Zn2+、Cu2+、Fe3+、Al3+、Ti4+及Sn4+等金属对68Ga3+标记NOTA、DOTA、TRAP-NOPO(三氮杂环壬烷-次膦酸类螯合物)的影响。结果表明,与TRAP及NOPO相比,NOTA及DOTA受其他金属离子影响较大,在低浓度金属离子存在时标记率明显下降;在亚磷酸盐类型的结构(TRAP、NOPO)中,Zn2+和Ga3+能够快速地进行交换,提供了一种可再生的标记方法,认为TRAP与NOPO是进行68Ga标记的理想结构。
3 68Ga标记探针及其研究进展
3.1 小分子探针
3.1.1奥曲肽靶向探针
Asti等[21]报道了一种有效的纯化方法并用于68Ga-DOTA-TOC的制备,该纯化技术也可用于其他68Ga标记的DOTA修饰的多肽制备。DOTA修饰的一系列奥曲肽类似物68Ga-DOTA-TOC、68Ga-DOTA-TATE及68Ga-DOTA-NOC(图2)是目前研究最多的一类68Ga标记化合物[6,23-25]。该类探针主要用于诊断生长激素抑制素受体高表达的肿瘤,与111In标记的同类物质相比更具优势。其制备过程简单,核素获取容易,半衰期适宜,PET显像分辨率也优于SPECT显像。Hofmann等[26-27]研究发现68Ga-DOTA-TOC用于检测神经内分泌瘤时表现优异,在8个病例中,68Ga-DOTA-TOC的病灶检出率达到100%且具有高的肿瘤显像对比度,而111In标记的奥曲肽病灶检出率只有85%。
3.1.2RGD靶向探针
肿瘤的生长、侵袭等行为依赖血管生成,整合素在血管生成过程中有重要作用,整合素αvβ3受体在某些肿瘤细胞及新生血管内皮细胞高表达。RGD小分子多肽是含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的短肽,可与整合素αvβ3受体特异性结合。放射性核素68Ga标记到含有RGD肽结构的分子上用于PET显像已经有许多报道,68Ga-NOTA-RGD与68Ga-NOTA-PRGD2也已经进入临床实验阶段[28-29]。
NOTA修饰的RGD探针c(RGDyK)(RGD1)、E[c(RGDyK)]2(RGD2)、E{E[c(RGDyK)]2}2(RGD4)在U87MG细胞上的受体结合实验表明:三种探针对整合素受体的亲和力大小为NOTA-RGD4>NOTA-RGD2>NOTA-RGD1[30]。PET显像实验显示,四聚体68Ga-NOTA-RGD4在肿瘤上摄取值最高(注射后1 h肿瘤摄取2.8%ID/g),但在肾脏部位也有明显的放射性滞留,从而影响了显像效果。相比于68Ga-NOTA-RGD1,二聚体68Ga-NOTA-RGD2肿瘤摄取明显提高(注射后1 h肿瘤摄取值为(2.2±0.1)%ID/g),且在其他脏器中的摄取值较低,综合优势明显。
为解决RGD探针在体内代谢快、肿瘤摄取较低、肝肾等非靶部位摄取较高的问题,研究者在探针中引入15-amino-4,7,10,13-tetraoxapentadecanoic acid(PEG4)或Gly-Gly-Gly(Gly3)等基团提高肿瘤的摄取率。68Ga标记的RGD二聚体探针NOTA-G3-RGD2与NOTA-P4-RGD2,均能在30 min实现68Ga标记且比活度为8.88×109~11.84×109MBq/mol。相比68Ga-NOTA-RGD2,两个探针在肿瘤病灶富集效果更好,证明PEG4及Gly3连接基团起到了重要作用[31]。Blom等[32]在RGD与DOTA/NOTA之间增加PEG链,获得了可以靶向于肿瘤的68Ga-DOTA-PEG-RGD与68Ga-NOTA-PEG-RGD,但没有进行显像实验研究。除NOTA外,DOTA是另一种可用于68Ga标记的大环多胺类双功能螯合基团。如图3所示,68Ga-DOTA标记的RGD单体(DOTA-E-c(RGDfK)),二聚体(DOTA-E-[c(RGDfK)]2)及四聚体,(DOTA-E{E[c(RGDfK)]2}2)的半数抑制浓度(IC50)分别为(23.9±1.22)、(8.99±1.20)、(1.74±1.18) nM,注射后2 h在SK-RC-52肿瘤中的摄取值分别为(3.30±0.30)、(5.24±0.27)、(7.11±0.67)%ID/g,表明连接的RGD结构越多在肿瘤中的放射性摄取越高[33]。

图2 DOTA-TOC、DOTA-NOC及DOTA-TATE奥曲肽类似物结构[24]Fig.2 Structural formulas of DOTA-TOC, DOTA-NOC, and DOTA-TATE octreotide[24]

a——DOTA-E-c(RGDfK);b——DOTA-E-[c(RGDfK)]2;c——DOTA-E{E[c(RGDfK)]2}2图3 用于68Ga标记的RGD单聚体及多聚体结构[33]a——DOTA-E-c(RGDfK);b——DOTA-E-[c(RGDfK)]2;c——DOTA-E{E[c(RGDfK)]2}2Fig.3 Structural formula of the DOTA-conjugated monomeric, dimeric, tetramericRGD peptide[33]
Ferreira等[12]比较了68Ga-PCTA-RGD与68Ga-NOTA-RGD在HT-29小鼠肿瘤中的显像效果。PCTA-RGD与NOTA-RGD在室温下反应5 min放化产率即大于95%;68Ga-PCTA-RGD体外4 h稳定性(93±2)%不如68Ga-NOTA-RGD(98±1)%;标记化合物主要分布在肾、肝以及肿瘤部位,在其他的器官中能迅速清除。68Ga-PCTA-RGD的肾摄取较低,瘤/肾比值达到1.5±0.4,有可能使68Ga-PCTA-RGD获得更多的应用。Dumont等[14]比较64Cu及68Ga标记的NODAGA-c(RGDfK)、DOTA-c(RGDfK)及CB-TE2A-c(RGDfK)在U87肿瘤模型中的PET显像效果。68Ga标记NODAGA-c(RGDfK)在室温下反应10 min即可。注射后1 h,68Ga-NODAGA-c(RGDfK)的肿瘤摄取值为(5.19±1.45)%ID/g,68Ga-DOTA-c(RGDfK)的肿瘤摄取值为(3.47±0.78)%ID/g,68Ga-NODAGA-c(RGDfK)拥有更好的靶/非靶比值。该研究证明螯合基团对探针靶向能力会造成影响。64Cu-CB-TE2A-c(RGDfK)和64Cu-NODAGA-c(RGDfK)在18 h有较高的靶/非靶比值,在肿瘤诊疗方面具有良好的潜力。
68Ga标记的RGD探针在其他疾病监测方面也取得了一定成果。Haukkala等[34]通过放射自显影技术验证了68Ga-DOTA-RGD在动脉粥样硬化斑块里的摄取值明显高于正常的血管壁。Paeng等[19]研究发现,与正常小鼠相比,68Ga-NOTA-RGD在ApoE-/-(载脂蛋白E基因敲除)模型小鼠中的主动脉上有更高的摄取;通过68Ga-NOTA-RGD与18F-FDG对比研究,发现68Ga-NOTA-RGD图像对比度与灵敏度较18F-FDG低,有可能限制68Ga-NOTA-RGD在动脉粥样硬化疾病显像方面的应用。
3.1.3CXCR4靶向探针
趋化因子受体CXCR4在肿瘤生长、转移等过程中有重要的作用。Eleni等[35-37]合成了一种68Ga标记的CPCR4靶向探针68Ga-CXCR4-2(68Ga-pentixafor,图4a),其IC50值为(4.99±0.72) nM,具有较好的体内稳定性及肿瘤摄取。OH1小鼠中生物分布实验结果显示,注射后1、2 h的肿瘤摄取值分别为(6.16±1.16)%ID/g与(4.63±1.54)%ID/g。该探针具有良好的亲水性,能够快速从肾脏清除。PET显像结果显示,68Ga-pentixafor在其他非靶器官中的滞留少,肿瘤对比度高。此外,普乐沙福(AMD3100)是CXCR4的抑制剂,基于AMD3100结构的68Ga标记化合物也受到关注。Poty等[38]在AMD3100上修饰了PEG水溶性基团及p-NCS-Benzyl-NODAGA双功能连接剂,成功制备了68Ga标记的AMD3100类似物68Ga-11(图4b),该标记探针肝、脾、肺、骨等CXCR4高表达的脏器中有较高的摄取,但在肿瘤中的摄取较低,导致靶/非靶比值较差。

图4 68Ga-pentixafor(a)及AMD3100类似物68Ga-11(b)结构[35-38]Fig.4 Chemical structure of 68Ga-pentixafor(a) and AMD3100 analogues68Ga-11(b)[35-38]
CXCR4受体在炎症细胞表面高表达,Hyafil等[39]利用68Ga-pentixafor在兔子模型上进行动脉粥样硬化PET/MRI显像。注射68Ga-pentixafor后1 h,PET显像能够清晰辨认腹主动脉及颈动脉上的粥样硬化斑块。注射AMD3100后,斑块对探针的摄取明显被抑制。
胃泌素释放肽受体(gastrin-releasing peptide receptors, GRPR)存在于多种肿瘤中。Gourni等[40]利用MJ9多肽结构(Pip-D-Phe-Gln-Trp-Ala-Val-Gly-His-Sta-Leu-NH2)与NOTA及NODAGA结合,制备NOTA-MJ9和NODAGA-MJ9并进行68Ga标记,两种标记物68Ga-NOTA-MJ9和68Ga-NODAGA-MJ9在PC3肿瘤模型中1 h的摄取值分别为(23.3±2.0)%ID/g及(16.7±2.0)%ID/g,均有良好的肿瘤显像效果。
3.1.4叶酸靶向探针
多种癌症细胞会高表达叶酸受体。在活体组织中,叶酸受体在除肾脏以外的正常组织表达很低,可以作为肿瘤或炎症病灶的一个特殊靶点。将叶酸分子与双功能螯合官能团连接并进行放射性核素标记,可通过叶酸的靶向性将核素运输到靶点进行显像,68Ga标记的叶酸受体靶向探针成为研究的热点。
将DOTA结构修饰到叶酸上,可用111In,67Ga,68Ga,177Lu等核素进行标记。Fani等[41]合成了用乙二胺结构连接的DOTA类叶酸探针(编号P3026)与用短链PEG连接的叶酸类似物(编号P1254)类似物(图5)。在体外实验中,P3026与P1254标记物在KB细胞中均有较高的放射性摄取,滞留效果优于111In-DTPA-folate;在生物分布实验中,这两种68Ga-DOTA-folate探针在注射后2 h肿瘤放射性摄取约为10%ID/g,在肾脏中的放射性摄取差别较大,分别为67/68Ga-P3026:(87.78±12.37)%ID/g,67/68Ga-P1254:(98.43±15.40)%ID/g;注射探针后20 min~24 h,瘤/肾的比值维持在0.08~0.14。Müller等[42]用68Ga对叶酸靶向探针DOTA-Bz-EDA-folate(编号EC0800)进行标记并用于PET显像,注射后1.5 h该探针在KB肿瘤中有较高摄取,在肾脏和膀胱中有很高的放射性滞留,若提前注射培美曲塞(pemetrexed),可有效抑制肾脏的摄取且不影响肿瘤摄取。
Fani等[43]研究了68Ga-NODAGA标记的靶向于叶酸受体的NODAGA-folate P3246及NODAGA-dideaza-folate P3238(图6)。68/67Ga-
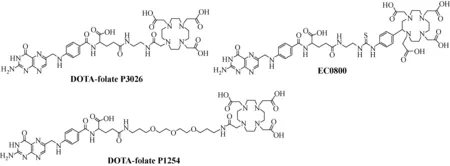
图5 DOTA连接的叶酸类似物结构[41-42]Fig.5 Chemical structures of the DOTA-folate[41-42]
P3246及68/67Ga-P3238的Kd值(解离常数,指引起最大效应一半(50%受体被占位)时的药物浓度)分别为(5.61±0.96) nM及(7.21±2.46) nM,叶酸受体亲和力高。注射后1 h两种探针在叶酸高表达的KB肿瘤中摄取达(16.56±3.67)%ID/g、(10.95±2.12)%ID/g,4 h仍维持该水平;但肾脏摄取高,采用pemetrexed进行抑制,提高了瘤/肾比值;两种探针在肿瘤病灶部位均表现出良好的肿瘤显像效果,68Ga-P3246性质更为优越,有望成为叶酸受体靶向性质优良的显像应用探针。
Mathias等[44]报道了68Ga与DF-folate偶联后对叶酸受体具有特异性,可作为叶酸受体肿瘤显像剂(图7)。去胺铁(deferoxamin)在分子中作为螯合剂可与Ga3+形成配合物,不需要DOTA及NOTA等大环多胺类连接结构。

a——NODAGA-folate P3246;b——NODAGA-dideaza-folate P3238;c——荷KB肿瘤裸鼠尾静脉注射68Ga- P3246后1 h的PET/CT显像图;d——注射68Ga-P3246之前注射pemetrexed进行抑制图6 NODAGA-folate P3246及NODAGA-dideaza-folate P3238结构及显像图[43]a——NODAGA-folate P3246;b——NODAGA-dideaza-folate P3238;c——MIP images of 68Ga-P3246 1 h pi;d——MIP images of 68Ga-P3246 1 h pi;d——MIP images of 68Ga-P3246 1 hour pi with preinjection of pemetrexedFig.6 The structures of NODAGA-folate P3246 and NODAGA-dideaza-folate P3238 and MIP images[43]

图7 DF-folate的结构[44]Fig.7 Structures of the DF-folate[44]
3.1.5伊文思蓝探针
伊文思蓝(evans blue)为一种偶氮类染料,能够与血浆白蛋白高度亲和。将放射性核素标记到伊文思蓝结构上,可实现白蛋白在生物体内的标记,从而延长探针的体内半衰期,该方法克服了体外白蛋白标记的缺点,可用于血池、淋巴结及肿瘤显像。以伊文思蓝结构为基础的68Ga-NOTA-NEB(图8)在临床转化方面取得了较大进展。健康人及肝血管瘤患者静脉注射68Ga-NOTA-NEB 90 min后,PET全身显像结果显示,在肝血管瘤中,该探针相比于18F-FDG表现出更高的肿瘤/肝组织对比度;其他肝脏病灶例如肝细胞癌,肝囊肿和神经内分泌肿瘤肝转移病灶对68Ga-NOTA-NEB的摄取显著低于周边正常肝组织[45]。Zhang等[46]运用该探针进行淋巴病变患者的PET显像,结果显示,PET图像上可观察到患者的淋巴病变,获得的疾病信息多于99mTc-SC淋巴显像且更准确。

图8 68Ga-NOTA-NEB的结构[45]Fig.8 Chemical structure of 68Ga-NOTA-NEB[45]
3.1.6双靶向探针
Liu等[47]通过含有Arg-Gly-Asp(RGD)与bombesin(BBN)结构的双靶向探针评价肿瘤整合素αvβ3及胃泌素释放肽受体的表达(图9)。与68Ga-NOTA-RGD以及68Ga-NOTA-BBN比较发现,双受体靶向的68Ga-NOTA-RGD-BBN在PC-3肿瘤中有更高的摄取值,该摄取可以被过量的RGDyK及BBN抑制,证明该探针同时具有整合素受体及胃泌素释放肽受体的双重靶向性。有研究比较了18F、64Cu及68Ga标记的RGD-BBN用于乳腺癌显像的效果[48],结果显示,64Cu-NOTA-RGD-BBN及68Ga-NOTA-RGD-BBN相比18F-FB-PEG3-RGD-BBN制备更加快速简单,虽然64Cu-NOTA-RGD-BBN及68Ga-NOTA-RGD-BBN在MDA-MB-435肿瘤中摄取值高,但背景值也较高。
3.1.7其他小分子探针
Yang等[49]将DOTA与D-葡萄糖胺进行连接合成DOTA-DG(图10a),并进行68Ga标记后靶向肿瘤部位。在A431细胞中,68Ga-DOTA-DG与18F-FDG在60 min的放射性摄取值分别为15.7%和16.2%。生物分布实验中,68Ga-DOTA-DG在A431肿瘤的摄取值分别为(2.38±0.30)%ID/g(10 min),(0.75±0.13)%ID/g(30 min),(0.39±0.04)%ID/g(60 min)。小动物PET显像显示,注射68Ga-DOTA-DG 60 min后显影肿瘤清晰可见,且瘤/心、瘤/脑、瘤/肌肉都显著高于18F-FDG显像(图10b)。

图9 NOTA-RGD-BBN异质二聚体结构(a)及荷PC-3肿瘤鼠PET显像图(b)[47]Fig.9 Chemical structure of NOTA-RGD-BBN heterodimer(a)and microPET images of PC-3 tumor-bearingmice(b)[47]

图10 DOTA-DG合成及68Ga标记过程(a)与68Ga-DOTA-DG的A431肿瘤与非靶器官比值(b)[49]Fig.10 Synthesis of the precursor compound DOTA-DG and labeling of it with 68Ga(a)and comparison of the tumor: nontumor (T/NT) uptake ratios for 18F-FDG and 68Ga-DOTA-DG in mice bearing A431 tumors at 1 hour after radiotracer (b)[49]
Notni等[50]合成了含有TRAP及DOTA结构的PET/MRI双模态显像剂(图11),基于TRAP特有的结构,在其分子外部直接连接三个DOTA结构。TRAP可进行68Ga的标记,而Gd可标记在DOTA结构,因而同时具有PET显像与核磁共振显像(magnetic resonance imaging,MRI)显像功能。
除以上介绍的RGD、BBN、叶酸等靶向结构外,研究人员还将DOTA或NOTA等螯合结构与生物素类似物[51]、表面膜抗原[52]、硝基咪唑结构[53,54]、氨基酸类似物[55-57]、二磷酸盐[58]等进行连接,合成了一系列68Ga标记的显像探针。
3.2 大分子探针
3.2.1以白蛋白为载体的分子探针
Haubner等[59]用68Ga标记GSA大分子靶向肝细胞中的ASGP受体(图12),与99mTc-GSA对比发现,68Ga-DTPA-GSA及99mTc-DTPA-GSA在肝脏部位摄取均较高,在血液中68Ga-DTPA-GSA的浓度要高于99mTc-DTPA-GSA。将DTPA螯合结构换成NOTA用于68Ga标记,可提高探针的代谢稳定性,但没有显著提高肝脏疾病诊断价值,68Ga-NOTA-GSA相对于68Ga-DTPA-GSA优势并不明显[60]。
3.2.2以特异性抗体为载体的分子探针
以特异性抗体为载体,并利用68Ga进行标记及显像受到广泛关注。HER2受体过度表达是乳腺癌及多种恶性肿瘤的征兆之一。亲和性物质ZHER2:342(约7 kD)是利用噬菌体展示技术筛选得到的可与HER2特异性结合的多肽,111In-DOTA-ZHER2:342-pep2(ABY-002)在HER2表达的乳腺癌中有优良的显像效果。Tolmachev等[61]用68Ga替代111In对ABY-002进行标记,68Ga-ABY-002能够特异性靶向SKOV-3肿瘤,且在血液、肺部、肠道、肌肉的清除更加迅速,注射后的2 h即可得到(12.4±3.8%)ID/g的肿瘤摄取值。
3.3 以纳米颗粒为载体的分子探针
纳米颗粒的表面修饰对纳米探针的功能化和体内分布至关重要。通过纳米载体负载各种功能基团是实现多功能诊疗的重要途径。Lee等[62]通过三辛基氧化膦在Qdot表面修饰了多肽、糖以及可用于68Ga标记的NOTA结构(图13),该探针能够特异性靶向整合素受体高表达的肿瘤,同时进行荧光显像及PET显像。Frigell等[63]制备了糖修饰的金纳米颗粒,该纳米颗粒连接能穿过血脑屏障(blood-brain barrier,BBB)的神经肽以及螯合基团NOTA。在PET显像及生物分布实验中,不同神经肽修饰的纳米颗粒体现出不同的生物分布,修饰有Leu-enkephalin肽(Enk)的金纳米颗粒相比于没有修饰靶向多肽的纳米颗粒表现出更高的脑摄取值。
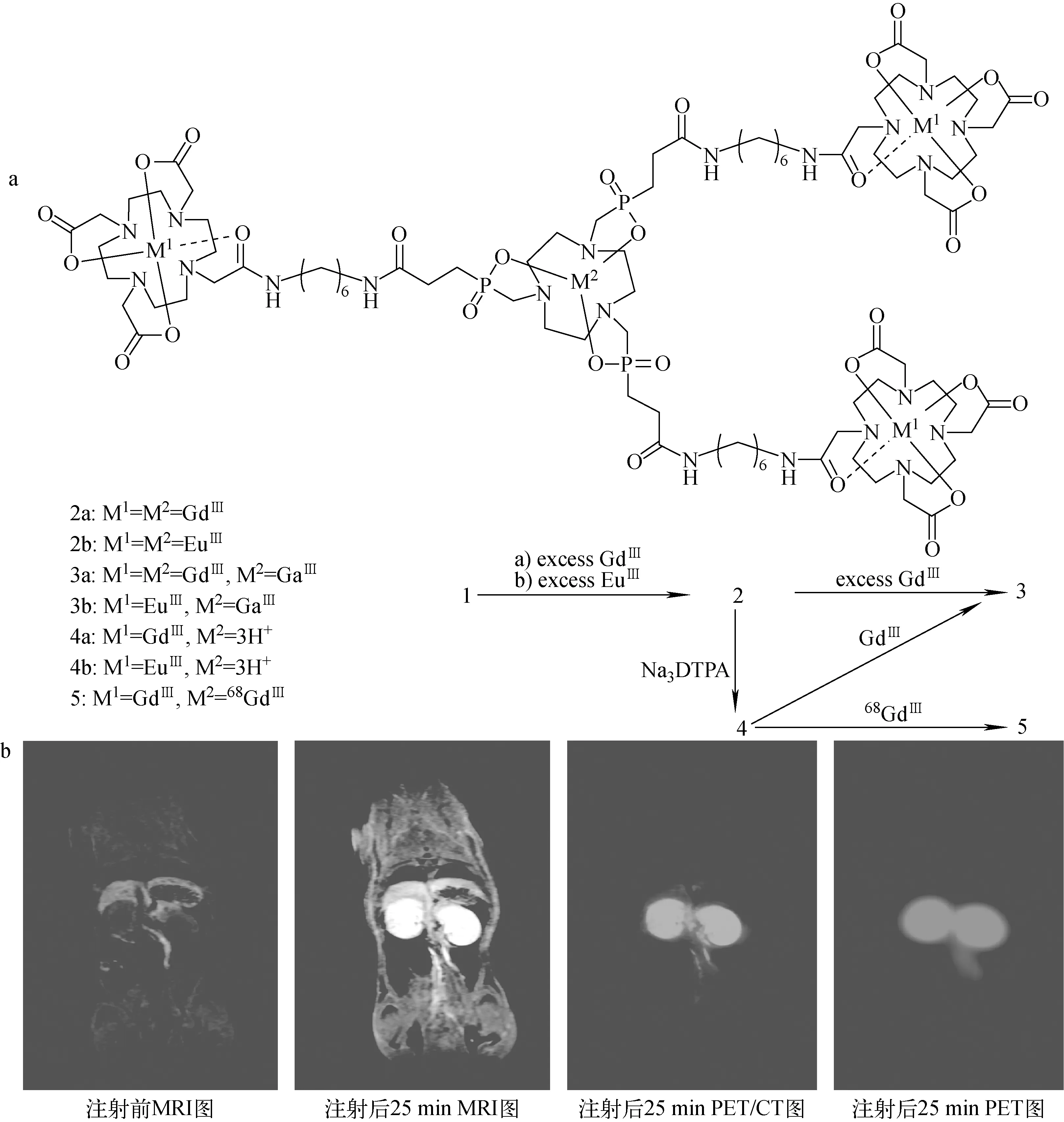
图11 68Ga标记的TRAP(HMDA-DOTA)3(a)与Wistar大鼠注射3a及5的混合物之前及25 min后的PET/MRI显像图(b)[50]Fig.11 Synthesis of metal complexes and 68Ga labeling of TRAP (HMDA-DOTA)3 (a) and PET/MRI of a Wistar rat (coronal plane through kidneys) before and 25 min after injection of a mixture of 3a and 5(b)[50]

图12 68Ga标记的GSA结构图[59]Fig.12 Schematic structure of 68Ga-DTPA-GSA[59]
4 小结与展望
68Ga标记药物在靶向NET肿瘤方面取得了较好的成绩,有多个药物正在进行临床研究。FDA批准了68Ga-DOTATATE药物用于生长抑制素受体阳性神经内分泌肿瘤的诊断。鉴于68Ga优良的核素性质、方便的获取途径及成熟的标记条件,68Ga标记的放射性药物将获得更多的发展。在今后的研究中,研制出稳定性高、生物活性好、特异性强、药代动力学性质突出的68Ga标记药物用于肿瘤的诊断和疗效监测,仍然是研究重点和目标。PET显像药物将逐渐摆脱过于依赖18F-FDG的状态,以68Ga标记药物为代表的PET显像剂将发挥更大的作用,促进正电子药物的多元发展并最终为人类健康服务。

图13 Qdot表面通过三辛基氧化膦修饰的双亲性链[62]Fig.13 Tails of these amphiphileshydrophobically interact with trioctylphosphine oxide on Qdot surfaces[62]
