申嗪酰胺类衍生物对禽传染性支气管炎病毒的抑制作用
2019-09-10蔡智超吴清来方守国
蔡智超 吴清来 方守国


摘要:申嗪霉素及其衍生物具有抑菌和抗癌活性。該文检测了17种申嗪酰胺类衍生物对Vero细胞的毒性和9种该类衍生物禽传染性支气管炎病毒( IBV)复制的影响。结果表明,浓度为10μg/mL时,9种衍生物SQXA-O1、02、06、08、09、11、12、14、16对Vero细胞无毒性,而其他8种衍生物均产生不同程度的毒性;在最大无毒浓度下,SQXA-02、06和16在2种处理方式下均具有较高的抗IBV活性,而SQXA-O1、08、09、11、12在B方式处理下具有较高的抗IBV活性(相对抑制率>80%),而在A方式处理下活性较低。该研究结果为进一步研究衍生物抗病毒的机制和药物研发提供了理论支持。
关键词:申嗪酰胺类衍生物;禽传染性支气管炎病毒;细胞毒性;抑制作用
中图分类号:S852.65
文献标识码:B
doi:10.3969/j .issn.2096-3637.201 9.10.001
0 引言
申嗪霉素又名吩嗪-1-羧酸(PCA),最早在染料合成中被发现[1]。19世纪50年代科学家从链霉菌(Streptomyceschromogenus sp.)和极毛杆菌(Pseudomonads fluorescens)的代谢物中分离提取到吩嗪-l-羧酸[2]。许煜泉等从假单胞菌株M18( Pseudomonas sp.)的分泌物中发现了具有强烈农用抑菌活性的物质,结构鉴定为吩嗪-l-羧酸,研究发现其具有广谱性农用抗菌活性[3-4]。在某些癌细胞中,吩嗪-1-羧酸同样表现出抑制生长的效果[5],但对于正常细胞则表现为低毒性[6]。在影响病毒复制方面,还未见详细报道。本研究检测了17种申嗪酰胺类衍生物对Vero细胞的毒性以及其中9种衍生物对IBV病毒复制的影响。
1 材料与方法
1.1 材料
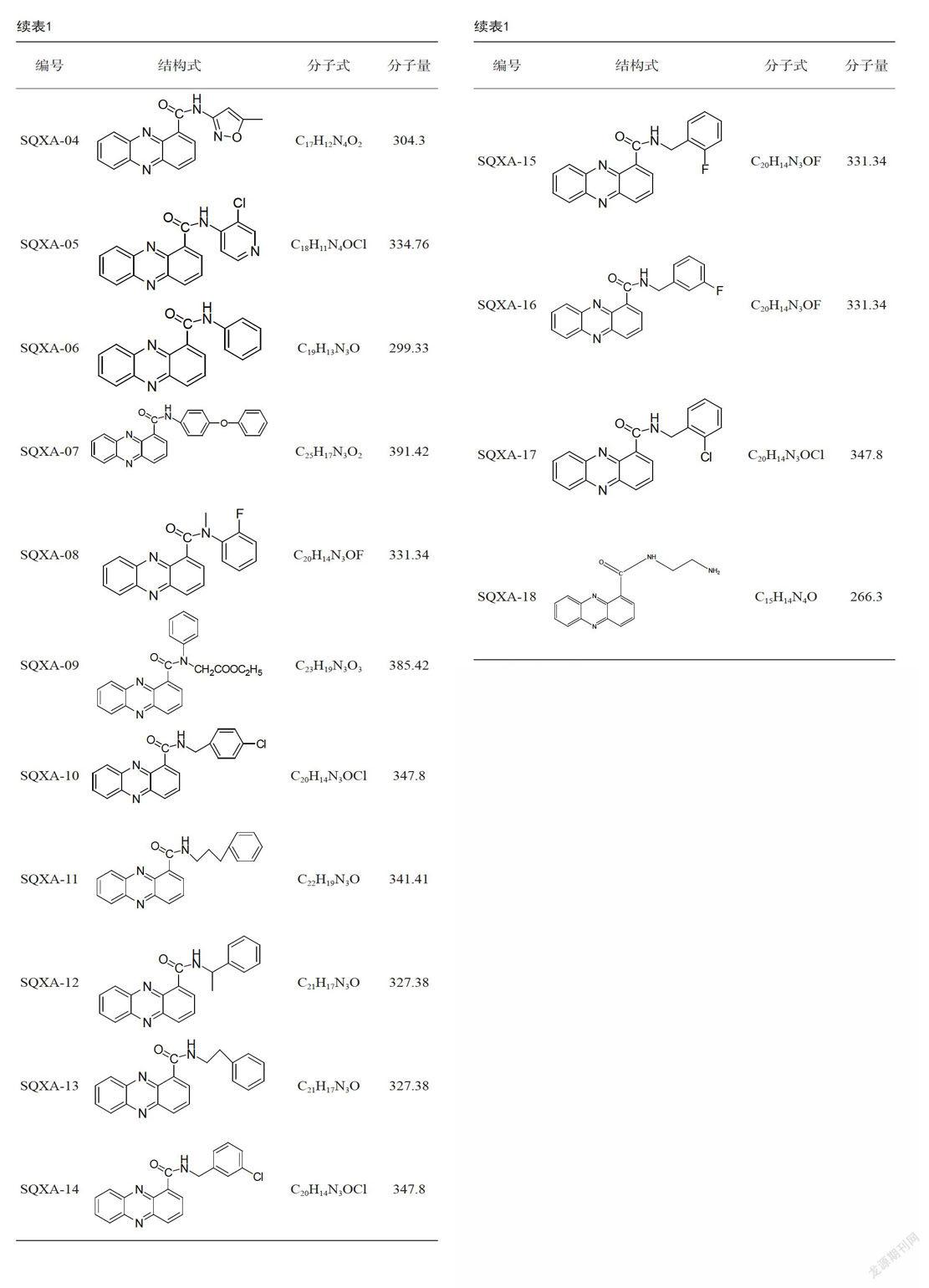
17种申嗪酰胺类衍生物均由长江大学农药研究所提供,见表l。非洲绿猴肾细胞系( Vero)和表达荧光素酶的禽传染性支气管炎病毒(IBV-3ab-Iuc)[7]由本实验室保存。高糖DMEM细胞培养液、0.25% Trypsin-EDTA、FBS购于Gibco、MTT购于Solarbio。
1.2 试验方法
1.2 1 申嗪酰胺类衍生物对Vero细胞的最大无毒浓度的测定
DMSO溶解17种申嗪酰胺类衍生物,见表1,使其浓度为10 mg/mL,超声波震荡1 min,使化合物充分溶解,常温密封保存备用。
将复苏后传代3次的Vero细胞从T75细胞培养瓶接种到12孔细胞培养板培养,每孔约接种细胞5 x 104个,37℃环境下5% C02恒温培养至长满板底50%时加入化合物,每种化合物设置3种浓度:100、50、10μg/mL,及1个DMSO对照组,3次重复,37℃环境下5% C02恒温培养至对照组细胞镜检下长满板底时停止处理。真空泵吸干每孔中的上清液,用2 mL PBS小心清洗3次,每孔加入500μL 0.25%Trypsin-EDTA浸润10 s后吸出,室温消化1min,加入1mL含0.1%台盼蓝的PBS重悬细胞,转移至1.5 mL离心管中,倒置显微镜下血球计数板细胞计数,并记录数据(蓝色细胞不记入其中)。
1.2.2 9种申嗪酰胺类衍生物对IBV-3ab-Iuc病毒复制的影响
将复苏后传代3次的Vero细胞从T75细胞培养瓶接种到24孔细胞培养板中37℃环境下5% CO2恒温培养,每孔约接种细胞1×104个。按照以下A、B2种加药方式分开加药处理,加药浓度为其对Vero细胞的最大无毒浓度。
A加药方式:为检测申嗪酰胺类衍生物是否能刺激Vero细胞产生抗IBV作用,每种化合物设3个重复,设置1个DMSO对照组及1个空白组(不感染病毒),待Vero长满板底50%后加入9种化合物处理24 h后,吸尽培养液并用PBS洗2次,再加入培养液,而后加入IBV-3ab-luc(MOI=1.0)处理24h。
B加药方式:为检测申嗪酰胺类衍生物能否抑制IBV在Vero细胞中的复制,每种化合物设3个重复,设置1个DMSO对照组及1个空白组(不感染病毒)。待Vero长满板底后加入IBV-3ab-luc(MOI=1.0)处理4h,而后加入9种化合物处理20 h。
吸尽上清液,PBS小心清洗3遍,每孔加入200μLRLB常温下浸润5 min,移液器吹打混匀,取50 μL RLB溶解物与50μL Luciferase Substrate混合均匀后放入单管发光检测仪( Promega)中检测荧光值,记录数据,计算相对抑制率一(1化合物处理后的荧光值/DMSO处理后的荧光值)×100%。
2 结果与分析
2.1 不同浓度申嗪酰胺类衍生物对Vero细胞的毒性测定
通过调查不同浓度申嗪酰胺类衍生物处理后Vero细胞的活细胞数,确定衍生物对Vero细胞不产生毒性的浓度。结果显示,与DMSO处理组(细胞数为1.520×106个)相比,浓度为10 μg/mL时,9种衍生物SQXA-O1、02、06、08、09、11、12、14、16对Vero细胞无毒性,而其他8种衍生物均产生不同程度的毒性,并随浓度的增高而渐强;浓度为50μg/mL时,只有SQXA-01、06、14和16表现出无毒性;浓度为100μg/mL时,只有SQXA-Ol、14和16表现出无毒性。SQXA-14和16表现出促Vero细胞生长的作用,见表2。由以上数据可得9种申嗪酰胺类衍生物在10 - 100μg/mL浓度范围内的最大无毒浓度:SQXA-OI(50 μg/mL)、SQXA-02(10μg/mL)、SQXA-06( 100μg/mL)、SQXA-08( 10μg/mL)、SQXA-09( 100μg/mL)、SQXA-11(10 μg/mL)、SQXA-12(10μg/mL)、SQXA-14(100μg/mL)、SQXA-16(100μg/mL)。296F7240-825F-4A55-9A5D-E2361C5F476E
2.2 9种申嗪酰胺类衍生物对IBV-3ab-Iuc复制的影响
在上述9种申嗪酰胺类衍生物最大无毒浓度下,检测其对IBV-3ab-luc复制的影响,所得的荧光值和相对抑制率见表3、表4。结果表明,方式A处理下,9种衍生物均对IBV-3ab-luc复制表现出不同程度的抑制作用,其中,SQXA-02、06、14和16的相对抑制率超过50%,分别为54.5%、72.2%、60.0%和76.3%;方式B处理下,SQXA-O1、02、06、08、09、11、12、16具有较高的抗IBV-3ab-Iuc活性,相对抑制率在8 0%以上,但SQXA-14无抗病毒活性。结果显示,SQXA-02、06和16在A、B2种处理方式下均具有较高的抗IBV活性,说明这3种化合物可直接抑制IBV的复制或通过刺激Vero细胞产生抗病毒物质进而抑制IBV的复制;SQXA-01、08、09、11、12在B方式处理下具有较高的抗IBV活性(相对抑制率>80%),而在A方式处理下活性较低(相对抑制率12.9%~42.7%),说明这5种衍生物可直接抑制IBV的复制;SQXA-14在A方式处理下具有60%的抑制IBV复制的活性,但在B方式处理下无抗病毒活性,原因不明,有待进一步研究。
3 讨论与结论
申嗪霉素及其类衍生物具有良好的抗癌和抗菌活性[8-9],但它们的抗病毒活性未见详细报道。本文首次检测了17种申嗪霉素酰胺类衍生物对Vero细胞的毒性和IBV复制的影响。结果表明,衍生物SQXA-04、05、07、10、13、15、17、18在1Oμg/mL时对Vero细胞具有毒性,并随着浓度的升高,对Vero细胞的毒性渐大;其他9种申嗪酰胺类衍生物在10 - 1OOμg/mL浓度范围内的最大无毒浓度:SQXA-01( 50μg/mL)、SQXA-02(10μg/mL)、SQXA-06(100μg/mL)、SQXA-08(10μg/mL)、SQXA-09(100μg/mL)、SQXA-11(10μg/mL)、SQXA-12(10μg/mL)、SQXA-14(100μg/mL)、SQXA-16( 100μg/mL);而SQXA-14和16表现出促Vero细胞生长的作用,说明不同的申嗪霉素酰胺类衍生物对Vero细胞的毒性不同。
检测9种申嗪酰胺类衍生物最大无毒浓度下IBV-3ab-Iuc复制的影响,结果显示,SQXA-02、06和16在A、B2种处理方式下均具有较高的抗IBV活性,说明这3种化合物可直接抑制IBV的复制或通过刺激Vero细胞产生抗病毒物质进而抑制IBV的复制;SQXA-O1、08、09、11、12在B方式处理下具有较高的抗IBV活性(相对抑制率>80%),而在A方式处理下活性较低(相对抑制率12.9%~ 42.7%),说明这5种衍生物可直接抑制IBV的复制;SQXA-14在A方式处理下具有60%的抑制IBV复制的活性,但在B方式处理下无抗病毒活性,其抗病毒机制正处于研究中。
申嗪酰胺类衍生物分子式相同但取代基团的连接方式或位置不同,表现出不同的生物活性。如SQXA-02和SQXA-05只是CI的位置不同,但SQXA-05对Vero细胞的毒性更高;SQXA-08. SQXA-15和16分子式相同但F的位置不同,SQXA-15对Vero细胞的毒性显著高于SQXA-08,相反,SQXA-16能促进Vero细胞的生長,且它的抗IBV的活性高于SQXA-08; SQXA-12与SQXA-13,苯环的连接方式不同,对Vero细胞的毒性存在差异;SQXA-1O. 14和17.Cl的位置不同,SQXA-lO和17在1O - 100μg/mL浓度范围表现出对Vero细胞的毒性,而SQXA-16能促进Vero细胞的生长。这些作用的机理有待进一步研究。
参考文献
[l] Birkofer L. Chlororaphin. ein weiteres farbigesStoffwechselprodukt des Bacillus pyocyaneus[J]. EuropeanJoumal oflnorganic Chemistry. 2010. 80(3):212-214.
[2]Isono K. Suzuki S,Sawazaki T,et al.An antibiotic producedby Streptomyces chromogenus sp[J].Journal of Antibiotics,1955.8(1):19-21.
[3] Duffy B. Combination of pencycuron and Pseudomonasfluorescens strain 2-79 for integrated control of thizoctonia rootrot and take-all of spring wheat[J]. Crop Protection. 2000. 19(1):21-25.
[4] Lee J Y. Moon S S,Hwang B K.Isolation and in vitro andin vivo activity against Phytophthora capsici and Colletotrichumorbiculare of phenazine-l-carboxylic acid from Pseudomonas aeruginosa strain GC-B26[J]. Pest Management Science,2010. 59(8):872-882.
[5] Gao X, Lu Y. Xing Y, et al.A novel anticancer andantifungus phenazine derivative from a marine actinomycete BM-17[J]. MicrobiologicalResearch. 2012. 167( lO):616-622.
[6] Cimmino A. Evidente A. Mathieu V. et al.Phenazines andcancer[J]. Natural Product Reports, 2012. 29(4):487-490
[7] Shen H. Fang S G, Chen B,et al.Towards construction ofviral vectors based on avian coronavirus infectious bronchitisvirus for gene delivery and vaccine developruent[J]. Joumal ofVirological Methods. 2009. 160( 1-2):48-56.
[8] Karuppiah V. Alagappan K. Sivakumar K. et al Phenazine-l-carboxylic acid-induced apoptosis in human prostate cancercells is mediated by reactive oxygen species generation andmitochondrial-related apoptotic pathway[J]Joumal of AppliedBiomedicine. 2016. 14(3):199-209
[9]郑文君,徐曙,周明国.申嗪霉素对油菜菌核病菌生物学活性的初步研究[J].农药学学报,2011. 13(1):28-32.
基金项目:国家自然科学基金项目——禽传染性支气管炎病毒非编码RNA的形成机制及其生物学功能(31572490)
作者简介:蔡智超(1993-),男,硕士,从事分子病毒学研究。
通信作者:方守国(1965-),男,教授,从事分子病毒学研究。296F7240-825F-4A55-9A5D-E2361C5F476E
