滤泥的热解特性及动力学分析
2019-09-10刘法球周少基向敏唐秋平唐智光
刘法球 周少基 向敏 唐秋平 唐智光


摘要:【目的】研究濾泥的热解特性、动力学和热力学性质,为滤泥热解提供科学依据。【方法】采用定量法进行工业分析和元素分析;采用热重分析法,以5、10、15、20、25和30 ℃/min加热速率从室温加热至800 ℃,运用Kissinger、Flynn-Wall-Ozawa(FWO)和Kissinger-Akahira-Sunose(KAS)3种方法处理热重试验数据。【结果】滤泥灰分含量为44.34%,挥发分含量为52.88%,C、H、N、S和O的重量百分比含量分别为24.96%、4.04%、1.98%、5.82%和18.86%,高位发热值(HHV)为11.39 MJ/kg。由TG(热重分析)曲线可知热解主要分为3个阶段进行,分别为微失重阶段(110 ℃左右)、快速热解阶段(150~510 ℃)和炭化阶段(510~800 ℃),不同加热速率下DTG(热重分析一阶微分)曲线峰值差别明显。运用FWO和KAS方法计算得出的平均活化能(Eα)分别为322.28和321.93 kJ/mol,平均焓变(ΔH)为289.04和288.24 kJ/mol,平均吉布斯自由能变(ΔG)为207.87和208.01 kJ/mol,熵变(ΔS)由负值持续增加为正值。【结论】较低的加热速率有利于滤泥的热解反应;FWO和KAS模型均能较好地描述滤泥热解过程,整个热解过程符合热力学第二定律,是一个复杂多步的吸热过程。
关键词: 滤泥;热解;热重分析;动力学
中图分类号: S141;TS249.4 文献标志码: A 文章编号:2095-1191(2019)11-2552-07
Pyrolysis characteristics and kinetic analysis of filter mud
LIU Fa-qiu1,2, ZHOU Shao-ji1*, XIANG Min1, TANG Qiu-ping1, TANG Zhi-guang1
(1School of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China; 2Guangxi Rural Investment Group Agricultural Development Co., Ltd., Nanning 530004, China)
Abstract:【Objective】The pyrolysis characteristics, kinetics and thermodynamic properties of the filter mud were studied to provide a scientific basis for the pyrolysis of the filter mud. 【Method】Industrial analysis and elemental analysis were performed using quantitative methods. Thermogravimetric analysis was conducted, heating from room temperature to 800 ℃ at 5, 10, 15, 20, 25, 30 ℃/min heating rate, using different methods like Kissinger, Flynn-Wall-Ozawa (FWO) and Kissinger-Akahira-Sunose(KAS) for processing thermogravimetric data. 【Result】The ash content of the filter sludge was 44.34%, the volatile matter content was 52.88%. The weight percentages of C, H, N, S and O were 24.96%, 4.04%, 1.98%, 5.82% and 18.86%, respectively, high calorific value(HHV) was 11.39 MJ/kg. According to the TG(hermogravimetric analysis) curve, pyrolysis was mainly divided into three stages, namely, micro-weight loss stage(about 110 ℃), rapid pyrolysis stage(150-510 ℃) and carbonization stage(510-800 ℃). The peak value of DTG(first order differential hermogravimetric analysis) curve was significantly different at different heating rates, with the increase of heating rate. The average activation energy(Eα) calculated by FWO and KAS methods were 322.28 and 321.93 kJ/mol, the average enthalpy change(ΔH) were 289.04 and 288.24 kJ/mol, the average Gibbs free energy change(ΔG) were 207.87 and 208.01 kJ/mol, and the value entropy change(ΔS) were negative continued to increase to a positive value. 【Conclusion】Low heating rate is beneficial to the pyrolysis reaction of filter mud. Both the FWO and KAS model methods can better describe the filter mud pyrolysis process. The whole pyrolysis process conforms to the second law of thermodynamics, and is a complex multi-step endothermic process.
Key words: filter mud; pyrolysis; thermogravimetric analysis(TGA); kinetics
0 引言
【研究意义】滤泥是糖厂的三大主要副产品之一,占加工甘蔗的3%~4%。作为无害化的常规处理,滤泥一般返回田地,但直接返田使用不仅容易引起烧苗和发臭等问题,还易发酵产生高温(65 ℃)和难闻气味,需很长时间才能自然分解(Bhat et al.,2016)。若将滤泥进行热解,获得其热解特性,可为滤泥的热化学利用提供重要的科学依据。【前人研究进展】目前,对于生物质热解,大多数学者采用热重分析(TG)方法进行研究,并利用实验数据来拟合相关模型(赖艳华等,2002;于娟等,2002)。蒋剑春和沈兆邦(2003)对通过热重分析方法获得的数据进行线性回归,在不同加热速率下对木屑进行热解动力学分析, 根据线性拟合度的相关性确定动力学模型,以此确定最佳反应机理函数;傅旭峰等(2009)对不同生物质进行热重分析,并对其热解过程和特性进行研究;王瑀喆等(2017)假设9种动力学模式函数,分别建立动力学模型;Bach和Chen(2017)对微小球藻进行非等温热解,探究非等温热解反应下小球藻的热解,从而得到最佳模型;Kaur等(2017)采用热重分析结合无模型等转化率方法对蓖麻进行热解动力学分析;范方宇等(2018)、解海卫等(2018)在不同升温速率下对生物质进行热解,并研究其机理。综上所述,根据热重分析所得数据进行模型建立,需先对模型进行假设,且适用局限性较大。而无模型等转化率方法可在不假设动力学函数模型的前提下计算热解动力学参数,避免动力学模型选择相关误差,简化热解过程。【本研究切入点】目前,鲜见采用不同升温速率下的热重分析结合等转化率模型对滤泥热解特性进行研究的文献报道。【拟解决的关键问题】对滤泥的热解特性和热解规律进行研究,分析不同模型对动力学参数的影响,为滤泥的热解提供科学依据。
1 材料与方法
1. 1 试验材料
滤泥样品取自广西良圻糖厂,经干燥、粉碎后过0.2 mm筛网,用广口瓶封装备用。
1. 2 分析方法
1. 2. 1 工业分析和元素分析 参照GB/T 212—2008《煤的工业分析方法》对滤泥进行工业分析,使用EA3000元素分析仪(意大利欧维特公司)对原料进行元素分析。样品的高位发热值根据杜隆公式计算:
HHV=0.338C+1.428(H-O/8)+0.095S (1)
式中,HHV表示高位发热值(MJ/kg),C、H、O和S分别表示样品中碳、氢、氧和硫元素组成的重量百分比含量。
1. 2. 2 热重分析 使用STA449F5同步热分析仪(德国NETZSCH公司)对样品进行热重分析。将6~8 mg滤泥粉末置于小的氧化铝坩埚中,氮气作为惰性气体,流速20 mL/min,以5、10、15、20、25和30 ℃/min的不同加热速率从室温加热至800 ℃。
1. 3 热解动力学
热解主要由以下反应机理表示:
生物质[k]挥发性物质+烧焦物 (2)
式中,挥发性物质包括气体和焦油的总和,k表示反应速率常数。
从固态到挥发性产物的反应转化率由下式表示:
[dadt] =kf(a) (3)
式中,α表示样品转化率,t表示时间,f(ɑ)表示反应机理函数,转化率可定义为:
a = [mi-mami-mf] (4)
式中,mi表示样品初始质量,mf表示反应结束时样品质量,mɑ表示t时刻样品质量。
反应速率常数k,可用阿伦尼乌斯(Arrhenius)方程表示:
k=Ae(-Ea/RT) (5)
式中,A表示指前因子,R表示气体摩尔常数,Ea表示反应活化能,T表示热力学温度,其中加热速率可定义为β:
β = [dTdt] (6)
当加热速率β恒定时,公式(3)可积分变为(Kaur et al.,2017):
G(a)=[0adaf(a)] =[Aβ][T0Texp(-EaRT)] dT (7)
其中G(α)表示函数f(ɑ)的积分形式,且这个方程式没有明确的解。
1. 4 无模型等转化率方法
无模型等转化率方法不需作任何反应模型的假设,动力学参数根据曲线在相同转化率下的不同加热速率进行计算。国际热分析和热量测定联合会动力学委员会(ICTAC)高度建议采用无模型等转化率法(Vyazovkin et al.,2011)进行热解模型分析。使用无模型等转化率法的主要目的是简化和避免与动力学模型选择有关的误差。Kissinger、Friedman(FR)、Flynn-Wall-Ozawa(FWO)、Kissinger-Akahira-Sunose(KAS)和Vyazovkin(V)是等转化率方法的代表。本研究采用无模型Kissinger、Flynn-Wall-Ozawa(FWO)和Kissinger-Akahira-Sunose(KAS)方法進行计算。
1. 4. 1 Kissinger方法 在Kissinger方法中(Kis-singer,1956),假定活化能在给定的转化率下为恒定。根据不同加热速率下的ln(β/T[2m])对1/Tm作曲线计算活化能,Tm是DTG(热重分析一阶微分)曲线的峰值温度。Kissinger方程式为:
ln[βT2m] = ln[ARE] - [EaRTm] (8)
根据方程式的斜率-Eɑ/R计算活化能Ea。
1. 4. 2 FWO方法 在FWO方法中(Ozawa,1965;Flynn and Wall,1966),以lnβ对1/Tɑi作曲线图来计算活化能。通过引入Doyle的近似方法,FWO方程的最终形式如下:
ln(βi)=ln[AaEaRg(a)] - 5.331-1.052[EaRTai] (9)
式中,i和ɑ分别表示加热速率和转化率。活化能Eɑ由斜率-1.052Eɑ/R计算得出。
1. 4. 3 KAS方法 KAS法(Akahira and Sunose,1971)是目前广泛应用于生物质热解动力学研究的方法之一。通过引入Doyle的近似方法,最终方程式如下:
ln[βT2m] = ln[AaREaga] - [EaRTai] (10)
活化能通过在一定的转化率ɑ下,以ln(β/T[2ai])对1/Tɑi的曲线斜率来计算,其斜率为-Eɑ /R。
阿伦尼乌斯(Arrhenius)方程中的指前因子(A)通过下式计算:
A=βEaexp [EaRTm] /R[T2m] (11)
焓变(ΔH)、吉布斯自由能变(ΔG)和熵变(ΔS)等热力学参数根据以下等式计算:
[Δ]H = Eɑ-RT (12)
ΔG = Eɑ+RTm ln [KBTmhA] (13)
ΔS=[?H-ΔGTm] (14)
式中,KB=1.381×10-23×J/K,h=6.626×10-34×J×S。
2 结果与分析
2. 1 样品的表征
滤泥的元素分析和工业分析结果如表1所示。从元素分析结果可知,C、H、N、S和O的重量百分比含量分别为24.96%、4.04%、1.98%、5.82%和18.86%,其中O含量较低,有利于滤泥热解。根据公式(1),可计算得到滤泥的HHV为11.39 MJ/kg。从工业分析结果可知,滤泥挥发分含量为52.88%,灰分含量为44.34%,固定碳含量较低,仅有1.43%。
2. 2 热降解过程
随加热速率增加,达到热解设定温度时间减少,但传热滞后效应更明显,滤泥TG曲线(图1)和DTG曲线(图2)均表现为向高温侧移动趋势。由图1可知热解主要分为3个阶段进行,分别为微失重阶段(110 ℃左右)、快速热解阶段(150~510 ℃)和炭化阶段(510~800 ℃)。如图2所示,DTG曲线峰值在各加热速率下差别明显,随升温速率的加快,产生传热滞后现象,峰值温度转为更高值,由5 ℃/min的347 ℃变为25 ℃/min的380 ℃,最大失重率由5 ℃/min的2.31%/min变为25 ℃/min的13.57%/min。
2. 3 动力学分析结果
转化率和温度变化的曲线是分析无模型等转化率方法的基础。不同加热速率条件下转化率与温度的变化曲线如图3所示。由图3可知,温度与转化率间成正比,且在相同温度下加热速率越快转化率越低。用于计算动力学参数的Kissinger曲线如图4所示,根据图4和公式(8)计算出的活化能、指前因子及相关系数(R2)分别为53.79 kJ/mol、4.02?104和0.98205。
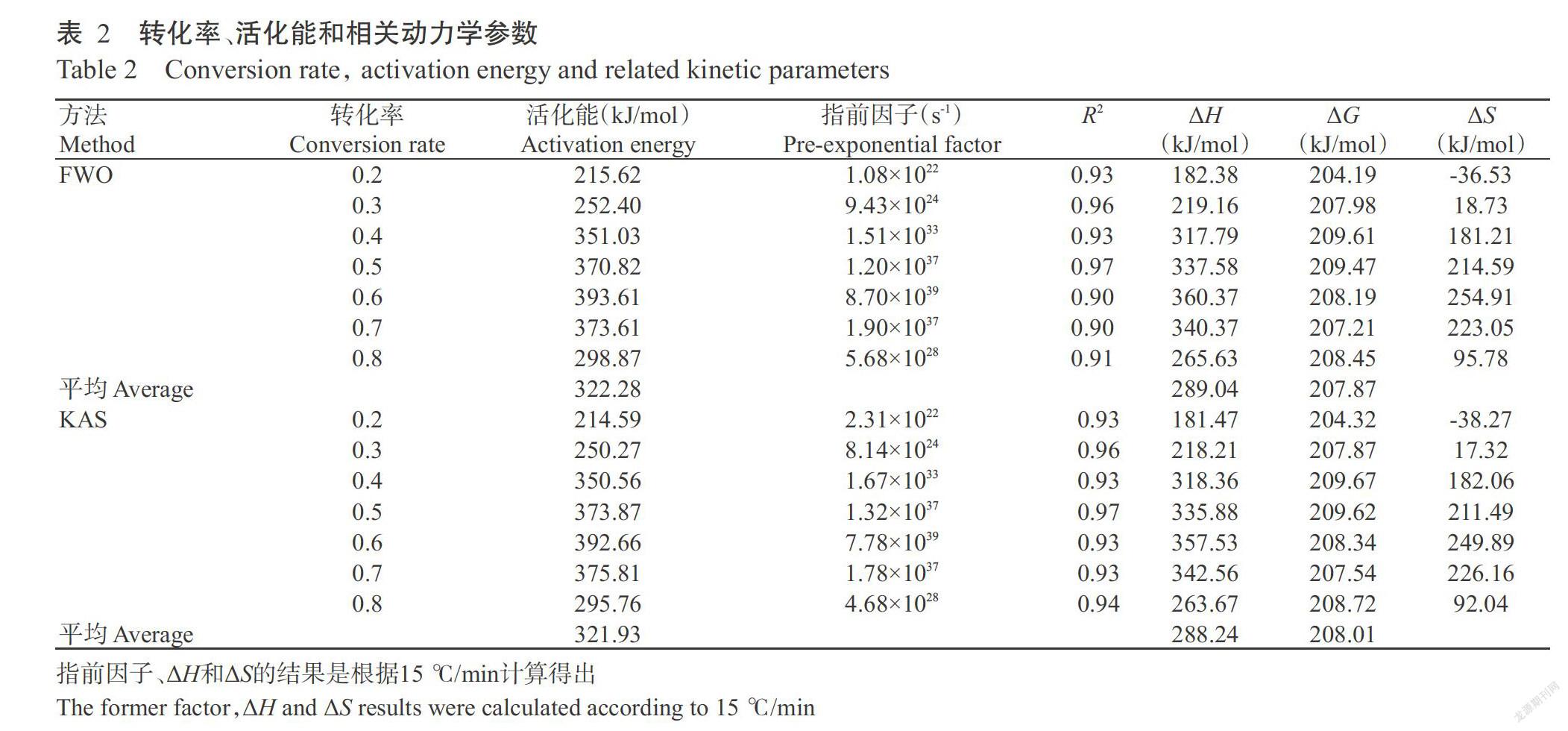
图5和图6为基于FWO和KAS法测得滤泥活化能的线性拟合图。活化能表示反应发生的壁垒,越过壁垒越困难,反应速率就会下降(Gai et al.,2013)。由图5和图6可知转化率从0.2到0.8,步长为0.1;由于低于0.2和高于0.8的R2极低,故仅使用0.2~0.8的转化率进行分析。根据公式(9)~(11)计算得到FWO和KAS法动力学参数(表2),由表2可知,两种方法计算得到的活化能和指前因子非常接近,且R2均在0.90以上,说明使用FWO和KAS法拟合的线性图和计算活化能及指前因子均可靠,指前因子随转化率的变化总体呈上升趋势,转化率0.2~0.8对应的指前因子在1022~1039范围内。将表2中FWO和KAS方法所得转化率和活化能变化关系作图,从图7可知,转化率对活化能有明显影响,活化能随转化率的变化而变化,整体上呈上升趋势,转化率为0.2时,FWO和KAS方法所得的活化能最低,分别为215.62和214.59 kJ/mol,转化率为0.6时活化能达最大值,分别为393.61和392.66 kJ/mol,转化率0.2~0.8所得平均活化能分别为322.28和321.93 kJ/mol。
2. 4 热力学参数
焓是热力学性质的重要参数,表示单位质量的物质中总热含量。对于热解,焓意味着生物质转化为各种产品(石油、天然气和焦炭)所消耗的总能量(Daugaard and Brown,2003)。运用公式(12)~(14)计算热力学参数的结果如表2所示。将ΔH和转化率的变化关系作图,如图8所示,随着转化率的增加,ΔH总体上呈上升趋势,转化率为0.2时,FWO和KAS两种方法的ΔH最小,分别为182.38和181.47 kJ/mol,平均ΔH分别为289.04和288.24 kJ/mol,两种方法所得转化率间的ΔH差异较小,在5.00~10.00 kJ/mol。
吉布斯自由能也称为自由焓,指样品在热解过程中形成活化复合物的总能量增加部分(Kim et al.,2010;Sheng et al.,2014)。圖9和图10分别表示用FWO法和KAS法计算不同加热速率下ΔG的变化规律。由图9和图10可知,加热速率对ΔG的变化有明显影响,5 ℃/min加热速率下的ΔG在转化率0.2~0.8范围内均保持最大值,且各转化率间ΔG差异也较明显,采用FWO法和KAS法计算出的ΔG分别为203.33~211.46 kJ/mol和202.06~211.68 kJ/mol,其平均值分别为207.87和208.01 kJ/mol。
由图11和图12可知,随着转化率的增加,FWO法和KAS法计算的ΔS总体上呈上升趋势,除转化率为0.2时ΔS为负值外,转化率0.3~0.8其ΔS均保持正值,且当转化率为0.6时ΔS达最大值。
3 讨论
从工业分析和元素分析结果可知,滤泥具有较高热值且热解性较好。挥发分含量较高(52.88%),与滤泥本身的性质有关,挥发分含量较高对热解和气化过程非常有利。滤泥灰分含量为44.34%,含量相对较高,但灰分中部分物质对热解起催化作用。从甘蔗汁中沉淀出来的大部分物质都在滤泥里,主要包括蛋白质、粗脂肪、木质素、纤维素、半纤维素、蔗糖、磷酸盐和碱金属氧化物等,每种成分具有不同的分解温度区域(Yang et al.,2005)。从滤泥的热解特性分析结果可知,热解主要分为3个阶段,与Kaur等(2017)对蓖麻渣热解特性研究结果一致。第一阶段,在温度达110 ℃左右,TG曲线稍微有所下降,DTG曲线出现失水峰,这一阶段是已知的脱水阶段,表示滤泥中弱结合水和一些蛋白质提取物发生水解。第二阶段主要是蔗糖、纤维素、半纤维素和粗脂肪等在150~510 ℃的分解,有大量挥发性物质产生,曲线失重率最大,表明这是滤泥热解的主要阶段;在该热解阶段,滤泥中蔗糖等物质快速分解,滤泥含碳化合物的C-C键发生断裂,二氧化碳含量增加,水蒸气含量减少,且有部分一氧化碳产生。第三阶段在510~800 ℃,是一个被动热解过程,该热解阶段主要是木质素的分解,大部分磷酸盐和碱金属氧化物也在这一阶段分解,留下无法被热解的灰分物质和固定碳。在整个热解阶段,炭和焦油是热解过程中产生的主要产物。随着加热速率的上升,从DTG曲线可知滤泥的最大失重率增加,同时最大失重率所对应的温度也逐渐升高,TG曲线则表现向高温侧移动出现热滞后效应。这是由于滤泥热解为吸热反应,且滤泥导热性较差,加热速率的上升导致滤泥颗粒内外温差变大,使得内部的热解气体来不及扩散,从而影响颗粒内部的热解。通常优选较低的加热速率,因为在较低加热速率下可不断加热生物质颗粒,并向其内部提供更好的热传递,促使更多的挥发性物质释放,热解后残留物更少。
动力学分析可知转化率随温度升高而逐渐增加,生物质中挥发性物质在高温下更易揮发。在同一温度下,加热速率越快,转化率反而越低,因为加热速率越快,达到同一温度所需时间越短,挥发分析出不完全。由FWO法和KAS法测得滤泥活化能的关系可知,当转化率从0.2增至0.6,活化能一直在增加,表明这个阶段是吸热反应,即滤泥在刚开始热解时需要吸收热量。转化率从0.7增至0.8,活化能在减小,表明这个阶段是放热反应,即转化率达0.7后,热解基本稳定,热解产生能量大于热解消耗能量,故活化能在减小。活化能的这种波动是由复杂热解反应引起,表明在惰性气体条件下存在平行、竞争和复杂反应。同时,活化能的变化也可能是由于生物质中组分的百分比及组分间的相互作用所导致(Ma et al.,2015)。当转化率为0.2时,对应滤泥热解的温度约为555 ℃,此时失重是由于木质素及磷酸盐等的分解造成,活化能较低。根据FWO法和KAS法计算活化能存在微小差异,可能是利用无模型方法在计算时所造成的合理差异。滤泥的平均活化能高于污水污泥活化能(160~270 kJ/mol)(Soria-Verdugo et al.,2013),表明滤泥热解反应的壁垒高于污水污泥的热解反应。运用FWO和KAS方法计算出的指前因子在1022~1039范围内,通常低指前因子(<109)表示此时反应为表面反应;指前因子越高,表示反应进行得越迅速,说明滤泥的整个热解反应过程较迅速。此外,指前因子随着转化率的增加总体上呈上升趋势,可能是随着转化率的增加,颗粒碰撞强度增加所导致。
由ΔH和转化率的关系图可知,每个转化点处ΔH微小差异有利于活化复合物的形成,是由于活化复合物间的能量差异所导致(Vlaev et al.,2007)。使用FWO和KAS方法计算出的平均ΔH分别为289.04和288.24 kJ/mol,表明在滤泥热解过程中需要吸收较多热量,主要进行吸热反应。滤泥的ΔG高于米糠(167.17 kJ/mol)、牛粪(176.60 kJ/mol)及鸡粪(175.29 kJ/mol)的ΔG(Xu and Chen,2013),表明滤泥的热解相较于米糠等物质热解需从外界吸取更多能量,与Kaur等(2017)对蓖麻渣热解特性研究结果一致。
FWO法和KAS法计算的ΔS有正值和负值,ΔS为负值,表示在热解过程中产物的键解离复杂程度低于初始反应物。低ΔS意味着滤泥热解仅通过物理和化学变化,使其处于接近其热力学平衡状态。在这种状态下,滤泥显示出很小的反应性,且需要更多时间来形成活化的复合物。转化率为0.3时ΔS变为正值,之后ΔS一直增加且保持正值。从热力学第二定律可知,任何化学反应均向着ΔS增大方向进行,表明滤泥热解符合熵增原理。
4 结论
滤泥的热解主要分为3个阶段,失重主要集中在第二阶段(150~510 ℃);较低的加热速率有利于滤泥的热解反应。FWO和KAS模型均能较好地描述滤泥热解过程,滤泥热解过程的活化能和指前因子间存在明显动力学补偿效应。
参考文献:
范方宇,黄元波,杨晓琴,郑云武,刘灿,王珍,郑志峰. 2018. 果壳生物质热解特性与动力学[J]. 生物质化学工程,52(6):8-14. [Fan F Y,Huang Y B,Yang X Q,Zheng Y W,Liu C,Wang Z,Zheng Z F. 2018. Pyrolysis characte-ristics and kinetics of shells biomass[J]. Biomass Chemical Engineering,52(6):8-14.]
傅旭峰,仲兆平,肖刚,李睿. 2009. 几种生物质热解特性及动力学的对比[J]. 农业工程学报,25(1):199-202. [Fu X F,Zhong Z P,Xiao G,Li R. 2009. Comparative study on pyrolysis characteristics and dynamics of grass biomass[J]. Transactions of the Chinese Society of Agricultural Engineering,25(1):199-202.]
蒋剑春,沈兆邦. 2003. 生物质热解动力学的研究[J]. 林产化学与工业,23(4):1-6. [Jiang J C,Shen Z B. 2003. Study on reaction kinetics of biomass pyrolysis[J]. Chemistry & Industry of Forest Products,23(4):1-6.]
赖艳华,吕明新,马春元,施明恒. 2002. 秸秆类生物质热解特性及其动力学研究[J]. 太阳能学报,23(2):203-206.[Lai Y H,Lü M X,Ma C Y,Shi M H. 2002. Study on the characteristics and dynamics of pyrolysis process agricultural residues[J]. Acta Energiae Solaris Sinica,23(2):203-206.]
王瑀喆,汪波,张桉童,李永华. 2017. 生物质热解实验及其动力学模型研究[J]. 电力科学与工程,33(1):21-27. [Wang Y Z,Wang B,Zhang A T,Li Y H. 2017. Study on the biomass pyrolysis experiment and kinetics model[J]. Electric Power Science and Engineering,33(1):21-27.]
解海卫,张晶,张艳,邓尚洵. 2018. 生物质热解实验及其动力学研究[J]. 能源与节能,(11):58-60. [Xie H W,Zhang J,Zhang Y,Deng S X. 2018. Study on biomass pyrolysis experient and kinetics[J]. Energy and Conservation,(11):58-60.]
于娟,章明川,沈軼,范卫东,周月归. 2002. 生物质热解特性的热重分析[J]. 上海交通大学学报,36(10):1475-1478.[Yu J,Zhang M C,Shen Y,Fan W D,Zhou Y G. 2002. Thermogravimetric analysis of pyrolysis characteristics of biomass[J]. Journal of Shanghai Jiaotong University,36(10):1475-1478.]
Akahira T,Sunose T.1971. Method of determining activation deterioration constant of electrical insulating materials[J].Research Report of Chiba Institute of Technology,16:22-31.
Bach Q V,Chen W H. 2017. A comprehensive study on pyrolysis kinetics of microalgal biomass[J]. Energy Conversion and Management,131:109-116.
Bhat S A,Singh J,Vig A P. 2016. Effect on growth of earthworm and chemical parameters during vermicomposting of pressmudsludge mixed with cattle dung mixture[J]. Proce-dia Environmental Sciences, 35:425-434.
Daugaard D E,Brown R C. 2003. Enthalpy for pyrolysis for several types of biomass[J]. Energy & Fuels,17(4):934-939.
Flynn J H,Wall L A. 1966. A quick,direct method for the determination of activation energy from thermogravimetric data[J]. Journal of Polymer Science Part B Polymer Letters,4(5):323-328.
Gai C,Dong Y P,Zhang T H. 2013. The kinetic analysis of the pyrolysis of agricultural residue under non-isothermal conditions[J]. Bioresource Technology,127:298-305.
Kaur R,Gera P,Jha M K,Bhaskar T. 2017. Pyrolysis kinetics and thermodynamic parameters of castor(Ricinus communis) residue using thermogravimetric analysis[J]. Bioresource Technology,250:422-428.
Kim Y S,Kim Y S,Kim S H. 2010. Investigation of thermodynamic parameters in the thermal decomposition of plastic waste-waste lube oil compounds[J]. Environmental Scien-ce & Technology,44(13):5313-5317.
Kissinger H E. 1956. Variation of peak temperature with hea-ting rate in differential thermal analysis[J]. Journal of Re-search of the National Bureau of Standards,57(4):217-221.
Ma Z Q,Chen D Y,Gu J,Bao B F,Zhang Q S. 2015. Determination of pyrolysis characteristics and kinetics of palm kernel shell using TGA-FTIR and model-free integral methods[J]. Energy Conversion & Management,89:251-259.
Ozawa T.1965. A new method of analyzing thermogravimetric data[J]. Bulletin of the Chemical Society of Japan,38(11):1881-1886.
Sheng J F,Ji D X,Yu F W,Cui L,Zeng Q Z,Ai N,Ji J B. 2014. Influence of chemical treatment on rice straw pyrolysis by TG-FTIR[J]. IERI Procedia,8:30-34.
Soria-Verdugo A,Garcia-Hhernando N,Garcia-Gutierrez L M,Ruiz-Rivas U.2013. Analysis of biomass and sewage sludge devolatilization using the distributed activation e-nergy model[J]. Energy Conversion & Management,65:239-244.
Vlaev L T,Georgieva V G,Genieva S D. 2007. Products and kinetics of non-isothermal decomposition of vanadium(IV) oxide compounds[J]. Journal of Thermal Analysis & Calorimetry,88(3):805-812.
Vyazovkin S,Burnham A K,Criado J M,Pérez-Maqueda L A,Popescu C,Sbirrazzuoli N. 2011. ICTAC Kinetics Committee recommendations for performing kinetic computations on thermal analysis data[J]. Thermochimica Acta,520(1-2):1-19.
Xu Y L,Chen B L. 2013. Investigation of thermodynamic parameters in the pyrolysis conversion of biomass and manure to biochars using thermogravimetric analysis[J]. Bioresource Technology,146:485-493.
Yang H P,Yan R,Chen H P,Zheng C G,Lee D H,Liang D T. 2005. In-depth investigation of biomass pyrolysis based on three major components:Hemicellulose,cellulose and lignin[J]. Energy & Fuels,20(1):388-393.
(責任编辑 罗 丽)
