紫苏原花青素提取及对A549细胞的抗增殖活性研究
2019-09-10王晴李红侠李梅梅
王晴 李红侠 李梅梅




摘 要:为提高紫苏利用率,探究紫苏花青素最佳提取条件并对其抗癌活性进行研究.以新鲜紫苏叶为试验材料,采用超声波辅助提取法,研究在不同提取温度、提取时间、溶剂浓度和溶液酸碱度条件下对原花青素提取效果的影响,并用噻唑蓝法测定提取的花青素对肿瘤细胞(A549)的抗增殖活性.结果表明,当提取温度为60℃、时间为90min、溶剂浓度为70%以及pH为8时,原花青素提取的效果最好;原花青素浓度为100μg/mL时,对A549细胞的抗增值性较好,IC50值为28.67μg/mL.
关键词:紫苏;原花青素;A549细胞;抗增殖活性
中图分类号:Q946 文献标识码:A 文章编号:1673-260X(2019)12-0028-03
0 引言
由于人们对饮食健康的重视,天然色素的需求日益增多,且其对癌症、眼疾、心血管疾病等具有较好的预防效果[1],因此开发、研究和利用天然食用色素成为研究热点.紫苏属唇形科,是一年生草本植物,新鲜紫苏叶片中,花色素苷类色素含量大,具有较好的开发前景.花色素苷是一种类黄酮类天然色素,不仅具有较强的抗氧化作用,还具有自由基清除活性[2].花色苷类物质在抗消炎作用、关节炎、预防心脑血管疾病、神经细胞衰老、癌症、糖尿病等起着重要作用[3].恶性肿瘤是严重威胁人类生命和健康的疾病,其发病率和死亡率仅次于心脑血管疾病,位列第二[4].近年来癌症的治疗,常采用手术、化疗等措施,其中化疗在综合治疗领域有着重要地位,但在临床应用时化疗仍存在疗效、副作用以及肿瘤细胞耐药等方面问题.原花青素可预防细胞突变、癌细胞生成,控制肿瘤生长快慢,减小肿瘤体积[5,6].以紫苏叶为材料,探究其原花青素最佳提取工艺,并进行抗癌活性試验,为色素在抗癌方面的研究提供理论依据.
1 材料与方法
1.1 材料与试剂
新鲜紫苏叶(宿州科学院提供);A549细胞株(购于上海细胞生物学研究所);甲醇、盐酸、醋酸铅、乙酸(均购于上海国药集团).
1.2 主要仪器
扫描酶标仪(Sunrise,奥地利TECAN);CO2培养箱(Heracel,美国Kendro);倒置荧光显微镜(OLYMPUS CX-40,日本OLYMPUS)等.
1.3 试验方法
工艺流程:紫苏叶→烘干→粉碎→过筛→提取→浓缩→测定
1.3.1 原料预处理
将紫苏叶用水洗净,沥干,置于干燥箱烘干至恒重(35-40℃),将烘干的紫苏叶用粉碎机粉碎,过50目筛,待用.
1.3.2 紫苏原花青素含量测定
称取原花青素标准品5.0mg,用调节pH后的去离子水定容到50mL,分别配制0.05、0.1、0.2、0.3、0.4、0.5mg/mL标准品溶液浓度系列.以纯净水为参比液进行紫外检测,原花青素标准溶液在765nm处有最大吸光度.根据标准品溶液的吸光度与浓度之间的关系,将所得的数据经过回归处理后,绘制出紫苏原花青素标准品的标准曲线y=2.2367x+0.0688.R2=0.9986.
1.3.3 单因素试验
称取备用的紫苏叶粉末2.0g于容量瓶中,提取剂用60%、70%、80%的pH为4、6、8的甲醇,在40℃、50℃、60℃、70℃、80℃五个不同温度下超声提取70min、80min、90min,提取液经过2000r/min离心10min过滤后吸取0.5mL,再用调节pH后的纯净水定容至50mL容量瓶中,在最大波长765nm下测得吸光度ΔA的值,根据吸光度ΔA的值,利用回归方程解出浓度,再计算出提取液中原花青素含量.
1.3.4 正交试验
根据单因素试验结果,得出较优水平,根据四因素三水平正交表[7]进行正交试验,以提取液原花青素浓度为指标,探究最佳提取工艺.
1.3.5 原花青素抗肿瘤细胞的增殖实验
收集对数期A549细胞,吹悬浮混匀并稀释至每孔细胞数约5×103个,铺于96孔细胞培养板上,每孔100μL细胞悬液.孔板外围边缘用PBS液体等体积填充.细胞贴壁后加入配置好的紫苏花青素溶液,4个浓度,3个重复.每孔100μL.24h后,每孔加20μL MTT溶液,继续培养4h.用酶联免疫检测仪在490nm波长处测定光吸收值,根据寇氏公式,计算IC50值[8].
2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度对原花青素提取效果的影响
温度越高,细胞膜的通透性越高,会加速对细胞的破坏,从而使得细胞内溶物相比较容易提取,但温度过高,原花青素含量降低,因为高温易使原花青素分解.如图1所示,提取液原花青素含量随温度升高而增加,60℃时达到峰值;超过60℃,原花青素含量呈下降趋势,说明原花青素具有热不稳定性,最佳提取温度为60℃.
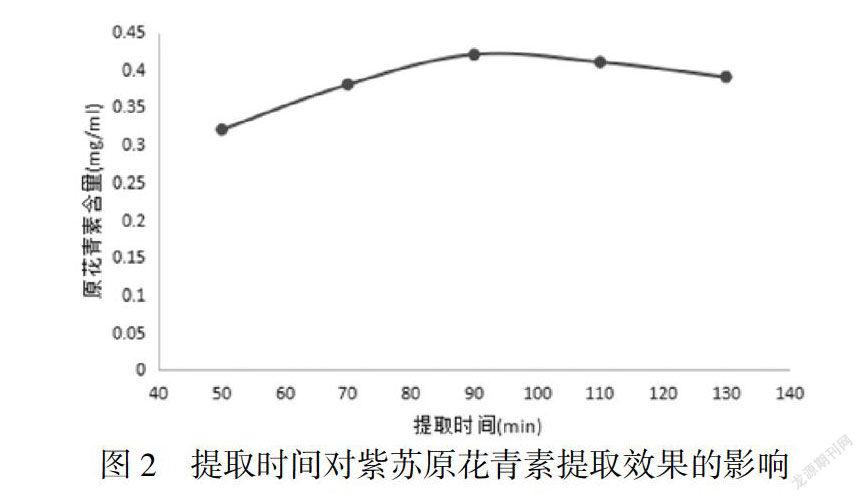
2.1.2 提取时间对原花青素提取效果的影响
由图2可知,90min前原花青素含量随提取时间增加呈上升趋势,当时间达到90min时原花青素含量达到最大,随后开始下降.提取时间过长原花青素的稳定性降低,导致原花青素容易分解;提取时间过长还会导致原花青素含量的损失,因为紫苏中含有多酚氧化酶,而多酚氧化酶能够破坏紫苏原花青素.但提取时间过短则导致提取不充分,因此最佳提取时间为90min.
2.1.3 甲醇浓度对原花青素提取效果的影响
随着甲醇浓度逐渐升高,提取液原花青素含量上升,甲醇浓度为70%时达到最高.因为紫苏中还含有很多的糖和其他水溶性色素等,低浓度甲醇提取时糖和水溶性色素的溶解性较好,而这些物质会影响原花青素的溶出,高浓度甲醇提取时,原花青素提取效果较好,因为极性较强的糖和水溶性色素等此时溶出较少.由图3可知,最佳甲醇浓度为70%.
2.1.4 pH对原花青素提取效果的影响
由图4可知,当pH为6时,紫苏原花青素的含量最高,稳定性最好,当pH<6.0时,原花青素的含量是随着pH上升而上升,当pH>6.0时,原花青素含量随pH上升而减少的,故最佳提取溶剂pH为6.
2.2 正交试验结果
由表1可知,在单因素的基础上进行正交试验,由K值数据可以得出,最优提取条件是60℃下用pH为8的70%的甲醇提取90min.
2.3 原花青素抗癌活性
由表2可得,当原花青素浓度为100μg/mL时对A549细胞的抑制作用最好.
3 结论与讨论
提取温度、提取时间、甲醇浓度、pH值均会影响紫苏原花青素的提取效果,通过单因素和正交试验得到最优条件为:提取温度为60℃、提取时间为80min、甲醇浓度为70%、pH值为8,经验证此时提取液原花青素含量为5.36mg/mL.紫苏原花青素对A549癌细胞的抑制性较强,且随花青素浓度的增大,對癌细胞的抑制性增强,与蓝莓花青素呈现剂量依赖性诱导癌细胞凋亡[9]结论一致,也与葡萄籽原花青素在抗癌作用上相同[10].紫苏原花青素既不影响机体正常细胞又对A549癌细胞具有极强的细胞抑制性,提示其具有较好的抗癌活性,对其在抗癌药物的应用提供理论依据.
参考文献:
〔1〕李红侠,方雪梅,徐礼生,等.蓝莓冻果花色素苷的提取及抗癌活性的研究[J].中国食品添加剂,2017(2):87-92.
〔2〕段文凯,尹涛,解玲琴.草莓花青素的微波提取工艺研究[J].现代食品,2019:79-84.
〔3〕谭利利,徐俊英,龚珂,等.花色素的抗癌研究进展[J],吉林医药学院学报,2014,35(2):128-132.
〔4〕JemalA, Bray F, Center MM, etal. Global cancer statistics. CA-Cancer J Clin 2011;61:69-90.
〔5〕王二雷.蓝莓花青素高纯提取物的制备技术及诱导肿瘤细胞凋亡作用研究[D].吉林大学,2014,35(4):35-96.
〔6〕张勇,周丽明,张超,等.苹果原花色素提取分离及其抗氧化作用[J].上饶师范学院学报,2018,38(6):56-60.
〔7〕刘娟,齐永亮.正交试验法优选铃兰总黄酮的提取工艺[J].佳木斯大学学报(自然科学版),2007, 25(4):563.
〔8〕Mohammad Fattahi, Vahideh Nazeri, Laura Torras-Claveria, etal. A new biotechnological source of rosmarinic acid and surface flavonoids: Hairy root cultures of Dracocephalum kotschyi Boiss[J] . Industrial Crops & Products. 2013, 119(4):65-68.
〔9〕侯锐,王利,李少伟,等.蓝莓花青素诱导结肠癌LS174T细胞凋亡和抑制其增殖[J].基础医学与临床,2016,36(11):68-72.
〔10〕王华,刘霞,杨继红.等.华葡萄籽原花青素抗癌活性及其机制研究进展[J].安徽大学学报(自然科学版),2012,36(4):101-108.
