硫辛酸注射液仿制药与原研药的制剂质量比较及其小鼠急性毒性实验研究
2019-09-10田园孔德志刘紫琪张赛航任雷鸣
田园 孔德志 刘紫琪 张赛航 任雷鸣



摘 要 目的:对硫辛酸注射液的原研药与国内2个厂家的仿制药进行制剂质量比较及小鼠急性毒性实验研究,探讨一致性评价方法的项目。方法:依据《中国药典》的相关质量标准,检测并比较3个厂家硫辛酸注射液样品的理化性质(性状、pH、渗透压等)、含量、有关物质及小鼠急性毒性实验(n=10)中的半数致死量(LD50)及以注射液原液注射给药后小鼠(n=30)死亡情况。结果:原研药与2個仿制药在理化性质和有关物质检查方面均符合质量标准,3个样品含量均为95%~105%;急性毒性试验结果显示2个仿制药的LD50值(LD50:247.911 mg/kg,95%置信区间222.209~277.999 mg/kg;LD50:215.291 mg/kg,95%置信区间196.637~235.053 mg/kg)明显低于原研药的LD50值(LD50:266.534 mg/kg,95%置信区间250.597~283.418 mg/kg),但差异无统计学意义(P>0.05)。取注射液原液直接单剂量注射时,3次重复实验结果显示2个仿制药引起的小鼠的死亡数(26、28只)与原研药(19只)比较差异有统计学意义(P均<0.05),且给药后原研药小鼠出现窜动和惊叫等兴奋性反应,而2个仿制药呈现抑制性反应。结论:硫辛酸注射液的2个仿制药与原研药在制剂质量标准方面均符合《中国药典》的有关规定,但是急性毒性实验结果差异较大,难以证明这2个仿制药与原研药的一致性;在注射液的一致性评价项目中建议纳入急性毒性实验。
关键词 一致性评价;硫辛酸注射液;含量;有关物质;理化性质;急性毒性实验
ABSTRACT OBJECTIVE: To compare the quality of original preparations of Thioctic acid injection and generic preparations from 2 domestic manufacturers, discuss the acute toxicity test of mice and to investigate the project of consistency evaluation methods. METHODS: According to the quality standard that stated in Chinese Pharmacopeia, physicochemical properties (characters, pH, osmotic pressure, etc., contents and related substances of samples of Thioctic acid injection as well as LD50 in acute toxicity test (n=10), and mortality of mice after administration of injection solution (n=30) were compared among 3 manufacturers. RESULTS: The physicochemical properties as and related substances of the original drug and 2 generic drugs were all in line with the quality standard; the contents of 3 samples ranged 95%-105%. The acute toxicity test results showed that the LD50 values of 2 generic drugs (LD50: 247.911 mg/kg, 95% confidence interval: 222.209-277.999 mg/kg;LD50: 215.291 mg/kg, 95% confidence interval: 196.637-235.053 mg/kg) were smaller than that of original drug (LD50: 266.534 mg/kg, 95% confidence interval: 250.597-283.418 mg/kg), but there was no statistical difference (P>0.05). The results of 3 repeated experiments showed that there was statistical significance in the number of animal death caused by the 2 generic drugs (26, 28) was more than that of the original drug (19) (all P<0.05), when injection solution was injected into mice in a single dose. After administration of the original drug, mice showed excitatory reactions such as movement and squeal, while 2 generic drugs showed inhibitory reactions. CONCLUSIONS: 2 generic drugs of Thioctic acid injection and the original drug all conform to the relevant regulations of Chinese Pharmacopoeia in terms of preparation quality standards, but the results of acute toxicity test are quite different, so it is difficult to prove the consistency between the 2 generic drugs and the original drug. Therefore, acute toxicity test is necessary for the consistency evaluation of injections.
KEYWORDS Consistency evaluation; Thioctic acid injection; Content; Related substances; Physicochemical properties; Acute toxicity test
硫辛酸(1,2-二硫戊环-3-戊酸)是一种强效天然抗氧化剂,兼具水溶性和脂溶性,广泛存在于各种原核细胞和真核细胞中,能直接清除多种自由基和活性氧,尚能再生机体的其他抗氧化物以及螯合金属离子[1-3]。硫辛酸注射液(德国史达德大药厂)在2005年进入中国市场,用于治疗糖尿病周围神经病变引发的感觉异常[4-5]。随后,该药的国产仿制药也获批上市。截至2019年6月,笔者通过国家药品监督管理局网站查询到目前共有11家药厂在生产此药。由于历史原因,我国仿制药品的质量仍有一定的提升空间,因此开展仿制药一致性评价很有必要。目前,药品的一致性评价工作已经不单单局限在口服固体制剂,注射剂的一致性评价工作也已经在开展。在2018年国家药品监督管理局颁布的《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》中要求:对于不具有完整、充分的安全性、有效性数据的已上市注射剂,都要开展药品再评价。但由于该文件中未列出具体再评价项目标准,因此笔者希望通过本研究对硫辛酸注射液国产仿制药与原研药的制剂质量及毒性一致性评价方法进行探索。经查询,有文献报道了国内仿制药注射用硼替佐米以及注射用丙戊酸钠与进口原研产品的质量一致性研究,该研究主要开展了理化性质、杂质检查、含量等项目的对比,最终认为仿制药与原研药的质量具有一致性[6-7]。但是原研药与仿制药的毒性是否一致也是一项十分重要的指标,鉴于注射剂的急性毒性试验对于制药企业是一个常规的安全性评价手段,笔者拟对德国史达德大药厂的硫辛酸注射液(原研药,规格:12 mL ∶ 300 mg)与国内2018年销售额排行前两名(经笔者调查所得)的硫辛酸注射液仿制药(三者主成分质量浓度一致)进行理化性质、含量测定、有关物质检查和小鼠急性毒性试验的对比研究,通过结果比较探讨一致性评价的检测项目。
1 材料
1.1 仪器
安捷伦1260高效液相色谱仪(美国安捷伦公司);Cubis微量天平(德国Sartorius公司);pH测定仪(梅特勒-托利多仪器有限公司);VAPRO 5600渗透压仪(美国Wescor公司)。
1.2 药品与试剂
硫辛酸对照品(北京恒元启天化工技术研究所和北京世纪奥科生物技术有限公司联合研制,批号:17072705,供实验室药品检验用,纯度:99.52%);硫辛酸注射液A药(原研药,德国史达德大药厂,批号:72009,规格:12 mL ∶ 300 mg);硫辛酸注射液B药(仿制药,国内某药厂,批号:180601,规格:6 mL ∶ 150 mg);硫辛酸注射液C药(仿制药,国内某药厂,批号:17961140,规格:6 mL ∶ 150 mg);磷酸二氢钾、磷酸均为分析纯;甲醇、乙腈均为色谱纯;超纯水由Thermo Scientific Nanopure超纯水机制备。
1.3 动物
SPF级昆明小鼠18~22 g,♀♂各半,由河北医科大学动物中心提供,实验动物生产许可证号:SCXK(冀)2018-004,实验动物质量合格证编号:1808006。实验前在温度23 ℃左右、相对湿度50%左右、明暗各12 h的实验室饲养1周,期间自由饮食饮水。
2 方法与结果
2.1 理化性质检查
参照2015年版《中国药典》(四部)[8],对3种硫辛酸注射液(A药、B药和C药)的性状、pH、颜色、渗透压等质控项目进行对比考察,结果显示原研药与2个仿制药在理化性质检查方面均符合药典标准,详见表1。
2.2 含量测定
2.2.1 色谱条件 色谱柱:Waters symmtry C18(100 mm×3.0 mm,3.5 µm),流动相:0.1%磷酸水-乙腈 (70 ∶ 30,V/V)[9],流速:1 mL/min,检测波长:210 nm,柱温:35 ℃;进样量:5 µL。
2.2.2 溶液制备 对照品溶液:精密称取硫辛酸对照品10.0 mg,置于5 mL棕色量瓶中,用50%乙腈水溶解稀释至刻度,避光4 ℃保存。供试品溶液:精密量取3个批号的硫辛酸注射液各100.0 µL,分别置于5 mL棕色量瓶中,用50%乙腈水稀释至刻度,避光4 ℃保存。
2.2.3 方法学考察 (1)专属性。由于仿制药B药和C药处方中均含有苯甲醇,故分别取苯甲醇溶液、硫辛酸对照品溶液及A药、B药和C药制备成的供试品溶液,按“2.2.1”项下条件进样分析,结果显示各检测成分分离良好,苯甲醇对主药色谱峰的分析未见干扰,色谱见图1。
(2)精密度。取上述对照品溶液,在“2.2.1”项下条件重复进样6次,测得硫辛酸峰面积的RSD为0.34%(n=6);连续3 d测定,硫辛酸峰面积的RSD为3.92%(n=3),表明仪器日内、日间精密度均良好。
(3)重复性。按“2.2.2”项下供试品溶液制备方法制备供试品溶液(批号:72009)6份,按“2.2.1”项下条件分别进样分析,测得硫辛酸峰面積的RSD为0.16%(n=6),表明试验重复性良好[10]。
(4)标准曲线与线性范围。分别精密吸取硫辛酸对照品适量,制备成质量浓度为0.123 3、0.197 2、0.246 5、0.394 4、0.493 0、0.788 8、0.986 0 mg/mL的溶液进样分析,对质量浓度(x)与峰面积(y)进行回归计算,得线性方程结果为y=3 530.2x-61.25(R2=0.999 8)。表明硫辛酸检测质量浓度线性范围为0.123 3~0.986 0 mg/mL。
(5)稳定性。硫辛酸为见光易分解药物,取供试品(批号:72009)溶液在室温避光条件下放置0、1、2、4、8、12、24、48 h后,按“2.2.1”项下条件进样分析,测得硫辛酸峰面积的RSD为1.39%(n=6),表明供试品溶液在室温避光条件下放置48 h内稳定。
(6)方法耐用性。取供试品(批号:72009)溶液,考察方法在不同品牌色谱柱、柱温、流动相、检测波长下的耐用性。结果表明,各因素在试验范围内变动时,供试品中硫辛酸含量的RSD均<2%(n=3),表明本试验色谱条件对不同品牌色谱柱、柱温、流动相和检测波长的耐用性较好,结果见表2。
(7)加样回收率。取已知含量的硫辛酸注射液(批号:72009)共9份,并按硫辛酸注射液质量浓度的80%、100%、120% 精密取适量硫辛酸对照品各3份,混合后分别进样,记录峰面积,测定回收率,结果表明方法准确度较好,详见表3。
2.2.4 含量测定 取3个厂家的样品,制备成供试品溶液后进样,计算注射液中硫辛酸的含量,取平均值。结果,A药和B、C药的含量均在95%~99%,符合要求(95%~105%),结果见表4。
2.3 注射液中有关物质检查
根据《欧洲药典》硫辛酸有关物质检查项条件[11],对3个厂家的样品进行有关物质检查,每个杂质峰的峰面积要小于硫辛酸峰面积的0.1%[12]。条件如下:色谱柱为DIKMA Diamonsil C18(250 mm×4.6 mm,5 µm),流動相为乙腈-0.7 g/L磷酸二氢钾(用磷酸调pH为3)-甲醇 (8 ∶ 41 ∶ 51,V/V/V),流速为1.2 mL/min,检测波长为215 nm,柱温为35 ℃,进样量为20 µL,记录色谱图至25 min。总杂质峰面积不得超过对照溶液主峰峰面积的2倍(1.0%)[13]。用不加校正因子的主成分自身对照法,测得A、B、C各样品中总杂质含量分别为0.016 9%、0.006%和0.005%,B、C药总杂质含量均低于原研药,2个仿制药与原研药在有关物质检查方面均符合质量标准。
2.4 小鼠急性毒性实验
2.4.1 实验方法 采用Bliss法,进行小鼠急性毒性实验[14-16]。首先对A药进行预实验,得出最大剂量和最小剂量范围。将小鼠随机分为250.0、225.0、202.5、182.3 mg/kg 4个剂量组,组间距r=0.9,给药体积为0.10 mL/10 g,每组10只,尾静脉注射给药。182.3 mg/kg 和202.5 mg/kg 这2个剂量组未见小鼠死亡,因此,最小剂量基本可以确定在202.5 mg/kg(引起小鼠零死亡的较高剂量)。之后,将剂量调整为202.5、225.0、250.0、276.0、309.0 mg/kg继续给药,309.0 mg/kg剂量仍不能致小鼠完全死亡,故仍需要升高剂量;最终,正式实验设定A药的剂量组为203.6、231.4、263.0、298.9、339.7 mg/kg,组间距r=0.88,给药体积为0.14 mL/10 g。同理,B药和C药按照上述方法进行预实验,B药采用187.0、212.5、250.0、277.8、308.7 mg/kg 5个剂量组进行正式实验;C药采用164.6、187.0、212.5、250.0、277.8 mg/kg 5个剂量进行正式实验;对照组静脉注射同体积的生理盐水。正式实验时,每日取小鼠30只,随机分为3组,各组分别静脉注射最低剂量的A药、B药或C药,每日上午9:00给药;次日同法给予第二个剂量的A药、B药或C药,直至完成所有剂量的给药。每组实验后需记录14 d内小鼠的活动、体质量及死亡数。观察期结束后,将存活小鼠处死,解剖主要脏器观察是否发生变化[17]。
2.4.2 统计学方法 应用SPSS 22.0软件进行统计学分析,采用t检验分别比较仿制药与原研药的半数致死量(LD50)之间差异是否有统计学意义。单剂量一次性给药的小鼠急性毒性试验结果,以死亡只数表示,采用χ2检验分别比较仿制药与原研药组间的差异。小鼠体质量(g)变化数据采用实测值计算x±s,多组间体质量均数的比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2.4.3 小鼠的LD50 采用SPSS 22.0软件的Probit回归法对急性毒性实验数据进行LD50及95%置信区间的计算[18],结果见表5。
由表5可见,仿制药与原研药的小鼠急性毒性实验结果(LD50)存在差别:266.534 mg/kg(A药)>247.911 mg/kg(B药)>215.291 mg/kg(C药);但是,3组间进行统计学分析时,差异未见统计学意义(P>0.05)。
2.4.4 小鼠的急性毒性表现 A药:231.4 mg/kg和203.6 mg/kg剂量组给药后小鼠无任何异常表现;另外3个剂量组中约70%的小鼠给药后立即出现四肢僵直,在笼内窜动、惊叫,持续约3 min,呈现兴奋性反应。B药:各剂量组给药后有30%~80%小鼠表现为侧卧、四肢抽搐、呼吸急促以及翻正反射消失,约2 min后恢复正常。C药:各剂量组给药后有30%~70%小鼠表现为俯卧瘫软、全身轻微颤抖,约5 min后恢复正常;B、C药均呈现抑制性反应。
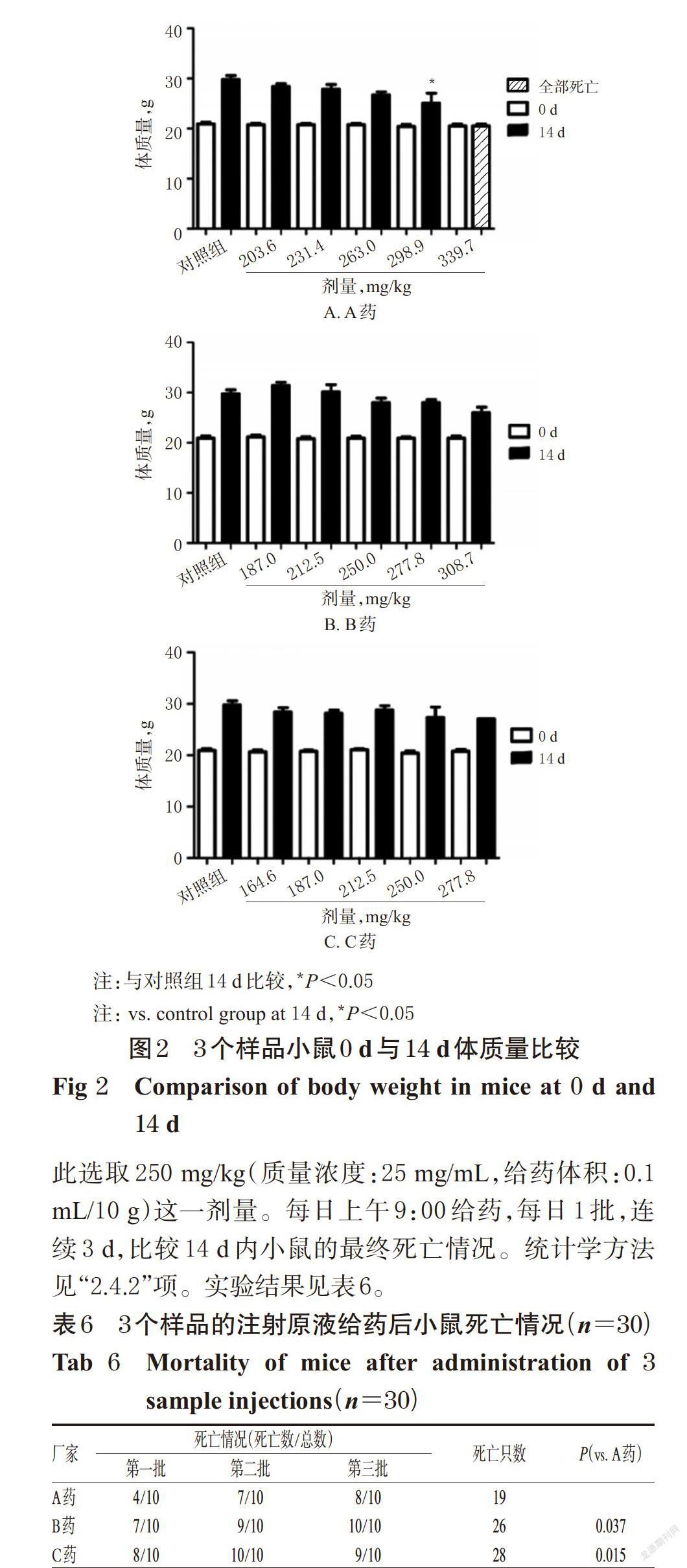
2.4.5 小鼠的体质量变化 实验前(0 d)A药、B药和C药组小鼠的体质量,在组间和组内(每组的各剂量组间)比较差异均无统计学意义(P>0.05)。14 d后小鼠的体质量,仅A药298.9 mg/kg剂量组与对照组比较,体质量显著降低(P=0.033);其余各剂量组以及B药和C药各剂量组小鼠体质量与对照组比较,差异均无统计学意义(P>0.05)。各组小鼠体质量比较见图2。
2.5 3个样品原液给药后小鼠死亡情况比较
尽管上述B药和C药的LD50值明显低于A药,但是统计学分析结果显示3个样品的LD50值差异并无统计学意义(P>0.05)。为了合理比较A、B、C 3个样品静脉注射的毒性大小,笔者进一步做了A、B、C 3个样品原液单次静脉注射给药后小鼠死亡情况的比较实验。实验分3批进行,每批取小鼠30只,♀♂各半,将小鼠随机分为3组,每组10只,各组分别尾静脉注射A药、B药或C药原液。综合A、B、C 3药的LD50值(依次为266.534、247.911、215.291 mg/kg),选取中间毒性的B药的LD50值作为给药剂量更容易比较3个样品药物的毒性大小,因此选取250 mg/kg(质量浓度:25 mg/mL,给药体积:0.1 mL/10 g)这一剂量。每日上午9:00给药,每日1批,连续3 d,比较14 d内小鼠的最终死亡情况。统计学方法见“2.4.2”项。实验结果见表6。
如表6所示,B、C 2个仿制药之间死亡只数无差异(26、28只),但B、C 2个仿制药分别与A药(19只)比较,差异均有统计学意义(P<0.05);由此可以看出A药(原研药)的毒性小,B、C药的毒性较大。
3 讨论
参考2015年版《中国药典》及仿制药一致性评价技术有关研究报道[7,19-20],笔者对3个不同厂家硫辛酸注射液的理化性质和含量等进行了检测与比较,结果表明理化性质和含量测定结果均无明显差异,表明原研药与仿制药在制剂质量方面基本一致。然而在小鼠急性毒性实验中,笔者发现尽管B药和C药的LD50值在数值上明显低于原研药,但是三者差异并无统计学意义。鉴于LD50易受多种因素影响,笔者又设计了采用药品原液直接单剂量一次性给药的平行对比实验。3次重复实验结果显示,仿制药B药和C药的毒性大于原研药,差异有统计学意义(见表6)。此外,在小鼠给药后的中毒表现方面,原研药小鼠出现窜动和惊叫等兴奋性反应,而2種仿制药呈现抑制性反应;提示仿制药诱发小鼠急性毒性反应的机制可能与原研药不同。虽然在有关物质检查方面,B药和C药2个仿制药的未知杂质含量均低于原研药,却无法排除未知杂质对急性毒性实验的影响,可能有必要对未知杂质进行定性、定量研究和毒理学研究。B药和C药2个仿制药均比原研药多添加了苯甲醇这一辅料,苯甲醇也可能是这2个仿制药毒性较大的因素。急性毒性实验结果显示,这2个仿制药与原研药存在较明显的差异。
尽管在本研究中,2个硫辛酸注射液仿制药在质量标准方面均符合《中国药典》的有关规定,但是小鼠急性毒性实验结果却有明显差异;因此难以证明这2个硫辛酸注射液仿制药与原研药在安全性方面的一致性。我国化学仿制药(注射剂)一致性评价工作刚刚起步,因此,若仅仅依据注射液的理化性质、含量和有关物质检查来评判一致性,似乎存在一定的问题。笔者认为,对于化学仿制药(注射剂)一致性评价工作,注射液的急性毒性实验结果具有重要的参考价值,建议增加对此项的评价。
参考文献
[ 1 ] HUERTA AE,NAVAS-CARRETERO S,PRIETO-HONTORIA PL,et al. Effects of α-lipoic acid and eicosapentaenoic acid in overweight and obese women during weight loss[J]. Obesity,2015,23(2):313-321.
[ 2 ] 李雅杰,王舒然.硫辛酸对慢性非传染性疾病影响[J].中国公共卫生,2014,30(2):152-154.
[ 3 ] 宋西玉,张鹏,李海霞,等.硫辛酸清除自由基的反应动力学研究[J].辐射研究与辐射工艺学报,2009,27(3):145- 150.
[ 4 ] 德国史达德大药厂.硫辛酸注射液说明书[S]. 2011-02- 01.
[ 5 ] GORĄCA A,HUK-KOLEGA H,PIECHOTA A,et al. Lipoic acid:biological activity and therapeutic potential[J].Pharmacol Rep,2011,63(4):849-858.
[ 6 ] 李曼,张丹,饶竞东,等.注射用丙戊酸钠的质量一致性评价[J].华西药学杂志,2017,32(6):621-624.
[ 7 ] 王瑞珣,杨文岭,史芳华,等.注射用硼替佐米仿制药与原研药质量一致性评价[J].沈阳药科大学学报,2018,35(7):574-580.
[ 8 ] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:133-134,375.
[ 9 ] 马宏达,胡北,吴琼,等.硫辛酸胶囊含量测定及其稳定性[J].医药导报,2014,33(3):367-369.
[10] 赵娅,冯慧,周珍,等. HPLC法同时测定四味姜黄汤散中7种成分的含量[J].中国药房,2018,29(1):29-33.
[11] EUROPEAN PHARMACOPOEIA COMMISSION. European Pharmacopeia 8.0:volume Ⅲ[S]. Strasbourg:European Directorate for the Quality of Medicine,2008:3405- 3406.
[12] 姜典卓. 2015年版《中国药典》中有关问题的探讨[J].中国药品标准,2016,17(5):325-328.
[13] 夏天水,熊全红,罗云龙. HPLC法测定硫辛酸注射液中的有关物质[J].中国药房,2016,27(21):2980-2982.
[14] 刘昌孝,孙瑞元.药物评价实验设计与统计学基础[M]. 北京:军事医学科学出版社,1999:84-88.
[15] 国家食品药品监督管理总局.药物单次给药毒性试验技术研究技术指导原则[S]. 2014-05-13.
[16] 许羚,胡玥,丁晓霜,等.雷公藤红素体内与体外急性毒性试验结果的比较[J].环境与职业医学,2015,32(6):535-538,548.
[17] USUI K,NISHIDA S,SUGITA T,et al. Acute oral toxicity test of chemical compounds in silkworms[J]. Drug Discov & Ther,2016,10(1):57-61.
[18] 周一平.用SPSS软件计算新药的LD50[J].药学进展,2003,27(5):314-316.
[19] 刘晓丹,何军,张景辰,等.注射剂仿制药一致性评价技术要求浅析[J].中国医药工业杂志,2018,49(7):999-1005.
[20] 胥洋,李晓光,赵荣生.硫辛酸注射液制剂的质量评价研究[J].中国新药杂志,2015,24(14):1624-1627,1674.
(收稿日期:2019-04-28 修回日期:2019-06-14)
(编辑:刘 萍)
