鸽毛滴虫分离培养及形态学观察
2019-09-10陆雨楠陈俊红陈羽朱秋阳曹彬彬陈瑾戴鼎震
陆雨楠 陈俊红 陈羽 朱秋阳 曹彬彬 陈瑾 戴鼎震

摘要:在生产饲养中,鸽毛滴虫感染鸽的情况较为普遍和严重,严重影响鸽的健康和经济价值。该文提供一种分离培养鸽毛滴虫并对其形态学进行观察的有效方法,为更好地了解鸽毛滴虫的形态和预防控制提供了理论支持。
关键词:鸽毛滴虫;体外培养;形态学;扫描电子显微镜
中图分类号:S858.39 文献标识码:B doi:10.3969/j.issn.2096-3637.2019.16.003
0 引言
鸽毛滴虫病(Pigeon Canker)又称口腔溃疡,是鸽最常见的一种传染性原虫病[1-2]。鸽毛滴虫属原生动物门,鞭毛纲,动鞭亚纲,多鞭毛目,毛滴虫科,毛滴虫属的禽毛滴虫[3-4]。该病的传染源主要为病鸽。患病的成年鸽可通过互相接吻或嗉囊哺育幼鸽,将鸽毛滴虫直接传递给同伴或幼鸽。另外,鸽毛滴虫还可通过污染的饲料、鸽巢垫料、伤口等途径感染鸽群[5]。鸽毛滴虫病主要造成鸽上消化道和嗉囊粘膜上出现黄色溃疡状结节,阻碍鸽的正常进食和呼吸,导致患病鸽饥饿死亡。成年鸽大多为带虫者,症状表现不明显。幼鸽症状表现明显,排出绿色粘液样粪便、羽毛杂乱且无光泽、消瘦、呼吸声加重等[6]。鸽毛滴虫大多是与大肠杆菌、念球菌等混合感染,单独感染鸽毛滴虫的病例较少。随着养鸽业的集约化发展,鸽毛滴虫病也变成养鸽场的常见病。鸽毛滴虫病因特殊的传播方式,短期内不能将其消灭干净,导致幼鸽发病率较高,对鸽养殖业造成了比较严重的危害[7]。然而,目前对鸽毛滴虫形态学的研究相对于阴道毛滴虫形态学的较少,为从根本上防治鸽毛滴虫,对鸽毛滴虫进行形态学的观察具有重要意义。鸽毛滴虫体外培养的应用对进行抗鸽毛滴虫的体外药敏试验及鸽毛滴虫形态学的研究提供了有利条件[8-9]。毛滴虫对体外培养的要求比较高,与培养基的pH值、环境温度、营养物质等因素密切相关,但培养成功后检出率高。对鸽毛滴虫进行了体外分离、纯化培养,并测定鸽毛滴虫的增殖密度。应用光学显微镜对染色后的虫体进行形态观察,并应用扫描电子显微镜更清晰的观察鸽毛滴虫的外表面结构,为更好了解鸽毛滴虫的形态提供了资料。
1 材料与方法
1.1材料
1.1.1培养用鸽毛滴虫样品
采集自患毛滴虫病的白羽王鸽的口腔及咽喉处的干酪样沉着物。
1.1.2药品与试剂
注射用硫酸链霉素(100万IU)、注射用青霉素钾(160万IU)、瑞氏一吉姆萨染色液(济南百博生物科技股份有限公司)、革兰氏染色液(济南百博生物科技股份有限公司)、L-半胱氨酸盐酸盐和标准小牛血清(郑州益康生物工程有限公司)、鸽子血清、小牛血清、麦芽糖、蛋白胨、氯化鈉、香柏油、3%戊二醛。
1.2方法
1.2.1肝浸汤培养基制备
取15g新鲜猪肝,先除去筋膜,再剪成米粒大小放入烧杯。加入100mL蒸馏水,放入冰箱保存24h。次日取出蒸煮30min。用纱布过滤取上清液,后加入0.5g氯化钠、1g麦芽糖、0.2gL-半胱氨酸盐酸盐、最后加入2g蛋白胨直至溶解,再用滤纸过滤。将滤液加蒸馏水定容至100mL,调pH至6,装入无菌玻璃瓶中,置于高温高压灭菌器内121℃,30min高温高压灭菌。冷却后置于4℃冰箱保存。抽取16mL肝浸汤溶解2瓶注射用硫酸链霉素(100万IU)和一瓶注射用青霉素钾(160万IU),待溶解均匀后装于无菌玻璃瓶内放置于冰箱内4℃保存。取3.5mL的无菌肝浸汤于无菌试管中,加入0.5mL的双抗溶液和1mL的鸽子血清,混匀后即可接种鸽毛滴虫。
1.2.2鸽毛滴虫分离鉴定
用无菌棉拭子采集鸽口腔样本后,放于无菌试管中封闭保存带回实验室。将样本接种于已制备好的毛滴虫液体培养基,37℃恒温箱静置培养48h。培养48h后混匀培养物,取一滴涂片后用光学显微镜镜检,如能发现梨形或者椭圆形,有折光性,不断运动的虫体,可初步诊断为鸽毛滴虫病[10]。
1.2.3鸽毛滴虫纯化培养
从采集的鸽毛滴虫样品中选择虫体活性状态好,且细菌和真菌相对较少的样品接种于5mL鸽毛滴虫肝浸汤培养基内进行第1代传代培养,每隔48h传代一次,传代至3代后,鸽毛滴虫培养基中细菌和真菌基本被消灭,继续每隔48h传代,得到较单纯的鸽毛滴虫培养基。
1.2.4鸽毛滴虫光学显微镜形态观察
该试验中,将纯化传代至第4代的鸽毛滴虫培养基样品取适量涂于载玻片上,用酒精灯加热固定,经瑞氏一吉姆萨染色和革兰氏染色后,按低倍镜一高倍镜的顺序观察涂片。
1.2.5扫描电子显微镜样本制备
含有毛滴虫的肝浸汤培养基800r/min,离心10min,取上清液。将上清液再次离心,3000r/min,离心10min。离心后舍弃上清液,收集虫体,取沉淀物。用3%戊二醛4℃固定过夜,用扫描电子显微镜观察鸽毛滴虫的形态。
1.2.6鸽毛滴虫生长曲线测定
本次试验接种的样本为传代至第四代,且生长了48h的鸽毛滴虫。用同一管的样本接种了三管肝浸汤培养基用于计数。待接种后,每隔12h计数一次,直至虫体全部死亡。并根据计数数据绘制鸽毛滴虫的生长曲线。
1.2.7药物作用下鸽毛滴虫形态学变化观察
以鸽毛滴虫在体外培养基中的生长曲线为依据,该试验将纯化培养至第四代且生长至48h的虫体应用于药敏试验,因为生长至48~60h的鸽毛滴虫增殖快且活性最强,因此可以确保用药后鸽毛滴虫的生长稳定。该药敏试验以48h作为体外药敏试验的周期,以此避免由于时间过长鸽毛滴虫正常死亡造成试验误差。
2 结果与分析
2.1鸽毛滴虫活体形态学观察结果
鸽毛滴虫活虫体呈椭圆形、圆形、或梨形,有折光性。光镜下的活虫体有的向左有或向前运动、有的呈旋转运动或布朗运动[4],虫体运动迅速,活性非常强。见图1。
2.2鸽毛滴虫染色后的形态观察结果
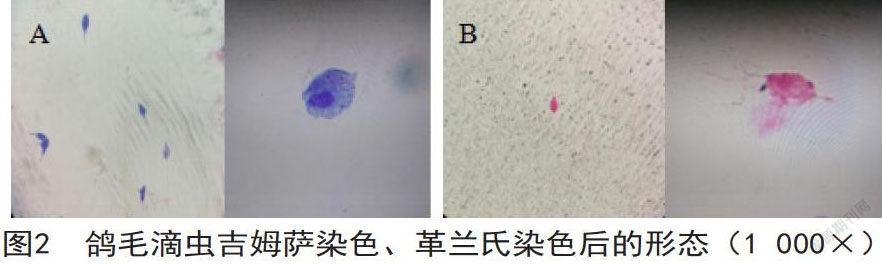
在1000倍油镜下,经瑞氏-吉姆萨染色后的虫体呈椭圆形或不规则形。虫体原生质被染成淡蓝色。细胞核呈椭圆形,且被染成红色,并位于虫体前端[4]。鞭毛呈暗红色或黑色,暗视野下能清晰观察到4根前鞭毛。轴柱颜色浅于原生质,且稍突出于虫体后缘。一侧可清晰观察到波动膜外边缘的轮廓,颜色比原生质稍浅(如图2A)。经革兰氏染色后的虫体呈椭圆形或不规则形。虫体原生质呈淡红色,细胞核的颜色比原生质深。能观察到呈黑色的4根鞭毛和波动膜邊缘轮廓。轴柱突出于虫体后缘,呈淡红色(如图2B)。
2.3不同生长期鸽毛滴虫的形态观察结果
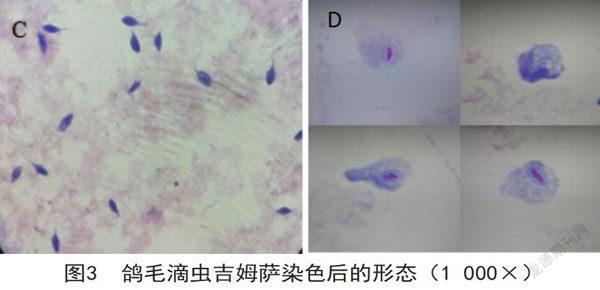
鸽毛滴虫生长到60h进行吉姆萨染色后,着色明显,暗视野下能观察到鞭毛。轴柱突出于虫体外,着色较原生质淡。虫体细胞核着色较原生质深,虫体轮廓清晰(图3C)。极少数鸽毛滴虫生长了120h后死亡,大多数鸽毛滴虫在生长衰亡期死亡,少数在生长迟缓期、生长对数期及生长稳定期死亡。取接种鸽毛滴虫样本120h后的培养基,经吉姆萨染色后,细胞核着色明显,多数虫体的鞭毛脱落,虫体胞膜破裂,形成空洞,原生质溢出,空洞扩大后,虫体裂解形成碎片。死亡裂解后的鸽毛滴虫着色较活的鸽毛滴虫淡(图3D)。
2.4鸽毛滴虫扫描电子显微镜的形态观察结果
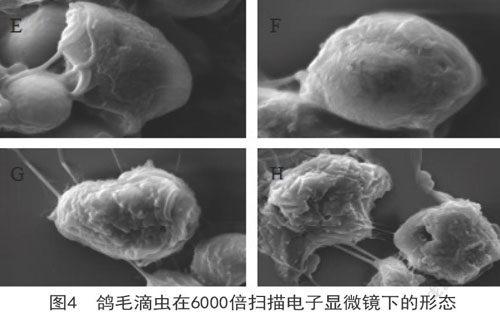
鸽毛滴虫呈卵圆形或球形。如图4E所示,在扫描电子显微镜下,60h前活力较强,鸽毛滴虫表面较为光滑,上面分布少许褶皱,可清晰的观察到四条前鞭毛,这些鞭毛起源于虫体前端毛基体的游离鞭毛。发育发达的波动膜起始于虫体的前端,波动膜几乎可以延伸到身体的整个长度。一根轴柱延伸出虫体的后缘。后虫体开始衰老,虫体开始皱缩,表面粗糙(如图4F所示)。继而,鸽毛滴虫表面皱缩加深,空洞变大,如图4G所示,虫体轮廓及鞭毛不清晰。在接近120h时,虫体崩解(如图4H所示)。
2.5鸽毛滴虫生长曲线测定结果
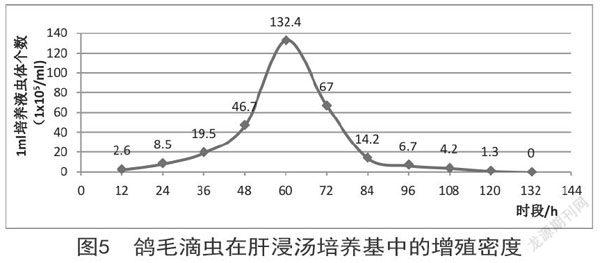
对鸽毛滴虫在肝浸汤培养基中的生长情况进行测定,结果如图5所示:虫体在肝浸汤培养基中生长良好,在接种了虫体12h内鸽毛滴虫增殖不太明显;12~48h鸽毛滴虫增殖明显,虫体数量缓慢增加;48~60h鸽毛滴虫数量呈直线上升,虫体呈对数增长;虫体在60h左右,虫体密度及活性最强;接种鸽毛滴虫60h后,鸽毛滴虫数量达最高峰,后则迅速下降;在接种后的第3天,鸽毛滴虫平均数为97.07×10 5个/mL,虫体数量最多;至84h时,显微镜视野下可见大量死亡虫体;84h后虫体缓慢死亡,直至120h,虫体全部死亡。鸽毛滴虫生长曲线见图5。
3 讨论
鸽毛滴虫在外界环境中抵抗力低,鸽毛滴虫对体外培养基有特殊的营养要求,需加血清才能生长及适量的两性霉素才能存活。进行鸽毛滴虫体外接种培养时,应在无菌条件下完成操作,避免细菌污染培养基,保证鸽毛滴虫的纯化培养。此次试验还应用小牛血清培养鸽毛滴虫,但是,培养了48h后取培养液进行显微镜观察,发现此次用小牛血清培养的鸽毛滴虫数量较少。所以试验用的鸽毛滴虫皆使用鸽子血清进行培养。用鸽子血清培养的毛滴虫数量增加迅速,视野内虫体运动迅速,活性非常强。从鸽毛滴虫的生长曲线表明,用肝浸汤培养的鸽毛滴虫接种后60h增殖达到高峰的活虫体数比张静静等人报道的HF培养基中的鸽毛滴虫的数量多。但是,肝浸汤培养容易产生肝杂质,在后期不利于虫体的观察和计数[10]。
此次试验用光学显微镜和扫描电子显微镜分别观察了鸽毛滴虫的形态,在100倍光学显微镜下能观察到有折光性、圆形或椭圆形,且快速游动的鸽毛滴虫。在1000倍油镜下,通过吉姆萨染色后能观察到鸽毛滴虫呈椭圆形或不规则形。虫体原生质被染成淡蓝色,椭圆形的细胞核呈红色,暗视野下能清晰的观察到4根不等的前鞭毛。在扫描电子显微镜下,正常的鸽毛滴虫呈梨形或球形。鸽毛滴虫表面出现褶皱或折痕。虫体饱满,各个外表面结构轮廓清晰,并可清晰观察到4条前鞭毛。发育发达的波动膜几乎可以延伸到虫体的整个长度。
4 结论
试验观察到鸽毛滴虫在肝浸汤培养基中生长繁殖过程,从接种到60h生长良好,可达生长高峰,虫体饱满,运动迅速,表面光滑,后呈下降趋势,虫体数量减少,死亡增多,虫体呈萎缩、出现空洞,崩解,并在120h达到死亡底限。本试验结果建立了可靠的鸽毛滴虫培养方法,弄清了鸽毛滴虫的生长规律,为检测、分离鉴定以及筛选抗鸽毛滴虫药物提供了基础。
参考文献
[1]佘柏荣,冯建雄,林日兰,等.鸽毛滴虫感染[J].中国兽医杂志,1984(6):36-37.
[2]罗锋,陈泽华,苏遂琴,等.鸽毛滴虫病的研究进展[J].中国兽医寄生虫病,2007(3):51-54.
[3]张文成,丁鹏.鸽毛滴虫病的防治[J].中国畜牧兽医文摘,2013,29(11):163.
[4]杨秀环,白如念,李志衍,等.鸽毛滴虫形态学观察研究[J].当代畜牧,2012(2):30-31.
[5]郭旭明.鸽毛滴虫病[J].畜牧兽医科技信息,2008(9):82.
[6]陈宗椿,陈应江,陈仁桃,等.肉鸽毛滴虫感染[J].畜牧与兽医,1996(2):92.
[7]张红玲.鸽毛滴虫病的诊治与治疗[J].畜禽业,2017,28(11):33-34.
[8]王宏伟.鸽毛滴虫病的诊治分析[J].畜牧兽医杂志,2005(2):48.
[9]步卫东,潘裕华.毛滴虫在鸽肝组织原代外植块培养液中的生长研究[J].中国家禽,2013,35(7):16-19.
[10]孙静静.体外抗鸽源禽毛滴虫中药的筛选及其作用机理研究[D].泰安:山东农业大学,2015.
基金项目:江苏省大学生创新训练,省重点项目(201813573013Z)
作者简介:陆雨楠(1997-),女,江苏省南通人,硕士研究生,主要从事兽医学研究。
通信作者:戴鼎震(1964-),男,江苏兴化人,博士,教授,主要从事预防兽医学及中兽医的研究。
