凤眼莲净化藻华养殖尾水过程中的潜在病原菌风险
2019-09-10周庆王岩宋伟陈婷韩士群
周庆 王岩 宋伟 陈婷 韩士群


摘要:通过高通量测序的方法,研究了漂浮植物在净化藻华养殖废水过程中对潜在病原菌和致病相关基因的影响。结果表明,漂浮植物凤眼莲能够显著降低藻华养殖废水中潜在病原菌的总体水平,但是其中的弓形菌属、螺杆菌属、肠杆菌属细菌水平在凤眼莲处理的12~18d内出现短暂增长,而密螺旋体属和假单胞菌属细菌水平在凤眼莲处理的30d时分别攀升至同期藻华养殖废水对照的(6.2+3.5)倍和(44.6+20.9)倍。漂浮植物凤眼莲处理后,藻华养殖废水中与人类代谢、传染和免疫疾病相关的基因水平逐渐低于对照,但是与人类神经疾病相关的基因水平与同期对照相比却提升了36.77%+6.91%。可见,仅靠漂浮植物净化处理不能完全消除养殖废水排放病原菌的风险。
关键词:养殖废水;藻华;漂浮湿地;凤眼莲;潜在病原菌
中图分类号:X592
文献标识码:A
文章编号:1000-4440(2019)02-0340-06
随着中国养殖业规模化、高密度化的发展,养殖废水的排放量每年近3x108 m3[1]养殖废水中大量未被鱼类食用的饲料和鱼类排出的粪便,使水质富营养化问题日趋严重,促进养殖废水的净化处理受到越来越多的关注。为了满足高效、经济的要求,水生植物对养殖废水的强化净化成为养殖废水净化处理的重要措施之一。许多研究者发现,空心菜、金鱼藻、凤眼莲、水花生、水蕹菜、苦草、伊乐藻和轮叶黑藻等具有较好的净化养殖废水的能力[25]。其中,以凤眼莲为代表的漂浮植物因其超强的氮、磷等营养物去除能力被较为广泛地应用到漂浮湿地的构建上川。但是,已有的研究多侧重在水生植物对养殖废水的氮、磷和化学需氧量的削减效果和对富营养化水体细菌多样性的影响上。养殖废水经漂浮湿地水生植物净化后的潜在病原菌特征以及致病相关基因方面的状况却鲜有报道。此外,养殖废水中藻类容易大量繁殖,其中蓝藻密度占绝对优势,可以达到浮游藻类总密度的80%[12]。蓝藻又名蓝细菌,属于细菌界,具有产毒素能力的蓝细菌对水环境和人畜构成了极大的致病危害,因此,潜在的产毒蓝细菌特征成为水体潜在病原菌研究中不可缺少的一部分。随着分子生物学技术的快速发展,高通量测序技术在河流、湖泊和水库等水体细菌群落结构的研究中已得到广泛应用[13-5。本研究主要以凤眼莲构建的漂浮湿地为研究对象,通过高通量测序的方法,分析凤眼莲在净化藻华养殖废水过程中水体潜在病原菌的变化,以及致病基因方面的差异,以期为养殖废水的处理提供理论依据。
1 材料与方法
1.1 试验材料
养殖废水取自江苏省农业科学院养殖池。养殖池24m3,养殖鲤鱼40kg,每天喂饲量1kg,每隔7d换水1次,已养殖42d。排放废水的总氮、总磷质量浓度分别为(13.83+0.42)mg/L和(5.89+0.54)mg/L,藻细胞密度为1L(5.42+0.86)x107个。
凤眼莲[Eichhornia crassipes(Mart)Solms]取自江苏省农业科学院凤眼莲保种池,正值7月凤眼莲分蘖繁殖和生长的旺盛阶段,经去除残体,自来水冲洗,0.01%高锰酸钾浸泡,去离子水充分冲洗后,选取大小基本一致,株高平均为42cm的健康植株,在滤纸过滤后的养殖废水中预培养7d,再用于试验。培养条件:温度28℃,相对湿度75%,光照度40μumol/(m2·s),光照周期12h:12h。
1.2试验方法
试验在12L平底敞口玻璃器皿中进行,按16kg/m3的投放密度,在10L养殖废水中加入初始鲜质量约160g的凤眼莲行净化处理,以不加凤眼莲作为对照,设置3个重复,培养条件同方法1.1。试验周期为30d,每6d采集水样,用0.22 μum孔径无菌滤膜过滤,将过滤后的滤膜放入-80℃冰箱暂存,用于后续DNA提取和高通量测序。
1.3 DNA提取与高通量测序
采用PowerWater© SterivexTM DNA Isolation Kit(美國MOBIO公司产品)提取基因组DNA,用分光光度计测定DNA浓度,用1%琼脂糖凝胶电泳检测提取的DNA。将合格的DNA样品送至上海派森诺生物科技有限公司,对16S rRNA基因的V3-V4高变区片段进行PCR扩增和Illumina MiSeq平台测序。PCR扩增的引物序列为338F(5'-ACTC-CTACGGGAGGCAGCA-3')和806R(5'-GGAC-TACHVGGGTWTCTAAT-3')。扩增条件:95℃预变性3min;95℃变性15s,55℃退火30s,72℃延伸30s,共27个循环;最终72℃延伸5min。DNA测序文库采用TruSeq© Nano DNA LT Sample Prep Kit(美国Illumina公司产品)构建,应用MiSeq ReagentKit V3(600 cycles)进行2x300 bp的双端测序。
1.4 统计分析
采用Qiime软件平台对优质序列按序列相似度0.97进行聚类,一个单元就是一个OTU。通过数据库比对获得每个OTU代表序列的分类学信息[16]。根据OTU的分类学信息,综合文献[17]~[19]归纳的信息统计潜在病原菌。基于宏基因组物种丰度信息以及物种的基因组数据库信息,利用软件PICRUSt以及Greengenes和KEGG数据库进行功能基因的预测和相关统计分析[20]。
2 结果与分析
2.1 漂浮植物凤眼莲对藻华养殖废水潜在病原菌的影响
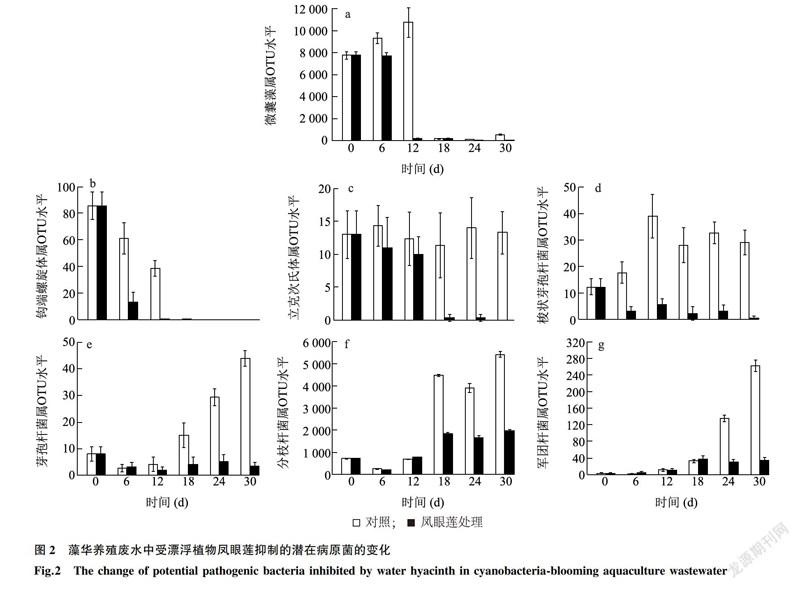
潜在病原菌的统计结果显示,藻华养殖废水中共有12个潜在病原菌属,分别隶属于微囊藻属(Mi-crocystis)、分枝杆菌属(Mycobacterium)、芽孢杆菌属(Bacillus)、梭状芽孢杆菌属(Clostridium)、立克次氏体属(Rickettsia)、弓形菌属(Arcobacter)、螺杆菌属(Helicobacter)、肠杆菌属(Enterobacter)、军团杆菌属(Legionella)、假单胞菌属(Pseudomonas)、密螺旋体属(Treponema)、钩端螺旋体属(Leptospira)。其中,相对丰度最高的属为微囊藻属,占潜在病原菌总量的90.03%+0.47%;其次为分枝杆菌属,占8.30%士0.37%。与对照相比,净化处理12d时,凤眼莲处微囊藻属细菌是养殖废水中水华蓝藻中的优势细菌,也是释放具有致肝癌作用的微囊藻毒素的潜在细菌。在漂浮植物凤眼莲影响下,养殖废水中微囊藻属病原菌水平加速减少并维持在较低水平,微囊藻属病原菌衰亡后的再次复兴也得到了有效抑制(图2a)。水体钩端螺旋体属和立克次氏体属病原菌受漂浮植物凤眼莲影响后加速消亡(图2b、图2c)。芽孢杆菌属、梭状芽孢杆菌属、军团杆菌属和分枝杆菌属病原菌的生长受到了漂浮植物凤眼莲的抑制,30d时凤眼莲处理的病原菌水平显著低于对照(图2d~图2g),但是其中的军团杆菌属和分枝杆菌属病原菌的水平经过凤眼莲处理后,还是比初始水平显著提升了。
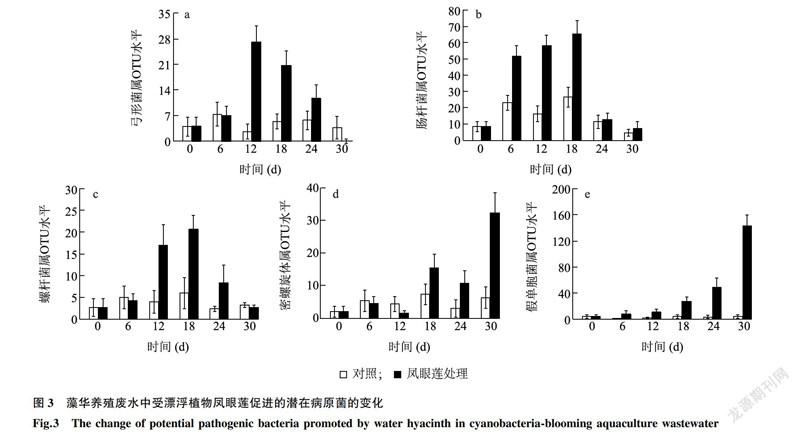
还有一些潜在病原菌的生长在一定程度上反而受到了凤眼莲的促进。如图3所示,弓形菌属、肠杆菌属和螺杆菌属病原菌的水平在凤眼莲处理12~18d时均显著高于对照,但30d后又与对照一样恢复至初始水平。而密螺旋体属和假单胞菌属病原菌的水平,则在凤眼莲处理18d时显著高于对照,并在30d时分别攀升至同期对照的(6.2+3.5)倍和(44.6+20.9)倍。
2.2 漂浮植物凤眼莲对藻华养殖废水细菌群落中与人类疾病相关基因的影响
细菌群落功能基因的预测结果显示,藻华养殖废水中细菌有许多基因与人类代谢疾病、传染疾病、免疫疾病和神经疾病关联。漂浮植物凤眼莲处理藻华养殖废水过程中,处理6d时水体细菌群落中与人类代谢疾病相关的基因水平显著低于对照,处理6~24d时水体中与人类传染疾病相关的基因水平显著低于对照,处理18d以后水体细菌群落中与人类免疫疾病相关的基因水平也显著低于对照,但是处理24d后水体中与人类神经疾病相关的基因水平却显著高于对照(图4)。
3 讨论
中国水产养殖业经过多年的发展,已经成为举足轻重的产业,并在全世界的养殖业中占有巨大的份额。但是,目前中国的养殖废水多伴有蓝藻水华,且养殖废水排放的标准主要由氮、磷等这类基本理化指标组成。水产养殖废水经处理以后,虽然一部分被养殖循环利用,但大部分最终要排放进入自然水体。漂浮植物凤眼莲去除水体中营养盐的能力已经得到公认”,但是理化指标达标排放的养殖水体存在的对人类有害的病原菌风险值得探究。
Blumenthal等[21]和Stewart等[22]研究发现,在炎热的天气下,用传统的大肠杆菌或大肠菌群指标来指示病原菌的存在和水平是不充分的。凤眼莲等水生植物存在能够促进自身生长的肠杆菌属内生菌[23],容易干扰传统的指示病原菌存在和水平的大肠杆菌或大肠菌群方法。此外,许多病原菌可以进入活的非可培养状态(VBNC)[24),传统的培养法低估了这部分病原菌,但是它们依然具有感染的特性[25]。随着分子生物学技术的发展,通过高通量测序获得的大量序列信息,将更全面地反映病原菌的变化[26]。
本研究通过16SrRNA基因高变区的高通量测序分析发现,漂浮植物凤眼莲能够显著降低藻华养殖废水中潜在病原菌的总体水平,但是对于不同的潜在病原菌的影响有差异,原因可能是凤眼莲的根系及其分泌物为部分微生物提供了适宜的栖息地和避难所[27]。弓形菌属、螺杆菌属、肠杆菌属、密螺体属和假单胞菌属细菌虽然在凤眼莲处理的不同阶段出现交替增长,但可能由于他们的相对丰度以及相关疾病基因的拷贝数较小,并没有引起水体细菌群落中与人类代谢、免疫、传染疾病相关的基因水平的提升。然而,水体细菌群落中与人类神经疾病相关的基因水平受凤眼莲影响却显著提升了,凤眼莲处理30d时与同期对照相比提升了36.77%+6.91%,这一提升的风险还有待深入研究。
假单胞菌属细菌是水生态环境中普遍存在的具有生物修复功能的微生物[28],但许多假单胞菌却是病原菌[29]。应用漂浮植物净化藻华养殖尾水过程中,假单胞菌属细菌水平的提升有利于植物与微生物对水环境的协同修复,有利于水体营养物质的去除,但是水生植物并没有选择病原菌与非病原菌的能力。
因此,虽然漂浮植物凤眼莲能有效降低藻華养殖废水中潜在病原菌的总体水平,但仅用这一个步骤,可能还不能完全消除病原菌的风险,进一步配合使用臭氧[30]、纳米抗菌材料[31]或者生物沙滤[32]的方法可能有助于将这一风险降到最低。本研究通过室内静态模拟试验初步探讨了漂浮植物凤眼莲处理藻华养殖废水对人类健康的潜在风险,但是室内静态模拟试验存在一定的局限性,没有涉及流动水体以及底泥微生态的影响,与漂浮湿地原位环境相比具有一定的差异性,因此后续还需要在漂浮湿地原位进行更深入的生态安全性评估,为漂浮植物湿地单元的构建与综合布署提供更全面的依据。
参考文献:
[1]益清.我国水产养殖每年排放近三亿立方米废水[J].现代物业(.上旬刊),2014(z1):93.
[2]董文斌,何铁光,蒙炎成,等.狐尾藻对养殖废水的减控去污效果[J].南方农业学报,2017,48(7):1204-1210.
[3]窦寅.两种水生植物在克氏原螯虾养殖中的应用研究[D].南京:南京大学,2011:16-38.
[4]唐红琴,董文斌,李忠义,等.稻草~狐尾藻治理养殖废水效应研究[J].江苏农业科学,2018,46(19):302-305.
[5]张迪,凌去非,刘炜,等.水葫芦和金鱼藻对黄颡鱼养殖水,体净化效果研究[J].扬州大学学报,2012,33(4):66-71.
[6]刘国锋,何俊,华伯仙,等.控养速生植物治理污染水体的研究进展[J].江苏农业科学,2017,45(21):1-6.
[7]黄子贤.沉水植物对陆域水产养殖污染削减效应研究[D].上海:.上海海洋大学,2011.
[8]闻学政,宋伟,张迎颖,等.凤眼莲深度净化污水处理厂尾水的效果[J].江苏农业学报,2018,34(5):1072-1080.
[9]龚龙,韩士群,周庆.水生植物对螃蟹养殖水体原位修复及其强化净化效果[J].江苏农业学报,2015,31(2):342-349.
[10]李阳,成家杨,钟钰,等.浮萍多样性对富营养化水体净化效果的影响[J].南方农业学报,2017,48(2):259-265.
[11]MALIK A. Environmental challenge vis a vis opportunity :The case of water hyacinth[J]. Environment International,2007,33(1):122- 138.
[12]王璐,李冰,孫盛明,等.复合养殖系统中浮游植物群落结构及其与水环境因子的关系[J].水生态学杂志,2015,36(5):81-88.
[13]DE-OLIVEIRA L F,MARGIS R. The source of the river as a nursery for microbial diversity[J]. PLoS ONE,2015,10(3):e120608.
[14]SUN Z,LIG,WANG C,et al. Community dynamics of prokaryotic and eukaryotic microbes in an estuary reservoir[J]. Scientific Reports,2014,4:6966.
[15]WILHELMS W,FARNSLEY S E,LECLEIR G R,et al. The relationships between nutrients,cyanobacterial toxins and the micro-bial community in Taihu (Lake Tai),China[J]. Harmful Alage,2011,10(2):207-215.
[16]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al. QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[17]BIBBY K,VIAU E,PECCIA J. Pyrosequencing of the 16S rRNA gene to reveal bacterial pathogen diversity in biosolids[J]. WaterResearch,2010,44 (14):4252-4260.
[18]YE L,ZHANG T. Pathogenie bacteria in sewage treatment plants as revealed by 454 pyrosequencing[J]. Environmental Science &Technology,2011,45(17):7173-7179.
[19]CHORUS I,BARTRAM J. Toxic cyanobacteria in water:a guide to their public health consequences,monitoring and management[M]. London:E&FN Spon,1999 :55-64.
[20]LANGILLE M G I,ZANEVELD J,CAPORASO J G,et al. Predictive functional profiling of microbial communities using 16SrRNA marker gene sequences[J]. Nature Biotechnology,2013,31(9):814-821.
[21]BLUMENTHALU J,MARA D D,PEASEY A,et al. Guidelines for the microbiological quality of treated wastewater used in agricul-ture:Recommendations for revising W HO guidelines[J]. Bulletinof the World Health Organization,2000,78 (9):1104-1116.
[22]STEWARTJR,GAST R J,FUJIOKA RS,et al. The coastal environment and human health:microbial indicators,pathogens ,sentinels and reservoirs[J]. Environmental Health,2008 ,7(Suppl 2):3.
[23]EL-DEEB B,GHERBAWY Y,HASSAN S. Molcular charaterization of endophytic bacteria from metal hyperaccumulator aquaticplant (Eichhornia crassipes)and its role in heavy metal removal[J]. Geomicrobiology Journal,2012,29(10):906-915.
[24]OLIVER J D. Recent findings on the viable but nonculturable state in pathogenic bacteria[J]. FEMS Microbiology Reviews,2010,34(4):415-425.
[25]WINGENDER J,FLEMMING H C. Biofilms in drinking water and their role as reservoir for pathogens[J]. International Journal ofHygiene and Environmental Health,2011,214(6):417-423.[26]侯丽媛,胡安谊,马英,等.九龙江流域潜在病原菌污染分析[J].环境科学,2014,35(5):1742-1748.
[27]RAMIREZ E,ROBLES E,MARTINCZ B. Free-living amoebae I solated from water-hyacinth root (Eichhornia crassipes)[J]. Ex-perimental Parasitology,2010,126(1):42-44.
[28]Y0NG Y C,WUX Y,SUN JZ,et al. Engineering quorum sensing signaling of Pseudomonas for enhanced wastewater treatmentand electricity harvest:a review[J]. Chemosphere,2015,140:18-25.
[29]陈丽萍,侯付景,张迪骏,等.宁波沿海陆源排污口假单胞菌属(Pseudomonas)分布特点[J].海洋与湖沼,2013,44(4):926-930.
[30]ORTA DE VELASQUEZ M T,ROJAS-VALENCIA M N,AYALA A. Wastewater disinfection using ozone to remove free-living,high-ly pathogenie bacteria and amoebae[J]. Ozone Science & Engineering,2008,30(5):367-375.
[31]SOTIRIOU G A,PRATSINIS S E. Antibacterial activity of nanosilver ions and particles[J]. Environmental Science & Technology,2010,44(14):5649 5654.
[32]BOMO A M,HUSBY A,STEIK T K. Removal of fish pathogenie bacteria in biological sand filters[J]. Water Research,2003,37(11):2618-2626.
