CYP3A5 6986A>G基因多态性与中国肾移植术后患者环孢素A血药浓度相关性的Meta分析
2019-09-10彭颖张峻柳汝明王茜黄桦王晶晶姚勤李骞
彭颖 张峻 柳汝明 王茜 黄桦 王晶晶 姚勤 李骞

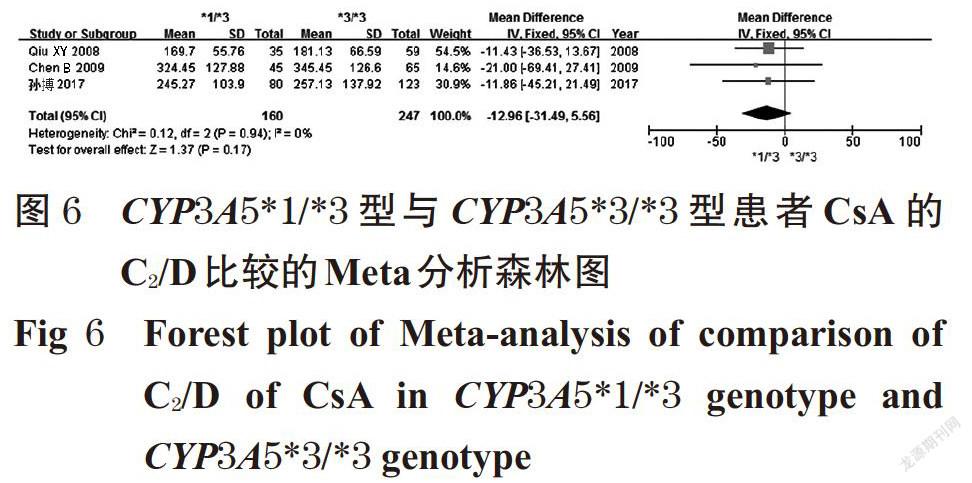
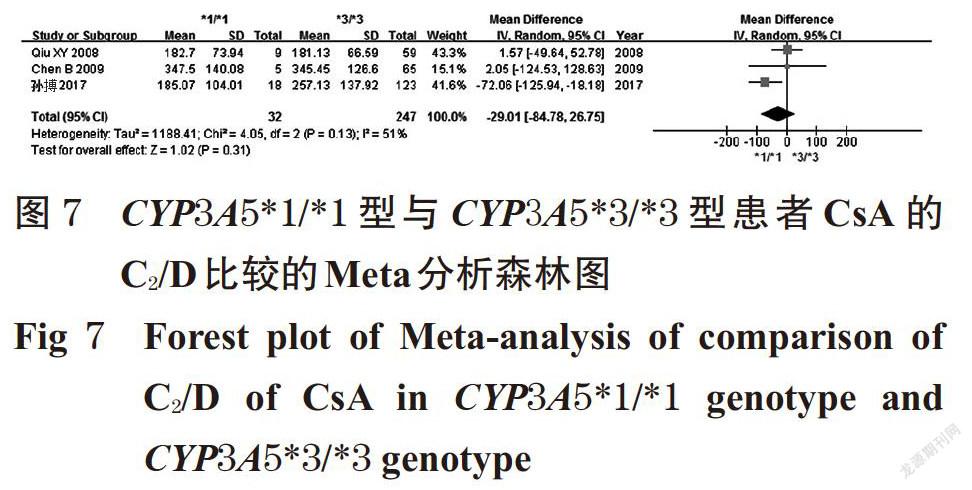




中圖分类号 R394.6;R979.5 文献标志码 A 文章编号 1001-0408(2019)20-2855-07
DOI 10.6039/j.issn.1001-0408.2019.20.23
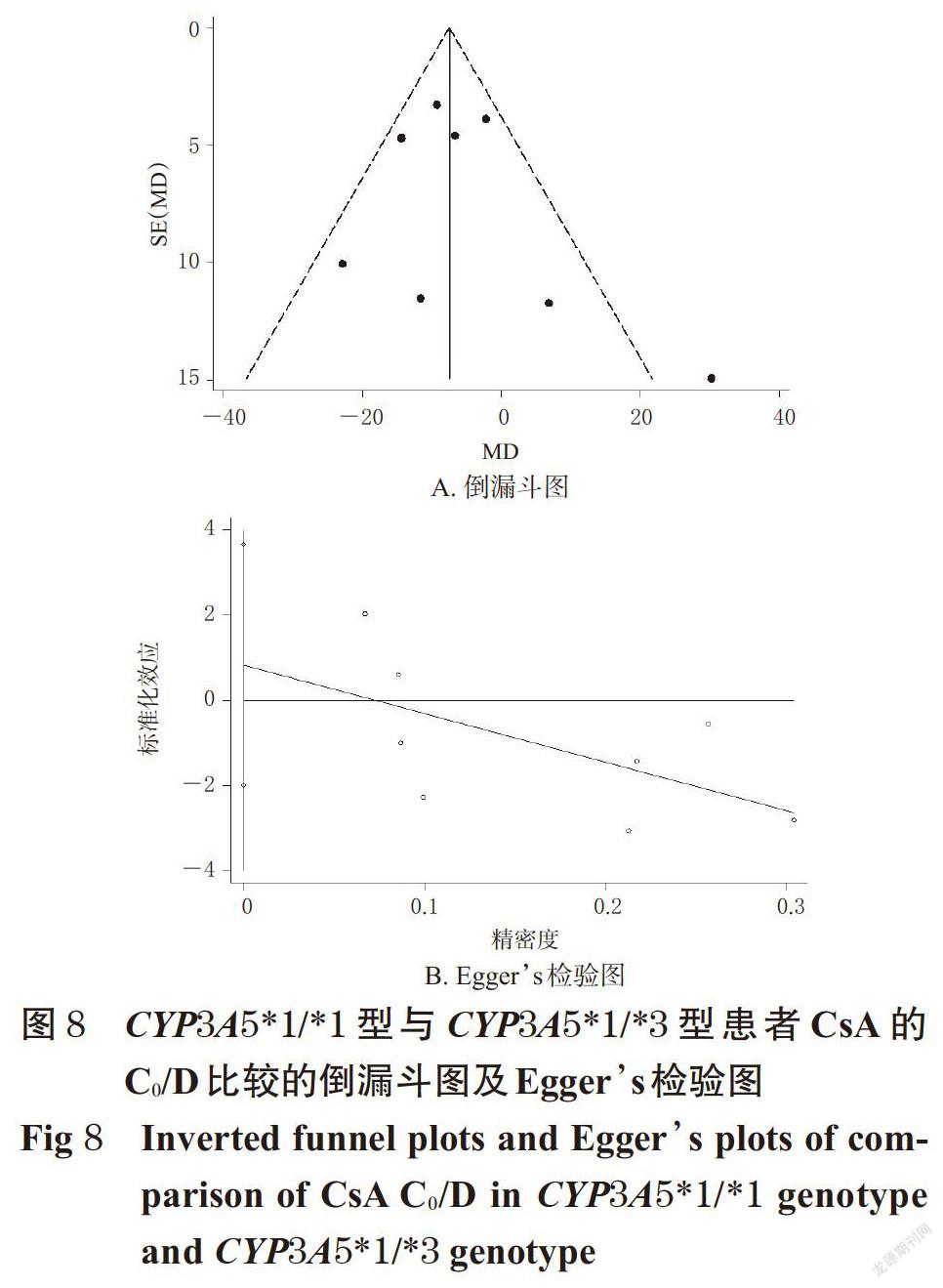
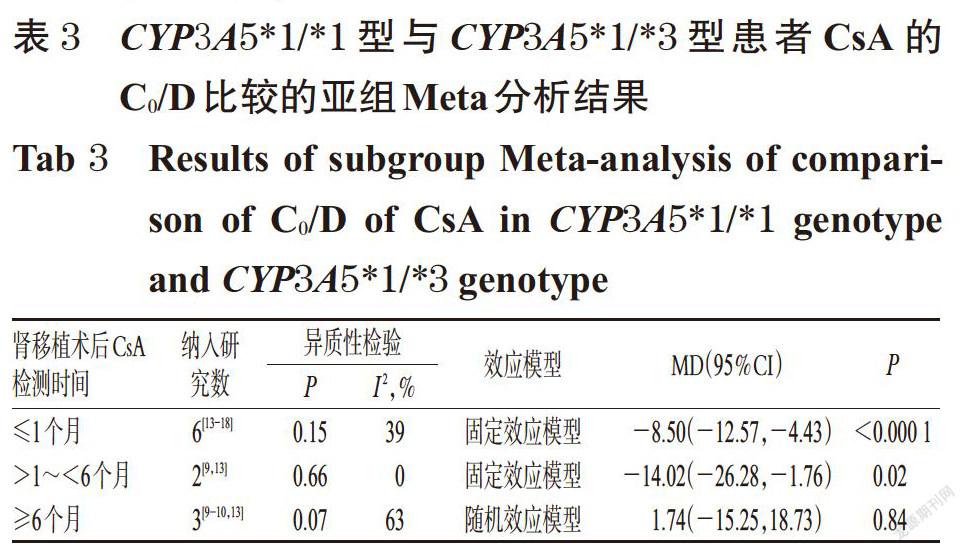
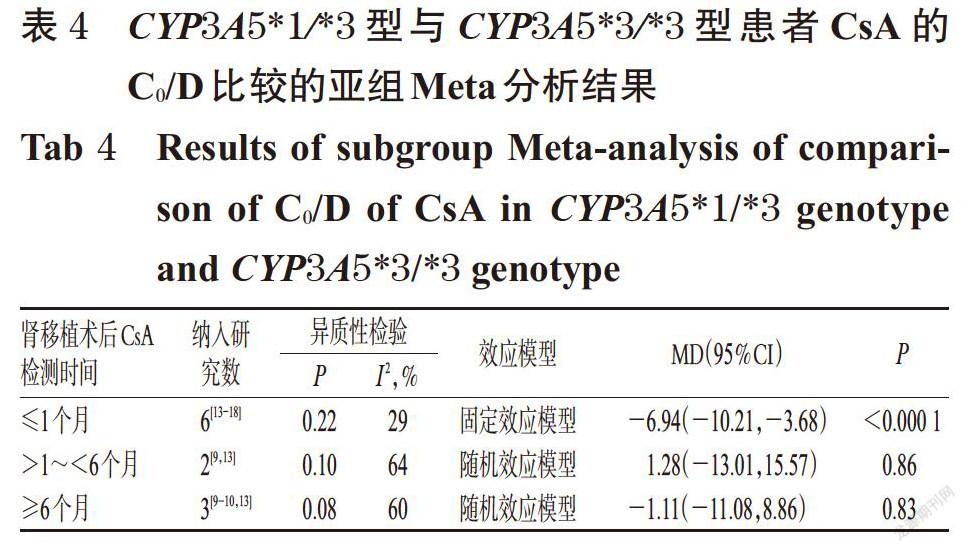
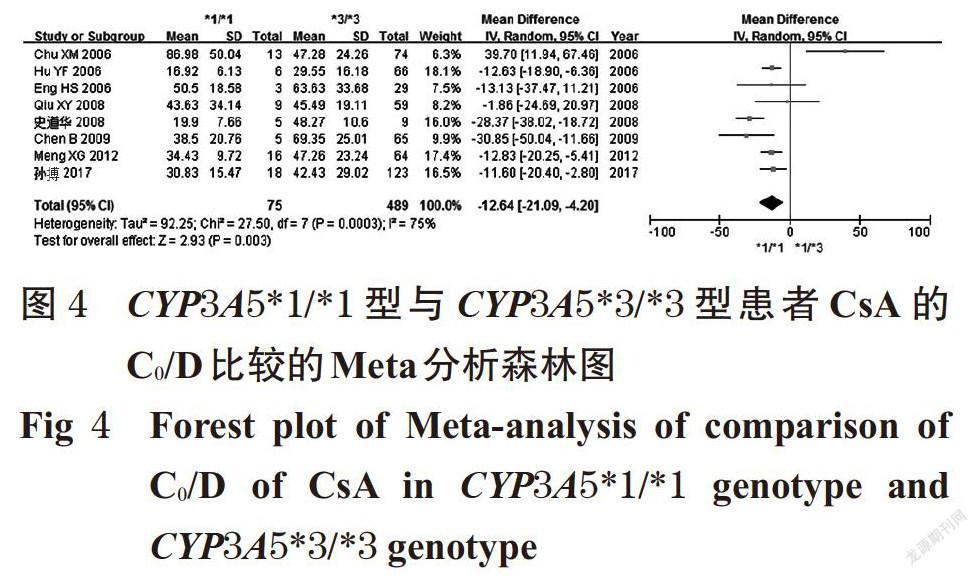
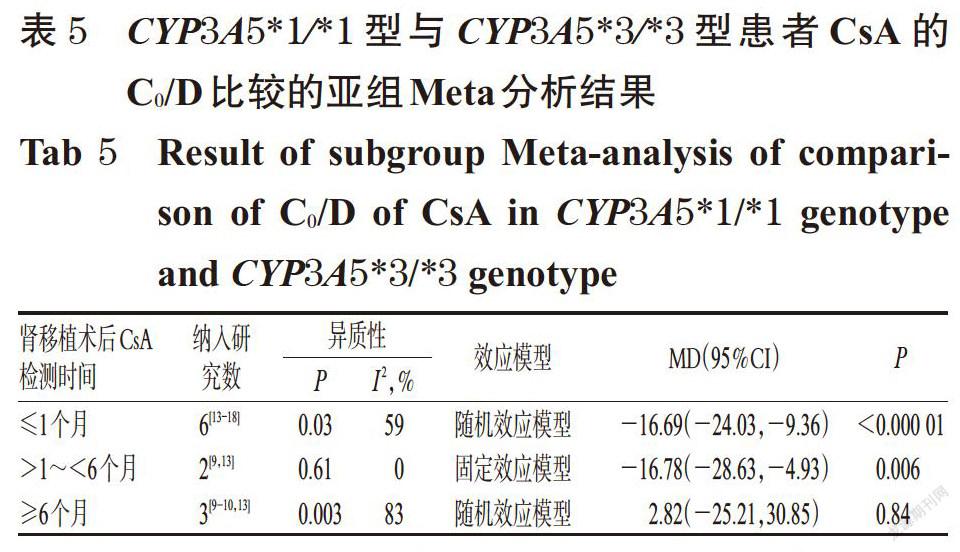
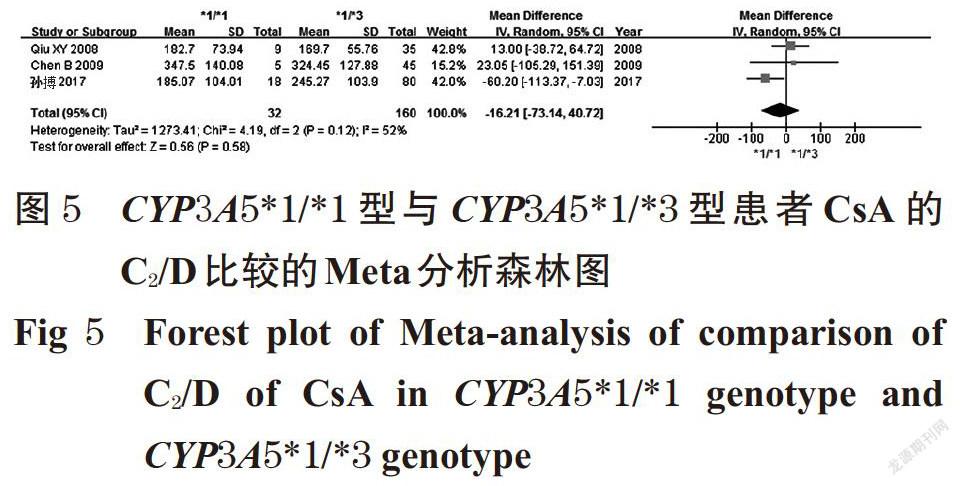
摘 要 目的:系统评价CYP3A5 6986A>G基因多态性与中国肾移植术后患者环孢素A(CsA)血药浓度的相关性。方法:计算机检索Cochrane图书馆、PubMed、Embase、中国生物医学文献数据库、中国期刊全文数据库、维普数据库、万方数据库等,收集肾移植术后使用CsA免疫抑制治疗并进行血药浓度监测的中国患者的病例对照研究或队列研究。筛选文献、提取资料后,采用纽卡斯渥太华量表评分对纳入文献质量进行评价,采用Rev Man 5.3软件进行Meta分析。结果:共纳入8篇文献,均为队列研究,共计890例患者。Meta分析结果显示,CYP3A5*1/*1型患者CsA剂量校正后的谷浓度(C0/D)显著低于CYP3A5*1/*3型[MD=-6.97,95%CI(-13.18,-0.76),P=0.03];亚组分析结果显示,肾移植术后CsA检测时间≤1个月时[MD=-8.50,95%CI(-12.57,-4.43),P<0.000 1]、检测时间>1~<6个月时[MD=-14.02,95%CI(-26.28,-1.76),P=0.02]CYP3A5*1/*1型患者CsA的C0/D均显著低于CYP3A5*1/*3型患者。CYP3A5*1/*3型患者CsA的C0/D显著低于CYP3A5*3/*3型患者[MD=-6.04,95%CI(-8.99,-3.09),P<0.000 1];亚组分析结果显示,肾移植术后CsA检测时间≤1个月时CYP3A5*1/*3型患者CsA的C0/D显著低于CYP3A5*3/*3型[MD=-6.94,95%CI(-10.21,-3.68),P<0.000 1]。CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*3/*3型[MD=-12.64,95%CI(-21.09,-4.20),P=0.003];亚组分析结果显示,肾移植术后CsA检测时间≤1个月时[MD=-16.69,95%CI(-24.03, -9.36),P<0.000 01]、检测时间>1~<6个月时[MD=-16.78,95%CI(-28.63,-4.93),P=0.006]CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*3/*3型。CYP3A5*1/*1型与CYP3A5*1/*3型、CYP3A5*1/*3型与CYP3A5*3/*3型、CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA剂量校正后的峰浓度比较,差异均无统计学意义。结论:CYP3A5 6986A>G基因多态性与中国肾移植术后患者CsA的C0/D具有一定的相关性,且在肾移植术后CsA检测时间≤1个月时的大小顺序为CYP3A5*1/*1型 关键词 CYP3A5 6986A>G;基因多态性;环孢素A;肾移植术;血药浓度;相关性;Meta分析 ABSTRACT OBJECTIVE: To systematically evaluate the correlation between CYP3A5 6986A>G gene polymorphism and blood concentration of Cyclosporine A (CsA) in Chinese renal transplant recipients. METHODS: Retrieved from Cochrane Library, PubMed, Embase, CBM, CNKI, VIP and Wanfang database, case-control or cohort studies about Chinese patients receiving CsA immunosuppressive therapy and blood concentration monitoring after kidney transplantation were collected. After literature screening and data extracting, the quality of literature was evaluated with Newcastle Ottawa scale, and Meta-analysis was performed by using Rev Man 5.3 software. RESULTS: Eight literatures with a total of 890 patients were involved in cohort study. Meta-analysis showed that the trough concentration after dosage correction (C0/D) of CsA in CYP3A5*1/*1 genotype was significantly lower than CYP3A5*1/*3 genotype[MD=-6.97,95%CI (-13.18,-0.76),P=0.03]. The subgroup analysis showed that the C0/D of CsA in CYP3A5*1/*1 genotype was significantly lower than CYP3A5*1/*3 genotype when test time≤1 month after renal transplant [MD=-8.50,95%CI(-12.57,-4.43),P<0.000 1] and >1-<6 months after renal transplant [MD=-14.02,95%CI(-26.28, -1.76),P=0.02]. C0/D of CsA in CYP3A5*1/*3 genotype was significantly lower than CYP3A5*3/*3 genotype [MD=-6.04,95%CI(-8.99,-3.09),P<0.000 1]. The subgroup analysis showed that C0/D of CsA in CYP3A5*1/*3 genotype was significantly lower than CYP3A5*3/*3 genotype when test time ≤1 month after renal transplant [MD=-6.94,95%CI(-10.21, -3.68),P<0.000 1]. C0/D of CsA in CYP3A5*1/*1 genotype was significantly lower than CYP3A5*3/*3 genotype [MD=-12.64,95%CI(-21.09,-4.20),P=0.003]. The subgroup analysis showed that C0/D of CsA in CYP3A5*1/*1 genotype was significantly lower than CYP3A5*3/*3 genotype when test time ≤1 month after renal transplant [MD=-16.69,95%CI(-24.03,-9.36),P<0.000 01] and >1-<6 months after renal transplant [MD=-16.78,95%CI(-28.63,-4.93),P=0.006]. There was no statistical significance in CsA of peak concentration after dose correction between CYP3A5*1/*1 genotype and CYP3A5*1/*3 genotype, CYP3A5*1/*3 genotype and CYP3A5*3/*3 genotype, CYP3A5*1/*1 genotype and CYP3A5*3/*3 genotype. CONCLUSIONS: CYP3A5 6986A>G gene polymorphism is associated with C0/D of CsA in Chinese renal transplantation recipients. The sequence of C0/D when test time ≤1 month after renal transplantation is as follows as CYP3A5*1/*1 genotype KEYWORDS CYP3A5 6986A>G;Gene polymorphism; Cyclosporine A;Renal transplantation; Blood concentration;Correlation; Meta-analysis 中国慢性肾病横断面调查显示,我国成年人慢性肾病患病率为10.8%,约有1.195亿患者[1]。肾移植术是终末期肾脏疾病的最佳治疗方式[2],而免疫排斥反应是肾移植术后最常见、最严重的并发症,直接影响移植术后肾的存活及患者的生存率[3]。肾移植术后的免疫抑制治疗是目前预防免疫排斥反应的主要措施,对于肾移植术后患者至关重要。环孢素A(Cyclosporine A,CsA)是一种从真菌培养液中分离得到的含有11个氨基酸的环状多肽类物质[4],为临床常用的强效免疫抑制剂,已广泛用于预防肾移植术后的免疫排斥反应[5]。但CsA存在治疗窗窄、口服生物利用度差、个体差异大、不良反应多、需长期进行血药浓度监测并调整剂量等缺点[6-7]。 药物基因组学研究发现,约20%~95%药物的药动学个体差异是由遗传因素引起的[8],CsA代谢酶细胞色素P450(CYP)3A5编码基因6986A>G的多态性可能是引起CsA血药浓度个体差异的重要原因。孙搏等[9]研究发现,CYP3A5 6986A>G基因多态性与CsA血药浓度存在相关性,CsA剂量校正后的谷浓度(C0/D)的大小顺序为CYP3A5*1/*1型 1 资料与方法 1.1 纳入与排除标准 1.1.1 研究类型 国内外公开发表的病例对照研究或队列研究;语种限定为中文和英文。 1.1.2 研究对象 肾移植术后使用CsA免疫抑制治疗并进行血药浓度监测的中国患者;患者需接受CYP3A5 6986A>G基因多态性检测;检测方法、患者年龄、性别均不限。按基因多态性检测结果将患者分为CYP3A5*1/*1型、CYP3A5*1/*3型和CYP3A5*3/*3型。 1.1.3 干预措施 患者肾移植术后均接受以CsA为基础的免疫抑制治疗,CsA给药方法、剂量不限。 1.1.4 结局指标 ①CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA的C0/D;②CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C0/D;③CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C0/D;④CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA剂量校正后的峰浓度(C2/D);⑤CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C2/D;⑥CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C2/D。 1.1.5 排除标准 ①重复发表的文献;②会议摘要;③无法获得全文的文献;④无法获取相关有效数据的文献;⑤文献中联合使用其他已知影响CsA血药浓度的药物;⑥不符合Hardy-Weinberg平衡(HWE)检验的文献。 1.2 文献检索策略 计算机检索Cochrane图书馆、PubMed、Embase、中国生物医学文献数据库、中国期刊全文数据库、维普数据库、万方数据库等。英文检索词为“CYP3A”“CYP3A5”“Cytochrome P-450”“Kidney transplantation”“Renal transplantation”“Cyclosporine”“Ciclosporin”“Cyclosporin A”等,中文检索词为“CYP3A”“CYP3A5”“细胞色素P450”“肾移植”“環孢素”等。检索时限均为各数据库建库起至2019年2月。采用主题词和自由词相结合的方式进行检索。 1.3 文献筛选与资料提取 由两位研究者独立按照纳入与排除标准筛选文献,并交叉核对,如有异议与第三位研究者协商并讨论裁定。提取资料包括第一作者、发表年份、患者属地、例数、年龄、性别、CsA检测方法及检测时间、结局指标等。 1.4 文献质量评价 采用纽卡斯渥太华量表(NOS)评分对纳入文献的质量进行评价,具体包括:(1)研究对象的选择(暴露组的代表性、非暴露组的代表性、暴露因素确定、肯定研究起始时尚无要观察的结局指标);(2)组间可比性(设计和统计分析时考虑暴露组和非暴露组的可比性);(3)结果测量(结局指标的评价、随访时间足够长、暴露组和非暴露组随访的完整性)。总分为9分,0~5分为低质量研究,6~9分为高质量研究[11]。 1.5 统计学方法 采用Rev Man 5.3软件进行Meta分析。对纳入研究的基因型分布频率进行HWE检验,P>0.05为符合HWE检验,表明样本具有群体代表性。计量资料以均方差(MD)及其95%置信区间(CI)表示。各研究结果的异质性采用Q检验和I 2检验。若各研究间无统计学异质性(P>0.10,I 2<50%),采用固定效应模型进行分析;反之,则采用随机效应模型进行分析[12]。采用Stata 12.0软件绘制倒漏斗图,结合Egger’s检验进行发表偏倚分析。P<0.05为差异有统计学意义。 2 结果 2.1 文献检索结果与纳入研究基本信息 初检得到相关文献428篇,剔除重复发表的文献后,阅读文题和摘要,并进一步阅读全文,最终纳入8篇文献[9-10,13-18]。其中英文文献6篇[10,13-15,17-18],中文文献2篇[9,16],共计890例患者。文献筛选流程见图1;纳入研究基本信息见表1(表中, FPIA表示荧光偏振免疫分析法,CMIA表示化学发光微粒子免疫分析法)。 2.2 纳入研究质量评价结果 8項研究均为队列研究[9-10,13-18];5项研究[9-10,13,15,17]NOS评分为8分,3项研究[14,16,18]为7分,均为高质量研究,详见表2。 2.3 Meta分析结果 2.3.1 CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA的C0/D比较 8项研究[9-10,13-18]均报道了CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA的C0/D,各研究间有统计学异质性(P=0.04,I 2=52%),采用随机效应模型进行Meta分析,详见图2。Meta分析结果显示,CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*1/*3型,差异有统计学意义[MD=-6.97,95%CI(-13.18,-0.76),P=0.03]。 按肾移植术后CsA检测时间进行亚组分析,结果见表3。Meta分析结果显示,肾移植术后CsA检测时间≤1个月时CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*1/*3型,差异有统计学意义[MD=-8.50,95%CI(-12.57, -4.43),P<0.000 1];检测时间>1~<6个月时CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*1/*3型,差异有统计学意义[MD=-14.02,95%CI(-26.28,-1.76),P=0.02];检测时间≥6个月时CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA的C0/D比较,差异无统计学意义[MD=1.74,95%CI(-15.25,18.73),P=0.84]。 2.3.2 CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C0/D比较 8项研究[9-10,13-18]均报道了CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C0/D,各研究间无统计学异质性(P=0.09,I 2=43%),采用固定效应模型进行Meta分析,详见图3。Meta分析结果显示,CYP3A5*1/*3型患者CsA的C0/D显著低于CYP3A5*3/*3型,差异有统计学意义[MD=-6.04,95%CI(-8.99,-3.09),P<0.000 1]。 按肾移植术后CsA检测时间进行亚组分析,结果见表4。Meta分析结果显示,肾移植术后CsA检测时间≤1个月时CYP3A5*1/*3型患者CsA的C0/D显著低于CYP3A5*3/*3型,差异有统计学意义[MD=-6.94,95%CI(-10.21,-3.68),P<0.000 1];检测时间>1~<6个月时CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C0/D比较,差异无统计学意义[MD=1.28,95%CI(-13.01,15.57),P=0.86];检测时间≥6个月时CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C0/D比较,差异无统计学意义[MD=-1.11,95%CI(-11.08,8.86),P=0.83]。 2.3.3 CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C0/D比较 8项研究[9-10,13-18]均报道了CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C0/D,各研究间有统计学异质性(P=0.000 3,I 2=75%),采用随机效应模型进行Meta分析,详见图4。Meta分析结果显示,CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*3/*3型,差异有统计学意义[MD=-12.64,95%CI(-21.09,-4.20),P=0.003]。 按肾移植术后CsA检测时间进行亚组分析,结果见表5。Meta分析结果显示,肾移植术后CsA检测时间≤1个月时CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*3/*3型,差异有统计学意义[MD=-16.69,95%CI(-24.03,-9.36),P<0.000 01];检测时间>1~<6个月时CYP3A5*1/*1型患者CsA的C0/D显著低于CYP3A5*3/*3型,差异有统计学意义[MD=-16.78,95%CI(-28.63,-4.93),P=0.006];检测时间≥6个月时CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C0/D比较,差异无统计学意义[MD=2.82,95%CI(-25.21,30.85),P=0.84]。 2.3.4 CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA的C2/D比较 3项研究[9,15,17]报道了CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA的C2/D,各研究间有统计学异质性(P=0.12,I 2=52%),采用随机效应模型进行Meta分析,详见图5。Meta分析结果显示,CYP3A5*1/*1型与CYP3A5*1/*3型患者CsA的C2/D比较,差异无统计学意义[MD=-16.21,95%CI(-73.14,40.72),P=0.58]。 2.3.5 CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C2/D比较 3项研究[9,15,17]报道了CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C2/D,各研究间有统计学异质性(P=0.94,I 2=0),采用固定效应模型进行Meta分析,详见图6。Meta分析结果显示,CYP3A5*1/*3型与CYP3A5*3/*3型患者CsA的C2/D比较,差异无统计学意义[MD=-12.96,95%CI(-31.49,5.56),P=0.17]。 2.3.6 CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C2/D比较 3项研究[9,15,17]报道了CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C2/D,各研究间有统计学异质性(P=0.13,I 2=51%),采用随机效应模型进行Meta分析,详见图7。Meta分析结果显示,CYP3A5*1/*1型与CYP3A5*3/*3型患者CsA的C2/D比较,差異无统计学意义[MD=-29.01,95%CI(-84.78,26.75),P=0.31]。 2.4 敏感性分析 以患者CsA的C0/D为指标逐一剔除单个研究,在剔除Chu XM等[10]的研究后,各研究间统计学异质性减小,对其他研究重新进行Meta分析。结果显示,CYP3A5*1/*1型与CYP3A5*1/*3型[MD=-8.11,95%CI(-11.85, -4.38),P<0.001]、CYP3A5*1/*3型与CYP3A5*3/*3型[MD=-7.02,95%CI(-10.06,-3.98),P<0.000 01]、CYP3A5*1/*1型与CYP3A5*3/*3型[MD=-16.03,95%CI(-22.14,-9.92),P<0.000 01]患者CsA的C0/D与未剔除前比较,差异均无统计学意义(P>0.05),提示结果稳定。 2.5 发表偏倚分析 以患者CsA的C0/D为指标绘制倒漏斗图,结果有部分研究散点在倒漏斗图范围外,但图形分布基本对称。经Egger’s检验,CYP3A5各基因型C0/D两两比较的P值分别为0.502、0.671、0.518,均大于0.05,提示本研究存在发表偏倚的可能性较小,详见图8~图10。 3 讨论 药物代谢酶基因多态性是引起药物个体差异的重要原因,药物代谢酶在体内的表达及活性可影响其底物的代谢过程,从而使药物疗效和不良反应产生个体化差异[19]。CsA主要通过CYP3A4和CYP3A5酶代谢,有研究认为CYP3A4在中国人群中的基因突变频率较低,因此CYP酶对CsA代谢的影响主要取决于CYP3A5基因[6]。CYP3A5基因位于人类第7号染色体上,含13个外显子,编码502个氨基酸,其具有多个突变位点,其中以CYP3A5*3(6986A>G,rs776746)的研究最为广泛[20]。有研究发现,CYP3A5*3等位基因编码了一个异常剪接的信使核糖核酸(mRNA)和一个过早的终止密码子,使CYP3A5表达受阻,CYP3A5代谢酶活性丧失,只有至少存在一个CYP3A5*1等位基因时才能转录出完整的mRNA并进行表达[21]。 本研究结果显示,CYP3A5 6986A>G基因多态性与患者CsA的C0/D具有相关性,且其C0/D大小顺序为CYP3A5*1/*1型 综上所述,CYP3A5 6986A>G基因多态性与中国肾移植术后患者CsA的C0/D具有一定的相关性,且在肾移植术后CsA检测时间≤1月时的大小顺序为CYP3A5*1/*1型 参考文献 [ 1 ] ZHANG L,WANG F,WANG L,et al. Prevalence of ch- ronic kidney disease in China:a cross-sectional survey[J]. Lancet,2012,379(9818):815-822. [ 2 ] MANOOK M,KOESER L,AHMED Z,et al. Post-listing survival for highly sensitised patients on the UK kidney transplant waiting list:a matched cohort analysis[J]. Lancet,2017,389(10070):727-734. [ 3 ] 中国医师协会器官移植医师分会,中华医学会器官移植学分会.中国肾移植受者免疫抑制治疗指南:2016版[J]. 器官移植,2016,7(5):327-331. [ 4 ] 廖秀娟,韦柳萍.环孢素A的药动学及其影响因素研究进展[J].中国药房,2015,26(4):558-561. [ 5 ] CRETTOL S,VENETZ JP,FONTANA M,et al. CYP3A7,CYP3A5,CYP3A4,and ABCB1 genetic polymorphisms,cyclosporine concentration,and dose requirement in transplant recipients[J]. Ther Drug Monit,2008,30(6):689- 699. [ 6 ] 韦玉,何晓静,肇丽梅,等.细胞色素P450 3A亚族和MDR1基因多态性对环孢素A代谢影响的研究进展[J]. 中国医院药学杂志,2010,30(7):593-596. [ 7 ] SHARAKI O,ZEID M,MOEZ P,et al. Impact of CYP3A4 and MDR1 gene(G2677T)polymorphisms on dose requirement of the cyclosporine in renal transplant Egyptian recipients[J]. Mol Biol Rep,2015,42(1):105-117. [ 8 ] EVANS WE,MCLEOD HL. Pharmacogenomics-drug disposition,drug targets,and side effects[J]. N Engl J Med,2003,348(6):538-549. [ 9 ] 孙搏,郭彦琨,高君伟,等. CYP3A基因多态性与肾移植术后不同时期环孢素浓度剂量个体差异的相关性研究[J].中国药师,2017,20(1):91-93. [10] CHU XM,HAO HP,WANG GJ,et al. Influence of CYP3A5 genetic polymorphism on cyclosporine A metabolism and elimination in Chinese renal transplant recipients[J]. Acta Pharmacol Sin,2006,27(11):1504-1508. [11] 劉鸣.系统评价、Meta分析设计与实施方法[M].北京:人民卫生出版社,2011:72. [12] 何淼泉,王继生,肖京平,等.他喷他多速释剂用于缓解拇囊炎术后中重度急性疼痛有效性和安全性的Meta分析[J].中国药房,2019,30(8):1117-1123. [13] ENG HS,MOHAMED Z,CALNE R,et al. The influence of CYP3A gene polymorphisms on cyclosporine dose requirement in renal allograft recipients[J]. Kidney Int,2006,69(10):1858-1864. [14] HU YF,QIU W,LIU ZQ,et al. Effects of genetic polymorphisms of CYP3A4,CYP3A5 and MDR1 on cyclosporine pharmacokinetics after renal transplantation[J]. Clin Exp Pharmacol Physiol,2006,33(11):1093-1098. [15] QIU XY,JIAO Z,ZHANG M,et al. Association of MDR1,CYP3A4*18B,and CYP3A5*3 polymorphisms with cyclosporine pharmacokinetics in Chinese renal transplant recipients[J]. Eur J Clin Pharmacol,2008,64(11):1069- 1084. [16] 史道华,林知捷.钙通道阻滞剂对肾移植患者环孢素血药浓度/剂量的影响与CYP3A5基因多态性有关[J].中国临床药理学与治疗学,2008,13(10):1149-1153. [17] CHEN B,ZHANG W,FANG J,et al. Influence of the MDR1 haplotype and CYP3A5 genotypes on cyclosporine blood level in Chinese renal transplant recipients[J].Xenobiotica,2009,39(12):931-938. [18] MENG XG,GUO CX,FENG GQ,et al. Association of CYP3A polymorphisms with the pharmacokinetics of cyclosporine A in early post-renal transplant recipients in China[J]. Acta Pharmacol Sin,2012,33(12):1563-1570. [19] WANG L,MCLEOD HL,WEINSHILBOUM RM. Genomics and drug response[J]. N Engl J Med,2011,364(12):1144-1153. [20] 羊仙. CYP3A5基因多态性的临床研究进展[J].智慧健康,2018,4(22):57-58. [21] KUEHL P,ZHANG J,LIN Y,et al. Sequence diversity in CYP3A promoters and characterization of the genetic basis of polymorphic CYP3A5 expression[J]. Nat Genet,2001,27(4):383-391. [22] TANG HL,MA LL,XIE HG,et al. Effects of the CYP3A5*3 variant on cyclosporine exposure and acute rejection rate in renal transplant patients:a meta-analysis[J]. Pharmacogenet Genomics,2010,20(9):525-531. [23] 赵力波,贾霜.肾移植术后C2浓度的监测[J].河南外科学杂志,2010,16(1):87-88. [24] NEMATI E,EINOLLAHI B,TAHERI S,et al. Cyclosporine trough (C0) and 2-hour postdose (C2) levels:which one is a predictor of graft loss? [J]. Transplant Proc,2007,39(4):1223-1224. (收稿日期:2019-04-15 修回日期:2019-08-19) (编辑:陈 宏)
