芒果壮铗普瘿蚊为害对芒果叶片挥发物的影响
2019-09-10蔡鸿娇陈峰
蔡鸿娇 陈峰



摘 要:【目的】探讨芒果壮铗普瘿蚊为害对芒果叶片挥发物的影响,为瘿蚊防治提供参考依据。【方法】采用顶空固相微萃取(SPME)及气质联用仪(GC-MS)技术分析芒果壮铗普瘿蚊为害后芒果叶片挥发性物质和相对含量的变化。【结果】健康叶片和虫伤叶分别含有65种和66种挥发物成分, 其中45个组分相同,主要包括石竹烯、α-荜澄茄烯、十八碳烯、蒈烯、水芹烯、β-月桂烯、蒎烯等。瘿蚊为害后挥发物主要为萜烯类31种和芳香族化合物13种,相对含量分别高达51.41%和41.10%,酯类物质相对含量明显高于健康叶片,成分也发生改变。虫伤叶挥发物除了萘和薁之外,主要物质包括甲基-4-(1-甲基亚乙基)-环己烯(24.32%)、α-荜澄茄烯(8.92)、3-蒈烯(2.23%)、乙酸酯3-己烯-1-醇(2.23%)、4-蒈烯(1.06%)、柠檬烯(1.04%)、a-石竹烯(1.46%)。极微量物质包括辛醇、兰桉醇、斯巴醇、表蓝桉醇、长香茅醇,香豆素类化合物只在健康叶片中检测到,马兜铃烯、法呢烯和一些特殊萘和薁芳香族化合物只在虫伤叶中检测到。【结论】芒果叶片的主要挥发性物质为芳香族类和萜烯类化合物,瘿蚊为害后导致挥发物质和含量发生明显改变。
关键词:芒果壮铗普瘿蚊;顶空固相微萃取;GC-MS;挥发物;虫伤叶
中图分类号:S 433文献标识码:A文章编号:1008-0384(2019)02-223-06
0 引言
【研究意义】芒果壮铗普瘿蚊Procontarinai robusta Li,Pu and Zhang,2003属双翅目Diptera、瘿蚊科Cecidomyiidae、普瘿蚊属Procontarinai Kieffer& Cecconi,2003年被鉴定为新种[1]。DAISIE(欧洲抵御外来物种计划项目)2009年公布的欧洲外来物种详细报告指出,外来物种导致经济价值、生物多样性及生态系统功能的明显损失,芒果壮铗普瘿蚊被列为11 000种入侵害虫防控对象名单内[2]。陈永森等风险分析认为该物种具有高度的危险性,应列为国家二类检疫对象[3]。
芒果树是厦门市的主要行道树种之一,芒果壮铗普瘿蚊主要为害芒果树叶片,1999年在厦门首次发现,随后十几年逐渐蔓延爆发扩散到厦门周边城市[4]。芒果树是芒果壮铗普瘿蚊的唯一寄主,每年发生4代,4~11月为害情况比较严重。成虫将虫卵产在芒果嫩叶的背面,孵化后幼虫直接钻入叶肉取食为害,造成叶片隆起,形成黑色虫瘿,梅雨季节幼虫为害部位经常形成斑点、孔洞、腐烂,虫瘿数量多的严重影响植物生长发育,从而导致芒果树提前衰老、叶片发黄干枯、提早凋落、不开花结果等现象[5],影响果园芒果产量和品质,也影响芒果行道树的景观特色。
除了芒果壮铗普瘿蚊,其他瘿蚊对寄主也表现出明显的专一寄生性和特殊的虫瘿形态,因此瘿蚊个体即使再小,也可以通过虫瘿的形态来判断瘿蚊物种。芒果壮铗普瘿蚊的防治也较为困难,瘿壳厚硬的特点使化学药剂难以达到靶标害虫,且容易农药残留,利用植物化学信息素防治和监测芒果壮铗普瘿蚊成虫是一种新的防治途径。【前人研究进展】瘿蚊对寄主植物的选择主要依靠植物挥发性物质。植物挥发性物质影响昆虫行为,如产卵、觅食、交配、繁殖、生长等[6]。特别是健康植物叶片中拥有可以引诱害虫的挥发性气味,可以引诱害虫在叶片上进行取食繁殖等活动[7]。同理芒果叶片的挥发物影响芒果壮铗普瘿蚊对寄主搜索定位、产卵、取食等行为。
目前已知的植物挥发性有机物主要成分包括醇类、醛类、酮类、酯类、萜烯类和芳香族类等。天然产物分离技术常见包括水蒸气蒸馏法、吸附树脂法、有机溶剂浸提法、超临界CO2萃取法、分子蒸馏法、抽气吸附法、动态顶空采集法和固相微萃取法(SPME),植物挥发物的采集和测定应尽可能真实反映自然状态下植物挥发物的成分和组成,顶空采样联合气质联用仪(GC-MS)对小分子的检测能力较差,而SPME-GC-MS具有无需有机溶剂、对成分检测灵敏度高、操作简单、重现性好、无污染等优点,被广泛采纳。【本研究切入点】目前通过植物次生物质调控害虫行为从而达到控制害虫种群的目的是世界研究热点。虽然SPME-GC-MS只能进行定性和相对含量分析,无法进行定量分析,但对初步判断瘿蚊为害对芒果挥发性物质成分的改变是可行的。
因此分析瘿蚊为害对植物挥发物成分的影响有利于揭示昆虫与植物之间的互作关系,对未来利用植物信息素监测和防治害虫种群提供参考依据。【拟解决的关键问题】本研究通过比较健康叶片和虫伤叶挥发性成分和相对含量的差异来分析害虫对植物次生物质的影响,以期為从植物中提取或者合成控制害虫的活性物质防治害虫提供参考依据。
1 材料与方法
1.1 试验材料
芒果叶片采集来自集美大学校园内芒果行道树,选择新鲜芒果树新抽梢上的嫩叶,健康叶片为对照组,以及刚被瘿蚊为害的嫩梢叶片为虫伤组,每组分别100g, 每组各重复4次。利用顶空固相微萃取方法吸附挥发性气味,将叶片置入顶空样品瓶中,插上萃取头在室温下进行萃取,萃取的时长为40 min。
1.2 气相色谱质谱联用仪(GC-MS)分离条件
采用气相色谱质谱联用仪(仪器型号Agilent 7980A GC;MS: 5975C)测定芒果叶片的植物挥发性成分。
采用的色谱柱是HP-INNOWax(30 m×0.25 mm×0.25 μm),柱温采用程序升温,初温40℃,以3℃·min-1升至120℃,再以5℃·min-1升至200℃,保持10 min;进样口的温度250℃,采用不分流进样载气高纯He,流量1.0 mL·min-1。萃取头在进样口脱附3 min。质谱条件为电子轰击离子源(EI);检测器电压为350V;离子源温度为200℃;接口温度为250℃,电子能量70 eV;扫描质量范围为35~335 amu。
1.3 挥发性化合物的定性和半定量分析
利用NIST谱库检索定性,面积归一化法求各成分的百分含量。
2 结果与分析
2.1 健康叶片与虫伤叶挥发物数量和相对含量
芒果叶片挥发物成分复杂,主要分为芳香族化合物、萜烯类、醇类、酯类、烃类、醛类、酮类和酸类8类,其中芳香族化合物和萜烯类是主要成分组成部分。
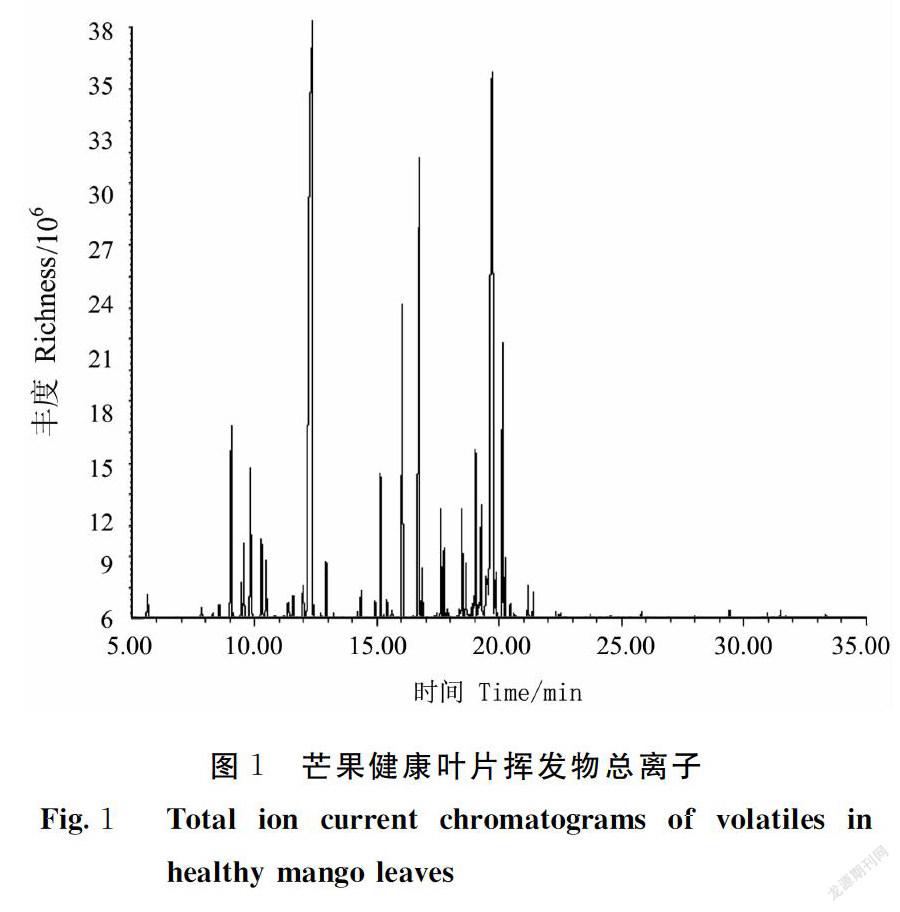
健康叶片挥发物总离子图见图1,各组分经过计算机谱库,共检出161个成分,分离鉴定出有效组分65种(表1),主要为芳香族化合物16种和萜烯类27种,相对含量分别高达29.77%和50.64%。
瘿蚊为害后叶片挥发物总离子图见图2,共检出158个成分,分离鉴定出其中有效组分 66种,主要为萜烯类31 種和芳香族化合物 13 种 ,相对含量分别高达51.41%和 41.10%(表1)。
试验结果显示芒果主要挥发物成分为萜烯类物质,与Winterhalter的报道基本一致,他认为芒果香味由酯类、萜烯类、酮类、醛类以及非萜烯类的其他烃类等物质共同作用产生[8]。结果显示醇类、酯类、烃类、醛类、酮类和酸类含量较低,这是由于很多挥发物只有在芒果果实成熟过程中释放,比如水果在绿熟期开始形C2~C6 的酯类[9],同时在成熟过程产生的重要香气产物是醛类和醇类[10],本试验主要测定叶片,所以这类物质较少。有些喇叭茶醇、表蓝桉醇、杜松醇等是薁前驱体化合物,即可经脱水、脱氢转化为薁,薁属芳香族化合物。被瘿蚊为害后酯类的相对含量明显增加,很多实验也证明害虫为害导致植物产生特异性气味,被称为取食诱导挥发物(Herbivory-induced plant volatiles,HIPVs)。
2.2 健康叶片与虫伤叶挥发物主要成分
健康叶片与虫伤叶含有45个相同组分,瘿蚊为害后产生21种成分的差别,常见的共同挥发性物质包括石竹烯、α-荜澄茄烯、十八碳烯、蒈烯、水芹烯、β-月桂烯、蒎烯等(表2),α-水芹烯被证明也是芒果花的主要成分,β-石竹烯是芒果果实挥发物的主要成分之一,β-荜澄茄油烯在果实和花中也均有被检测到[11]。同时检测出大量的萘与其同分异构体薁的出现。
健康叶片挥发物除了萘和薁之外,主要的物质包括甲基-4-(1-甲基亚乙基)-环己烯(31.6%)、α-荜澄茄油烯(5.03%)、3-蒈烯(3.01%)、4-蒈烯(1.98%)、柠檬烯(1.10%)等(表2)。很多醇类虽然含量极低,比如辛醇、兰桉醇、斯巴醇、表蓝桉醇、长香茅醇,只有在健康叶片检测到,而这些物质是芳香族化合物的前体。极微量的香豆素类化合物在健康叶片中发现。从活性上看香豆素类化合物由于其共轭双键的存在, 具有较高的生物活性,比如3-芳基香豆素化合物具有显著的抑制细胞生长,从而用在抗肿瘤治疗[12],然而呋喃香豆素类化合物能被昆虫细胞色素P450降解[13]。柠檬烯广泛存在天然植物中,在高温中可以分解成异戊二烯,研究发现柠檬烯对肉类腐败有抑菌效果,因此在防腐保鲜领域被广泛研究。本试验中两者柠檬烯相对含量差别不大。健康叶片中含有的硫氰酸二酯在虫伤叶中并未发现。该物质是否和异硫氰酸酯具有相同的功能有待研究,异硫氰酸酯可以帮助害虫定向寻找寄主[14]。
虫伤叶挥发物除了苯和薁之外,主要的物质包括甲基-4-(1-甲基亚乙基)-环己烯(24.32%)、α-荜澄茄烯(8.92)、3-蒈烯(2.23%)、乙酸酯3-己烯-1-醇(2.23%)、4-蒈烯(1.06%)、柠檬烯(1.04%)、a-石竹烯(1.46%)等。α-蒎烯,β-蒎烯和莰烯被认为是芒果叶片吸引瘿蚊形成虫瘿的主要生物标志物,含量越高越容易吸引瘿蚊Procontarinia matteiana为害[15]。本试验中α-蒎烯在虫伤叶的含量明显高于健康叶片,β-蒎烯和莰烯两者差别不大。有些组分只有在虫伤叶中才被检测到,比如马兜铃烯、法呢烯等(表2),马兜铃酸被证明具有毒性,国际癌症研究机构2008年将马兜铃酸列为1类致癌物,将马兜铃酸类物质列为2类致癌物,为害后产生的马兜铃烯是否对瘿蚊产生拒食作用有待研究。更多的芳香族化合物萘薁结构复杂,含量丰富。酯类物质相对含量明显高于健康叶片,成分也发生改变。石竹烯是双环倍半萜的植物化合物,药理研究对细胞膜具有高亲和力,有局部麻醉、抗炎、驱蚊虫、抗焦虑、抗抑郁作用[16],本试验测定结果显示,α-石竹烯在瘿蚊为害后含量增加,是否会对瘿蚊有驱避作用需进行风洞行为实验和触角电位实验确认。
3 讨论与结论
本研究结果说明芒果叶片的主要挥发性物质为芳香族类和萜烯类化合物,瘿蚊为害后可导致叶片挥发物组分和含量发生明显改变。植物释放的挥发物的化学成分和比例变化被称为化学指纹图谱(chemical fingerprint) [17],可以调控昆虫的寄主定向选择、产卵取食、交配繁殖等行为[18]。本试验测定结果显示,芒果叶片与前人果实的成分鉴定差别较大,是否与寄主品种也有关系,有待进一步确认。
昆虫对寄主植物的搜索是一个复杂的过程,包括对气味的识别和色彩的定位,其中挥发物是主要线索,但是挥发物的成分复杂,未来的研究将测定不同挥发物浓度下对昆虫的电生理反应和行为反应。田厚军等[11]研究表明,昆虫触角对同一挥发物不同浓度表现出不同的电生理反应,雌雄之间也有显著差别。昆虫对寄主挥发物的感知主要取决于触角感受器中的嗅觉受体神经元(olfactory receptor neurones,ORNs),这些神经元可以识别单分子结构,而寄主植物的挥发物通常都是混合的,这要求ORNs能够在高背景气味干扰下短时间内在不同浓度挥发物中精细的分辨出相关的寄主主体气味线索[19]。芒果壮铗普瘿蚊对芒果叶片的寄主专一性必然和某种或者某几种物质紧密相连,因此挥发物的有效成分配比和持续时间是未来的研究重点,同时挥发物的提取和人工合成必须是经济实惠才能实现市场化。
参考文献:
[1]李军,卜文俊,张清源.危害芒果叶片的瘿蚊科—中国新纪录和物种[J].动物分类学报,2006,28(1):148-151.
LI J, PU W J, ZHANG Q Y. A new species of gall midge (Diptera, Cecidomyiidae) attacking mango leaves from China[J]. Acta Zootaxonomica Sinica, 2006,28(1):148-151.(in Chinese)
[2]NENTWIG W. Handbook of Alien Species in Europe. In chapter 11, list of species alien in Europe and to Europe[M]. Dordrecht: Springer Dordrecht, 2009: 247.
[3]陳永森,黄国弟,李日旺,等. 入侵有害生物壮铗普瘿蚊在我国的风险分析[J].南方农业学报,2017, 48(3): 454-458.
CHEN Y S, HUANG G D, LI R W, et al. Risk analysis of Procontarinia robusta Li,Bu and Zhang in China: An invasive pest[J]. Journal of Southern Agriculture, 2017, 48(3): 454-458.(in Chinese)
[4]CAI H J, Kolesik P, Wang HY, et al. Description of the immature stages and gall morpholgy, and molecular characterisation of Procontarinia robusta, a gall midge (Diptera: Cecidomyiidae) damaging leaves of mango Mangifera indica L. (Anarcadiaceae) in southern Asia[J]. Australian Journal of Entomology, 2013, 52: 206-211.
[5]王伟新,王宏毅. 芒果壮铗普瘿蚊生物学特性初报[J].,2005,20(2):74-76.
WANG W X, WANG H Y. A preliminary report on biological characters of Procontarinia robusta in mango[J]. Fujian Journal of Agricultral Science, 2005,20(2):74-76.(in Chinese)
[6]DEMORAES C M, LEWIS W J, PAR P W. Herbivore-infested plants selectively attract parasitoids[J]. Nature, 1998, 393(6685): 570-573.
[7]杜家纬.植物-昆虫间的化学通讯及其行为控制[J].植物生理学报,2005,27(3):193-200.
DU J W. Plant-insect Chemical Communication and Its Behavior Control[J]. Acta Phytophysiologica Sinica, 2005,27(3):193-200.(in Chinese)
[8]WINTERHALTER P. Volatile compounds in foods and beverages [M].New York: Marcel Dekker, 1991:389-409.
[9]CANUTO K M, de Souza M A, GARRUTID D. Volatile chemical composition of mango fruit 'Tommy Atkins', cultivated in San Francisco valley, at different stages of maturity[J]. Quimica Nova, 2009, 32(9): 2377-2381.
[10]PANDITS S, KULKARNIR S, CDLEY H G, et al. Changes in volatile composition during fruit development and ripening of Alphonso mango[J]. Journal Science Food Agricultury, 2009, 89(12): 2071-2081.
[11]田厚军,陈艺欣,魏辉,等,芒果不同部位挥发物及横线尾夜蛾对其触角电位反应[J]. 生物安全学报, 2012, 21(2): 142-147.
TIAN H J, CHEN Y X, WEI H, et al. Volatiles emitted by mango (Mangifera indica) plants and electrophysiological responses of Chlumetia transverse to such volatiles[J]. Journal of Biosafety, 21(2): 142-147.(in Chinese)
[12]肖春芬,黄秋妹,李永冲,等. 3-芳基香豆素类化合物抗肿瘤活性研究进展[J].广州化学,2018,43(06),72-78.
XIAO C F, HUANG Q M, LI Y C, et al. Progress in the Anti-tumor Activity of 3-Aryl Coumarins[J]. Guangzhou Chemistry, 2018,43(6),72-78.(in Chinese)
[13]BERENBAUM M R, ZANGERL A R. Furanocoumarin metabolism in Papiliopolyxenes: biochemistry , genetic variability , and ecological significance[J].Oecologia , 1993,95:370-375.
[14]WITTSTOCK U,BUROW M. Glucosinolate breakdown in Arabidopsis:mechanism,regulation and biological significance[J]. The Arabidopsis Book,2010(8): e0134.
[15]AUGUSTYNA W A, BOTHAA B M, COMBRINCKA S, et al. Correlation of volatile profiles of twenty mango cultivars with their susceptibilities to mango gall fly infestation[J]. South African Journal of Botany, 2012, 76(4):710-716.
[16]张季林,魏惠珍,张洁. β-石竹烯生物学功能的研究进展[J].山东医药,2018, 58(3):110-112.
ZHANG J L, WEI H Z, ZHANG J. Advances in biological functions of beta-caryophyllene[J]. Shandong Medical Journal, 2018, 58(3):110-112.(in Chinese)
[17]PICHERSKY E,GERSHENZON J. The formation and function of plant volatiles: perfumes for pollinator attraction and defense[J]. Current Opinion of Plant Biology,2002,5(3): 237-243.
[18]王红伟,杨伟,杨桦,等. 横坑切梢小蠹对植物挥发物的电生理和行为反应[J].生态学杂志,2014, 33 (5):1260-266.
WANG H W, YANG W, YANG H, et al, Electroan-tennogram and behavioral responses of Tomicus minor(Hartig)(Coleoptera:Scolytidae) to plant volatiles[J]. Chinese Joural of Ecology, 2014, 33 (5):1260-1266.(in Chinese)
[19]BRUCE T J A and PICKETT J A. Perception of plant volatile blends by herbivorous insects Finding the right mix[J]. Phytochemistry, 2011, 72(13): 1605-1611.
(責任编辑:林海清)
