硫酸钙介导的诱导膜技术与常规诱导膜技术治疗胫骨创伤后大段骨缺损的临床疗效对比*
2019-09-09徐建平李妹霞左杨斌林国兵李平生
徐建平 李妹霞* 左杨斌 林国兵 李平生
现代社会,高能量损伤日益增多,各种创伤引起的四肢开放性损伤、粉碎性骨折、毁损伤频发,此类高能量损伤常常导致局部软组织坏死、创口感染,或者大量骨缺损。巨大骨缺损已成为临床骨科医师的棘手问题,其病程迁延难愈,治疗效果欠佳,给患者带来了巨大痛苦[1],临床处理困难。对于常见的巨大骨缺损的修复一直是骨科医师面临的挑战。
1 资料与方法
1.1 一般资料
本组2013 年1 月至2017 年5 月我院收治的39 例成人胫骨大段骨缺损患者资料:硫酸钙介导的Masquelet 技术治疗的23 例纳入硫酸钙组,男15 例,女8 例,骨缺损长度为(7.3±1.8) cm;传统常规的Masquelet 技术治疗的16 例纳入常规组,男12 例,女4 例,骨缺损长度为(7.4±1.9)cm。
1.2 手术方法
1.2.1 硫酸钙诱导膜技术组
选用腰硬联合麻醉。手术分两个阶段,第一阶段彻底清理骨缺损区,对死骨、硬化骨、无血运骨进行切除,消灭感染,如有必要,可对患者的软组织进行修复,后将硫酸钙与抗生素混合填充骨缺损区域,抗生素常为万古霉素,填充形状为棒状,后将骨断端位置连接,并以软组织将硫酸钙包裹后,进行筋膜、皮肤缝合,最后进行固定。本阶段手术结束后的20 ~60 d 内,可进行第二阶段手术,确保患者感染得到良好控制,软组织愈合情况较好,接触外固定后切开软组织、诱导膜,暴露硫酸钙,并将部分硫酸钙取出,随后将白色纤维膜打通,确保膜囊腔、骨髓腔连通,并选择自体骨或者骨替代材料,填充于膜腔内,使缺损的空腔填充好,然后缝合诱导膜,最后将骨断端进行内固定,随后以软组织将其覆盖,应确保软组织血供丰富,最后缝合皮肤。
典型病例:患者,男,55 岁。因“车祸致右小腿毁损伤5 h”急诊入院,入院后行“右胫腓骨开放性骨折伴骨缺损清创支架外固定术”;2 周后行“右胫骨下段骨缺损抗生素硫酸钙填充术”;50 d 后行“右小腿骨缺损自体髂骨植骨术”,术后恢复好(见图1)。

图1 A.术前骨坏死缺损;B.术前CT 示骨缺损;C.硫酸钙介导的诱导膜技术第一阶段;D.第二阶段填充自体骨;E.术后3 个月X 线片示骨折初步愈合;F.术后1 年X 线片示骨完全愈合;G.术后1 年三维CT 示骨愈合;H.术后功能恢复图片
1.2.2 常规诱导膜技术组
麻醉方式选用腰硬联合麻醉。手术分两个阶段,第一阶段的主要工作为彻底清理骨缺损区,对死骨、硬化骨、无血运骨进行切除,消灭感染,如有必要,可对患者的软组织进行修复,后将骨水泥与抗生素混合填充骨缺损区域,抗生素常为万古霉素,填充形状为棒状,后将骨断位置连接,并以软组织将骨水泥包裹后,进行筋膜、皮肤缝合,最后进行固定。本阶段手术结束后的20 ~60 d 内,可进行第二阶段手术,确保患者感染得到良好控制,软组织愈合情况较好,接触外固定后切开软组织、诱导膜,暴露骨水泥,并将骨水泥取出,随后将白色纤维膜打通,确保膜囊腔、骨髓腔连通,并选择自体骨或者骨替代材料,填充于膜腔内,使缺损的空腔填充好,然后缝合诱导膜,最后将骨断端进行内固定,随后以软组织将其覆盖,应确保软组织血供丰富,最后缝合皮肤。
1.3 术后处理及功能锻炼
两组患者均常规头孢二代抗生素使用48 h 预防伤口感染。术后及时行患肢正侧位DR 检查,明确植骨情况和骨折对位对线情况。每个月定期复查胫骨正侧位DR,确保骨折力线良好,同时评估骨痂生长情况,直到骨折区有大量骨痂生长,骨折愈合后,才可拆除外固定架,患肢渐进性功能锻炼,视情况逐步负重。
1.4 观察指标
收集并比较两组病例的骨愈合时间、完全负重时间、术后并发症情况及末次随访时的Iowa 膝关节评分、Iowa 踝关节评分、SF-36 量表得分。
1.5 统计学方法
采用SPSS 17.0 软件进行统计学分析,计量资料采用t检验,数据用均数±标准差表示,计数资料采用检验,以<0.05 为差异有统计学意义。
2 结果
39 例的随访时间为11 ~36 个月,平均(20.5±7.5)个月。硫酸钙组2 例出现钉道感染,嘱加强护理定期换药后好转;1 例切口感染,予以加强换药,敏感抗生素使用后治愈;常规组1 例髂骨切口处感染,加强换药后延迟4 d 拆线;3例钉道感染,嘱加强护理定期换药后好转;1 例术后4 周感染复发,再次行第一阶段手术后感染控制,于术后6 个月获骨愈合;1 例术后3 周发现切口有脓性分泌物流出,取分泌物作细菌培养后应用敏感抗生素治疗,症状得到控制;1 例因过早负重发生钢板失效、断裂,改为胫骨髓内钉固定后获骨愈合。硫酸钙组的骨愈合时间为16 ~26 周,平均(20.85±4.31)周,完全负重时间为 16 ~ 32 周,平均(23.17±6.93)周。常规组的骨愈合时间为12 ~36 周,平均(28.86±6.47)周,完全负重时间为 16 ~ 40 周,平均(32.87±6.79)周。两组患者的骨愈合时间、完全负重时间比较,差异均有统计学意义(=4.944,<0.000 1;=4.636,<0.000 1)(见表1)。
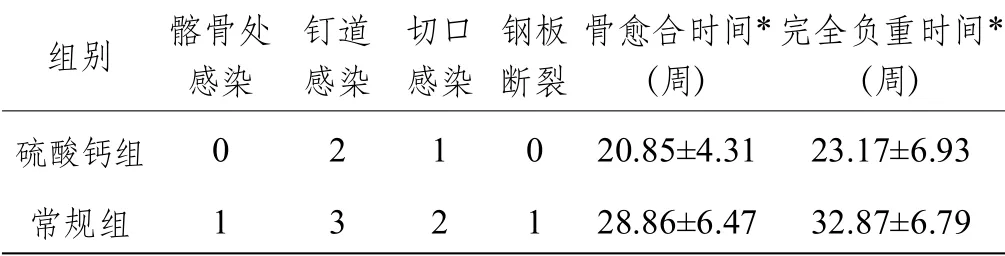
表1 两组患者术后并发症及骨愈合时间、完全负重时间比较
末次随访时,39 例患者均可在无痛状态下完全负重行走。硫酸钙组2 例下肢短缩1.5 cm,1 例下肢短缩1 cm;常规组2 例下肢短缩1 cm,1 例踝关节背伸受限,均不影响正常生活,未予特殊处理。末次随访时两组的膝、踝关节Iowa评分及SF-36 得分均较术前明显提高,差异均有统计学意义(均<0.05),但组间相同时间点的各项指标比较,差异均无统计学意义(均>0.05,见表2)。
表2 两组患者术前及末次随访时的膝、踝Iowa 评分及SF-36 得分比较
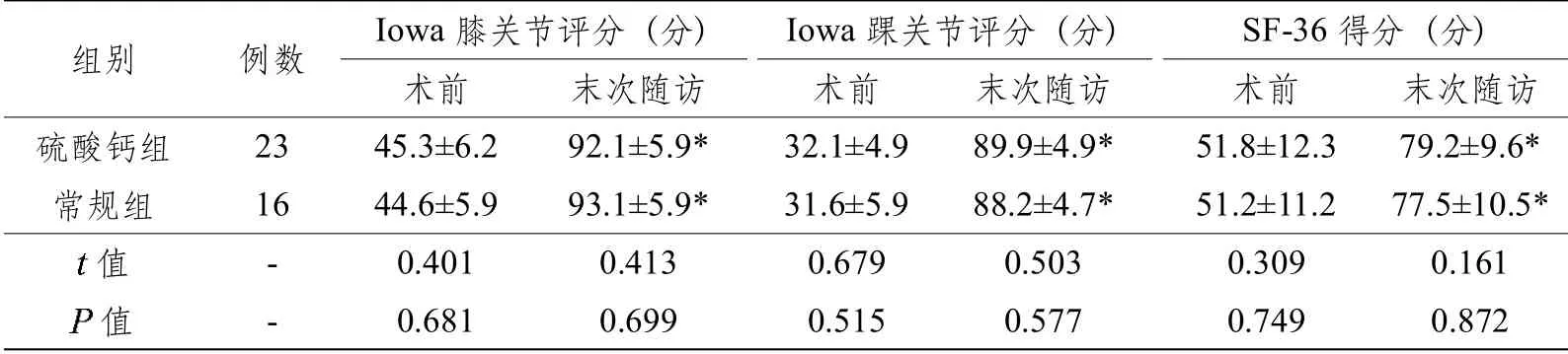
表2 两组患者术前及末次随访时的膝、踝Iowa 评分及SF-36 得分比较
注:*与术前相比较,差异有统计学意义(<0.05)。
组别 例数 Iowa 膝关节评分(分) Iowa 踝关节评分(分) SF-36 得分(分)术前 末次随访 术前 末次随访 术前 末次随访硫酸钙组 23 45.3±6.2 92.1±5.9* 32.1±4.9 89.9±4.9* 51.8±12.3 79.2±9.6*常规组 16 44.6±5.9 0.413 93.1±5.9* 31.6±5.9 88.2±4.7* 51.2±11.2 77.5±10.5*值 - 0.401 0.679 0.503 0.309 0.161images/BZ_22_511_1778_536_1804.png值 - 0.681 0.699 0.515 0.577 0.749 0.872
3 讨论
3.1 诱导膜技术的生物学基础及作用
在骨缺损区域填充骨水泥、硫酸钙等物质20 ~60 d后,局部可形成诱导膜,它是对填充物组织反应的产品。内层属于上皮细胞层,其为滑膜样,其中含有大量的上皮细胞、微血管;外层属于成纤维细胞层,其中含有大量的胶原纤维、微血管。诱导膜主要组成为成纤维细胞。据文献报道,在人体内形成的诱导膜与正常骨膜相比,每克诱导膜组织内蕴含的活细胞数量远超正常骨膜,约为11 倍。诱导膜内有着大量的浸润淋巴细胞增殖,诱导膜内CD 淋巴细胞约为正常骨膜内CD 淋巴细胞的31 倍[2]。这一情况证明,诱导膜内存在活跃度更好的免疫细胞补充。间充质干细胞在诱导膜中较为丰富,其与正常骨膜内的间充质干细胞扩充表现十分接近,成骨潜质较好,对患者的骨重建十分有益。
在手术的第一阶段,将填充物置入骨缺损区域中,能够避免软组织出现塌陷后占领骨缺损部位,以保障后续植骨空间。在手术的第二阶段,将填充物取出后,将自体骨替换填充物植入,以诱导膜隔离自体骨、软组织,确保骨骼具备独立、封闭的成长空间,保留、聚集骨祖细胞、有关因子,且相对独立的空间能够隔绝感染、炎症等不良因素干扰,同时避免了自体骨被吸收。
对于感染引起的骨缺损,填充物尤其是硫酸钙中,可以混入万古霉素,硫酸钙更好地提高缓释药物的缓释功能,在万古霉素的释放过程中,骨缺损部位感染情况被药物控制。有实验指出,将硫酸钙介导诱导膜技术应用,相比单一诱导膜修复、或单一植骨而言,能够产生较好的骨缺损修复效果。
3.2 硫酸钙诱导膜技术特点、临床运用优势及方法
运用诱导膜的技术原理,主要是以下几个步骤,首先通过硫酸钙填充骨缺损区,其次形成诱导膜,然后通过诱导膜释放的成骨因子以及诱导膜内的松质骨共同作用,加快骨缺损处的骨修复。在二期治疗过程中,在诱导膜内填充了松质骨,诱导膜具有丰富的血液供应,能分泌BMP-2、VEGF 等相关生长因子,发挥骨再生诱导的强大作用[3-4]。诱导膜作为隔离媒介,可以很好地阻断软组织、疤痕等长入骨缺损端,同时预防外部炎症介质进入,给骨缺损区营造一个良好的成骨环境,避免炎症和骨吸收的发生。因此诱导膜还具有机械性包裹隔离和辅助固定的作用[5],同时也对填充骨松质及缺损区起辅助稳定作用。操作细节注意:一期手术时清创应该彻底进行,彻底清除坏死及感染的软组织、坏死及感染的骨质,坏死骨质可通过放松止血带,钻孔了解骨端创面渗血情况确定。必要时可用冲洗器脉冲冲洗,并放置引流。相关实验研究表明,硫酸钙在骨缺损中起着重要作用[6-7],涉及感染的骨缺损一期硫酸钙填充时必须使用抗生素混合的硫酸钙。硫酸钙填充骨缺损区时,必需超出骨缺损两断端各1 ~2 cm,以保证衔接连续性好,术中同时还要估算硫酸钙填充量,避免过多切口关闭困难,过少支撑性不佳。手术关闭切口时必须要有血运良好的软组织覆盖创面,必要时行皮瓣修复覆盖。二期切开诱导膜取出硫酸钙填充物时必须小心保护,切不可破坏诱导膜。二期诱导膜内填充松质骨前必须打通双侧髓腔,自体松质骨首选,异体骨骨量不超过1∶3,注意诱导膜无创缝合关闭,于引流管诱导膜外留置。
在第一阶段的外固定、内固定应用过程中,应当确保固定的牢靠性,确保软组织能够良好生长,避免在活动过程中,硫酸钙对形成后的诱导膜造成破坏。如患者处于化疗、放疗过程中,或第一阶段手术20 ~60 d 后,患者骨缺损区域的感染情况仍未得到良好控制,应当将第二阶段手术的开始时间往后延长,确保患者身体条件、骨缺损局部情况能够允许开展手术。需保障骨缺损的骨断端健康及血管床良好,以保证进行第二阶段手术时,植入骨能够获得较好血运。骨缺损区域进行硫酸钙的填充、塑性时,应注意两边断端得到较好包裹,诱导膜囊内的空间较骨缺损大,以实现自体骨、骨断端之间的良好愈合。应先行计算骨缺损体积,并以此为依据,统计需应用的硫酸钙、万古霉素用量,调配正确的比例,避免硫酸钙内的万古霉素用量过多出现肾损伤,或用量过少难以实现有效杀菌。
在进行第二阶段的手术之前,应当保障诱导膜囊腔中的感染得到良好控制,或已消灭感染,术前2 个月应定期进行血沉、C 反应蛋白的检查,时间间隔为2 周,直至连续复查3 d 后,结果仍然正常。在第二阶段手术中,取出硫酸钙,将自体骨植入前,应将纤维膜两端、髓腔打通,在放置负压引流管过程中,为避免出现术后水肿,应正确放置引流管,将其放入诱导膜外软组织的间隙中,而非诱导膜内,防止诱导膜中出现成骨因子损失。进行自体骨的移植时,应当将囊膜腔内完全填满,避免留下死腔,降低术后感染的风险。在缝合诱导膜的过程中,应注重张力大小,避免太大导致诱导膜出现破裂。在进行骨缺损断端的固定时,应当固定牢靠,防止影响骨断端愈合,或出现骨连接不正的情况。使用的自体骨通常为松质骨,如患者的骨缺损范围较大,患者的松质骨难以支持用量时,可采用同种异体骨、皮质骨、人工骨植入,但应注意,替代骨的含量与松质骨相比,比例应低于1∶3,以防影响成骨效果。故而,应注意,松质骨仍为填充诱导膜囊腔的“金标准”,其大小应低于1 ~2 mm3[8]。
诱导膜技术为治疗大段骨缺损提供了较好的方式,该项术式的应用性、适应性较为广泛,手术操作较为简便,能够用在因创伤性感染、切除恶性骨肿瘤后出现的骨缺损,特别是对前者而言,这一方法具有强大的疗效。在传统的诱导膜技术的基础上,硫酸钙介导的诱导膜技术有着更大的优势,给广大骨缺损患者带来更大的福音。
