黄连水提物对人皮肤肿瘤A431细胞凋亡、增殖的影响
2019-09-07高耀星于建设都日娜杨丽敏赵鹏伟孙鹏
高耀星 于建设 都日娜 杨丽敏 赵鹏伟 孙鹏


[摘要] 目的 探討黄连水提物对人皮肤肿瘤A431细胞凋亡、增殖的影响。 方法 采用低温提取工艺,从药材中提取出水溶性的小分子混合物,用紫外色谱分析仪检测混合物成分;采用MTT法检测药物对人皮肤肿瘤A431细胞的抑制作用,药物设4个浓度,即6.3、12.5、25、50 μg/μL,并将其作为药物组,未加药物的为对照组,观察24、48、72 h抑瘤率;然后用Tunel检测细胞凋亡现象;通过MTT筛选后,用25 μg/μL黄连水提物作用肿瘤A431细胞48 h后,用Western blot 检测Caspase-3、Caspase-8、Caspase-9、Bcl-2凋亡途径的影响。 结果 紫外光谱分析黄连水提物主要成分为核酸、生物碱等,MTT显示25 μg/μL黄连水提取物在48 h对A431细胞的抑制率已达到最佳(P < 0.05)。显微镜下,对照组无变化。25 μg/μL黄连水提物孵育48 h后,细胞明显的数量减少、变圆、漂浮;Tunel显示25 μg/μL黄连水提物核定位处绿光明显增多,提示细胞大量凋亡。本研究检测显示,25 μg/μL黄连水提取物孵育48 h后,肿瘤A-431细胞中Caspase-3、Caspase-8、Caspase-9表达量显著升高,而Bcl-2的表达量显著降低。 结论 本研究初步表明黄连水提小分子混合物可促进A-431细胞凋亡,抑制细胞增殖。其机制包括细胞外凋亡通路和细胞内凋亡通路,导致肿瘤细胞中Caspase-3、Caspase-8、Caspase-9上调及抑制凋亡蛋白Bcl-2的下调。这进一步明确了黄连水提物在治疗皮肤肿瘤中的作用机制,为皮肤肿瘤的治疗提供的方法。
[关键词] 黄连水提物;皮肤肿瘤;A431细胞;细胞凋亡;Bcl-2;Caspase-3;Caspase-8;Caspase-9
[中图分类号] R739.5 [文献标识码] A [文章编号] 1673-7210(2019)06(a)-0021-05
Effects of water extract of berberine on apoptosis and proliferation of human skin tumor A431 cells
GAO Yaoxing1 YU Jianshe1 DU Rina2 YANG Limin2 ZHAO Pengwei3 SUN Peng3
1.Department of Anesthesiology, Affiliated Hospital of Inner Mongolia Medical University, Inner Mongolia Autonomous Region, Hohhot 010010, China; 2.Department of Dermatology, International Mongolian Medical Hospital of Inner Mongolia Autonomous Region, Inner Mongolia Autonomous Region, Hohhot 010010, China; 3.Inner Mongolia Medical University, Inner Mongolia Autonomous Region, Hohhot 010010, China
[Abstract] Objective To investigate the effect of water extract of berberine on apoptosis and proliferation of human skin tumor A431 cells. Methods The low temperature extraction process was used to extract the water-soluble small molecule mixture from the medicinal materials. MTT assay was used to detect the inhibitory effect of the drug on human skin tumor A431 cells. Four concentrations of 6.3, 12.5, 25, 50 μg/μL were set as the drug group, and those without the drug were set as the control group. The tumor inhibition rates at 24, 48 and 72 h were observed. Tunel was used to detect apoptosis. After being screened by MTT, the apoptosis pathways of caspase-3, caspase-8, caspase-9 and Bcl-2 were detected by Western blot after treating tumor A431 cells with 25 μg/μL water extract for 48 h. Results The main components were nucleic acid, alkaloid, etc. MTT showed that the inhibition rate of 25 μg/μL water extract of berberine on A431 cells reached the best at 48 h (P < 0.05). Under the microscope, there was no change in the control group. After incubated with 25 μg/μL water extract of berberine for 48 h, the number of cells significantly decreased, became round and floated. Tunel showed 25 μg/μL water extract of berberine significantly increased green light at the approved location, indicating a large number of apoptosis. In this study, after incubated with 25 μg/μL water extract of berberine for 48 h, and the expressions of caspase-3, caspase-8 and caspase-9 in tumor A431 cells were significantly increased, while the expression of Bcl-2 was significantly decreased. Conclusion This study preliminarily showed that the small molecule mixture of water extract from rhizoma coptiliae could promote apoptosis of A431 cells and inhibit cell proliferation. The mechanisms include the extracellular apoptosis pathway and the intracellular apoptosis pathway, leading to the up-regulation of caspase-3, caspase-8 and caspase-9 in tumor cells and the down-regulation of the apoptotic protein Bcl-2. This study further clarified the mechanism of wat extract of berberine in the treatment of skin tumors and provided methods for the treatment of skin tumors.
[Key words] Water extract of berberine; Skin tumor; A431 cells; Apoptosis; Bcl-2; Caspase-3; Caspase-8; Caspase-9
皮肤鳞状细胞癌、基底细胞癌是皮肤科常见的恶性肿瘤之一,占皮肤恶性肿瘤的70%左右,该肿瘤好发于老年人的曝光部位[1]。病因可能与日光照晒、大剂量X线照射、接触砷化物等有关系[2]。目前临床多采用手术切除及放化疗,辅以光动力疗法[3]治疗,效果不理想。手术治疗皮肤肿瘤会与面部术后恢复产生矛盾[4]。中草药属于天然产物,副作用较少,寻求有效的中草药用于恶性肿瘤的治疗已成为抗肿瘤治疗研究的焦点之一。
黄连为毛茛科植物黄连的干燥根茎,味苦、性寒,归心、脾、胃、肝、胆、大肠经。具有清热燥湿,泻火解毒的功效[5]。现代药理研究[6-7]表明,黄连不仅具有抗菌、抗病毒的功效,还具有利胆、抗肿瘤等药理作用,被广泛应用于各种病证的治疗,如抑制胃癌、食道癌、肺癌等,但无在皮肤科领域的应用。因此,本研究采用低温提取工艺方法,探讨黄连水提物对人皮肤肿瘤A431细胞系增殖率的影响及其作用机制,为传统中药的开发提供科学数据,为皮肤肿瘤提供新的治疗方案。
1 材料与方法
1.1 材料
黄连,购自安国药物批发市场(内蒙古医科大学中医药教授鉴定);A431细胞,购于ATCC细胞库;Caspase-3(CST,9662S)、Caspase-8(CST 4790S)、Caspase-9(CST 9504S)、Bcl-2(CST 2872S);兔抗人一抗(CST 4970S)、二抗辣根过氧化物酶羊抗兔(北京全式金生物技术有限公司HS101-01)、脱脂奶粉(BD 232100),PVDF膜(MILIPORE ISE Q00010),SDS-PAGE制胶试剂盒(上海碧云天生物技术有限公司,P0012A)、Tunel细胞凋亡检测试剂盒(北京全式金生物技术有限公司FA201-01)、ELC显色液(北京全式金生物技术有限公司DW101-01)。DMEM培养基(北京全式金生物技术有限公司FI101-01)、10%胎牛血清均购自Sigma公司。
1.2 仪器
紫外分光光度计U-3900(HITACHI),酶标仪Multiskan GO(Thermo);LEICA DM4000B LED荧光显微镜购于德国莱卡公司:低温冷冻干燥机(上海博迅实业有限公司医疗设备厂);二氧化碳培养箱(日本日立公司)。
1.3 方法
1.3.1 黄连水提物的制备
将1 kg鸡爪黄连用超速粉碎机粉碎,用1∶6的水溶液浸泡4 h,随后放于-30℃冰箱,冷冻24 h,解冻后,离心,取上清,用分子柱过滤,冷冻干燥后得干粉。
1.3.2 紫外光谱分析
水提物经紫外200~700 nm波长扫描,在260、340 nm有明显吸收峰。
1.3.3 提取物对A-431细胞的凋亡、增殖影响
1.3.3.1 将A-431细胞培养于含1%双抗10%胎牛血清的DMEM常规培养瓶中,放入37℃、5% CO2、饱和湿度的培养箱中培养,待细胞长满后,转接于96孔板中,每孔加入4×105/mL细胞悬液100 μL,培养12 h后,分组。未加药物的为对照组,黄连水提取物设4个剂量,均为药物组,每个剂量设3个复孔,剂量为6.3、12.5、25、50 μg/μL。分别培养24、48、72 h,然后分别在不同的时间段,加入10 μL的MTT继续培养4 h后,在490 nm处读OD值。计算细胞抑制率。
1.3.3.2 选取细胞抑制率最佳的25 μg/μL药物组,加药培养48 h后,用倒置显微镜观察药物作用的形态变化。经Tunel染色后,在倒置荧光显微镜下观察细胞凋亡的荧光现象。
1.3.3.3 用药物浓度为25 μg/孔的黄连水提物作用A431细胞,分别收集0、12、24 h和48 h细胞,检测Caspase-3、Caspase-8、Caspase-9、Bcl-2蛋白表達。
1.4 统计学方法
采用SPSS 16.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 紫外吸光光谱分析法分析黄连水提物成分
黄连水提物经紫外200~700 nm波长扫描,出现两个吸收峰:在260 nm有最高吸收峰值,为核酸物质,340 nm出现高吸收峰,为生物碱(图1)。
2.2 MTT检测黄连水提物对细胞抑制作用的最佳浓度和时间
采用不同浓度的黄连水提取物作用于A431细胞,于24、48 h和72 h检测细胞的增殖率。结果显示,随着作用时间的增加,在6.3 μg/μL的黄连水提物对细胞增殖的抑制率在24 h和48 h差异无统计学意义(P > 0.05),而72 h的抑制率显著高于24 h和48 h(P < 0.05),12.5 μg/μL的黄连水提物作用72 h的抑制率显著高于24 h和48 h(P < 0.05),而48 h的显著高于24 h的抑制率(P < 0.05)。25 μg/μL和50 μg/μL的黄连水提取物作用72 h和48 h的抑制率显著高于24 h(P < 0.05),而72 h和48 h的抑制率差异无统计学意义(P > 0.05)。随着作用浓度的增加细胞的抑制率逐渐升高,在48 h时达到最高,与72 h的最高值差异无统计学意义(P > 0.05)。提示25 μg/μL黄连水提取物作用48 h对A431细胞的抑制率已达到最佳。见表1。
2.3 细胞凋亡现象
2.3.1 光镜下的细胞形态现象
显微镜下,对照组细胞生长旺盛,分布稠密,形态饱满呈鹅卵石型。25 μg/μL黄连水提取物孵育48 h组,细胞分布稀疏,体积明显缩小,多数细胞呈圆形,凋亡细胞数量明显增加。见图2。
2.3.2 Tunel检测细胞凋亡的變化
Tunel显示25 μg/μL孵育48 h组核定位处较对照组绿光比蓝光比例明显增多,提示细胞核DNA产生大量断裂,3′-OH暴露,细胞大量凋亡。见图3(封四)。
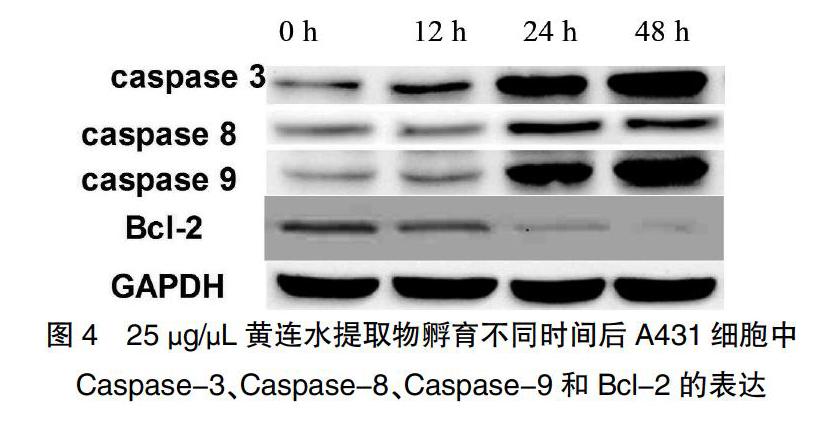
2.3.3 25 μg/μL黄连水提取物在不同时间点Caspase-3、Caspase-8、Caspase-9、Bcl-2表达比较
为了进一步研究黄连水取物对A431细胞凋亡的机制,本研究利用Western blot检测了Caspase-3、Caspase-8、Caspase-9和Bcl-2在25 μg/μL黄连水提取物孵育0、12、24 h和48 h后在蛋白水平的表达。提示Caspase-3、Caspase-8、Caspase-9在24 h和48 h的表达量显著升高(P < 0.05)。而Bcl-2在24 h和48 h的表达量则显著低于其他时间的表达量(P < 0.05)。用Western blot检测Caspase-3、Caspase-8、Caspase-9和Bcl-2在25 μg/μL黄连水提物孵育0、12、24 h和48 h后在蛋白水平的表达。见表2、图4。
3 讨论
天然植物提取物在肿瘤治疗和预防中起到积极作用,可以抑制肿瘤增殖和转移,减轻放化疗的不良反应,可改善人体抗肿瘤药物的耐药性,在治疗肿瘤中具有重要作用[8-9]。
黄连是一味具有广泛药效作用的中药,随着科技的进步,新的药效不断被发现,黄连的根茎均含多种异喹啉类生物碱[10],近年研究[11-12]表明盐酸小檗碱的较多,具有抗菌、抗病毒、利胆、抗肿瘤等药理作用。本研究发现,采用低温提法获取黄连水提取物,有效地保留了黄连水提物的有效成分,获取高纯度的浓缩提取物,可以使人皮肤肿瘤细胞A431细胞出现程度不同的凋亡,证明中草药黄连水提小分子提取物具有抑制皮肤肿瘤的作用,为皮肤肿瘤的治疗开发新的治疗方法,且表明在黄连中含有除小檗碱之外的其他抗肿瘤活性物质存在。严淑[13]运用体外抗肿瘤方法,发现黄连总碱对人胃癌细胞株BGC-823、MKN-45体外具有明显抑制增殖的作用。黄林清[14]发现黄连能具有抗食道癌的作用,这种作用与小桑碱调节肿瘤lL-6的产生水平是相关的。这提示黄连对肿瘤细胞有抑制作用。
细胞凋亡是指为维持内环境稳定。它涉及一系列基因的激活、表达及调控等作用[15],同时是受多种凋亡相关蛋白调控的复杂生化反应。凋亡相关蛋白的异常表达及功能改变与肿瘤的发生有关,是影响肿瘤治疗效果的重要因素[16-22]。本研究发现,黄连小分子水提物可以使外源性凋亡信号Caspase-8、内源性凋亡信号Caspase-9显著升高,并抑制Bcl-2的表达量,从而激活剪切后的Caspase-3凋亡效应蛋白,导致凋亡。中提示黄连水提小分子提取物能通过多渠道,多靶点调控细胞凋亡过程,抑制A431细胞增殖。本研究进一步明确了其在治疗皮肤肿瘤中的作用机制,扩大民族医药用途,为皮肤肿瘤的治疗提供了新的研究方向。
[参考文献]
[1] 郑瑞,桑洁玉,董志珊,等.皮肤基底细胞癌79例的临床与病理特征分析[J].山西医科大学学报,2014,45(6):487-488.
[2] 唐政.皮肤基底细胞癌发生的危险因素及其病理特征分析[J].实用癌症杂志,2016,31(6):921-923.
[3] 刘秀英,钱芳.5-氨基酮戊酸光动力治疗表浅基底细胞癌患者的疗效研究[J].实用癌症杂志,2015,30(4):500-502.
[4] 程定.基底细胞癌临床治疗现状[J].癌症进展,2011,9(1):77-80.
[5] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2015:285.
[6] 涂瑶生,江志强,孙冬梅,等.黄连生物碱提取及纯化工艺研究[J].中药新药与临床药理,2012,23(2):208-212.
[7] 李雪改,杨立国,陈丽霞,等.黄连水提液化学成分的分离与鉴定[J].沈阳药科大学学报,2012,29(3):193-198.
[8] 石静,梁勇刚.穿心莲内酯对人皮肤基底细胞癌A431细胞生长、凋亡及增殖细胞核抗原蛋白表达的影响[J].解剖学报,2013,44(1):73-78.
[9] 王海波,罗宏.内皮抑制素对皮肤基底细胞癌A431细胞株耐药基因的影响[J].中国麻风皮肤病杂志,2013,29(7):433-435.
[10] 吴唐维,宁勇,陈卫群.微RNA参与中药抗肿瘤作用的研究进展[J].重庆医学,2013,42(13):1536-1538.
[11] 王影,刘文娟,崔瑛.黄连现代研究进展[J].中医学报,2014,29(11):107-111.
[12] Iizuka N,Miyamoto K,Hazama S,et al. Anticachectic dffects of Coptidisrhizoma,an anti-inflammatory herb.on esophageal cacer cells that produce interleukin 6 [J]. Cancer Lett,2000,158(1):35.
[13] 严淑.五种天然有效部位生物总碱的提取分离及体外抗肿瘤作用研究[D].南京:南京中医药大学,2010.
[14] 黄林清.小桑碱抗肿瘤作用实驗研究[J].中国药理学通报,1997,13(12):189.
[15] 赵彦超,顾耘.细胞凋亡通路研究进展[J].现代医学,2013,41(4):285-288.
[16] Li G,Cai M,Fu D,et al. Heat shock protein 90B1 play an oncogenic role and is a Target of microRNA-223 in Human Osteosarcoma [J]. Cell Physiol Biochem,2012,30(6):1481-1490.
[17] D'Costa AM,Denning MF. A casppase- resistant mutant of PKC- delta protects keratinocytes friom UV- induced apoptosis [J]. Cell Death Differ,2005,12(3):224-232.
[18] Donepudi M,Mac Sweeney A,Briand C,et al. Inslghts into the regu-latory mechanism For caspase- 8 activation [J]. Mol Cell,2003,11:543-549.
[19] An Y,Matter M,Pai JT,et al. Amitochondrial Protein,Bitl,medi-ates apoptosis regulated by integrins and Groueho/TLE ceorePressors [J]. Cell,2004,116(5):751-762.
[20] Gómez-Fernández JC. Functions of the C-terminal domains of apoptosis-related proteins of the Bcl-2 family [J]. Chem Phys Lipids,2014,183(7):59-68.
[21] Tokar T,Ulicny J. The mathematical model of the Bcl-2 family mediated MOMP regulation can perform a non-trivial pattern recognition [J]. PLoS One,2013,8(12):81-86.
[22] Ding WX,Ni HM,Di Francesca D. Bid- dependent generation ofoxygen radicals promotes death receptor activation- induced apop-tosis in murine hepatocytes [J]. Hepatology,2004,40(2):403-413.
(收稿日期:2018-07-16 本文编辑:封 华)
