基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性
2019-09-06宁亚丽徐帅哲
宁亚丽,吴 跃*,何 嫱,徐帅哲,陈 艳
(中南林业科技大学食品科学与工程学院,稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
米酒作为我国一种传统发酵酒,通常以米类作物为原料,经微生物发酵酿制而成,其不仅风味独特,还富含丰富营养成分,具有特色食疗功能[1],在我国南方和北方一些地区非常盛行。近年来,朝鲜族米酒作为东北吉林延边朝鲜族的一种特色传统发酵米酒,因其米香浓郁,较南方米酒酸甜可口,口感醇和,类似饮料风味,深受男女老少喜爱,逐渐在我国流行。
我国米酒发展有悠久的历史,不同区域的米酒呈现出不同的风味和口感,其中具有代表性的传统米酒有孝感米酒、福建红曲米酒、信阳米酒、陕北米酒、朝鲜族米酒等。孝感米酒是湖北地区一种米酒,是以优质糯米为原料和传统凤窝酒曲发酵而成,其酒白如玉液,甜润可口;福建红曲米酒是由糯米和红米为原料,红曲为发酵剂酿造而成,以色红、味醇、香浓著称;信阳米酒由糯米为原料,利用小曲发酵而成,甘饴可口;陕北米酒主要由黄米或小米为原料,与当地酒曲发酵而成,呈黄色,口味略甜且带米酸味。而朝鲜族米酒是一种以粳米或糯米为主要原料,利用当地传统酒曲为发酵剂,经过浸米、熬煮(或蒸米)、糖化、发酵、过滤、调配等工序酿制而成,其乙醇体积分数为4%~6%[2],口感酸甜可口,但略偏酸,因其酒体为乳白色或微黄色,又被称为浊酒。其酒曲是以糯米粉和发芽玉米粉为原料,加水混合制成曲坯,自然接种环境中的微生物而成。
中国米酒文化源远流长,但关于朝鲜族米酒记录的文献很少。而与我国朝鲜族米酒相似的韩国米酒目前在世界范围内享受声誉,韩国对其米酒和酒曲Nuruk进行了大量研究,发现Nuruk酒曲中丝状真菌、酵母菌和细菌对韩国米酒的品质和风味起到至关重要的作用[3]。据报道,韩国米酒具有多种功能特性,包括抗癌、抗高血压、抗氧化,促进血液循环等功效[4-5]。而我国对朝鲜族米酒及其酒曲研究仅主要集中在其酿造及制曲工艺上[2,6],对米酒及其酒曲中微生物种类研究很少。高通量测序技术是目前研究微生物多样性中应用最广泛的测序技术,不仅能够快速地分析复杂微生物群落多样性,还能检测到低存在率及不可培养的微生物,现在该技术已经广泛应用于酸奶[7]、泡菜[8]、白酒[9]、醋[10]等生物群落结构研究,因此本研究采用高通量测序技术研究朝鲜族酒曲及其发酵后米酒中微生物群落多样性。
本研究以朝鲜族米酒及其酒曲为研究对象,采用Ilumina HiSeq和Illunina MiSeq高通量测序平台对细菌的16S rDNA V3区和真菌ITS1区进行测序,更全面地呈现朝鲜族米酒及其酒曲的微生物群落多样性,剖析各类微生物的结构比例,明确优势菌群;以此更好地提高朝鲜族米酒品质,推动其产业化发展,为现代化酿酒新工艺的建立提供理论依据,对推广民族特色发酵食品具有重要意义。
1 材料与方法
1.1 材料与试剂
米酒原料为东北粳米(珍珠米),产自黑龙江通河;酒曲为采集自吉林延边朝鲜族自治州家庭当年手工制作的新酒曲。
DNA提取试剂盒(DP328)、琼脂糖凝胶DNA回收试剂盒(DP208) 北京天根生物科技有限公司;强力土壤®DNA提取试剂盒 美国MOBIO公司;Taq酶、引物等 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
SHP-250生化培养箱 上海精宏实验设备有限公司;精密膜过滤器 烟台帝伯仕自酿机有限公司;C1000型聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc 2000型凝胶成像仪 美国Bio-Rad公司;水平电泳仪、电泳槽 北京市六一仪器厂;5427R型低温离心机 德国Eppendorf公司;SI-A256型涡旋机 美国Scientific Industries公司;MiSeq PE300测序仪、HiSeq 2500测序仪 美国Illuimina公司。
1.3 方法
1.3.1 样品制备及采集
参照文献[2]方法,结合当地工艺制备朝鲜族米酒。具体为:先将粳米浸润5~6 h,然后以质量比1∶5的米水比熬煮至粥状,摊冷冷却至室温,按大米质量的3%加曲拌匀后,入罐密封发酵,温度32 ℃,发酵3 d,得米白色酒醪,于4 ℃冷藏3 d,过80 目筛进行粗滤得米酒样品CL;在此基础上,为使颜色更澄清,采用滤芯膜为0.22 μm精密膜过滤器精滤得米酒样品JL。工艺流程如下:

1.3.2 样品总DNA提取
将酒曲用研钵粉碎,用五分法取3 份平行样品,分别编号JQ1、JQ2、JQ3;每种形式米酒分别取两份平行,粗滤形式米酒编号为CL1、CL2,精滤形式米酒编号为JL1、JL2。分别称取酒曲和2 种形式米酒样品各200 mg,分别用DNA提取试剂盒和强力土壤®DNA提取试剂盒对样品中细菌、真菌DNA进行提取,提取方案按试剂盒说明书进行。
1.3.3 PCR扩增及测序
对细菌16S rDNA的V3可变区和真菌的ITS1可变区进行扩增,具体引物见表1。
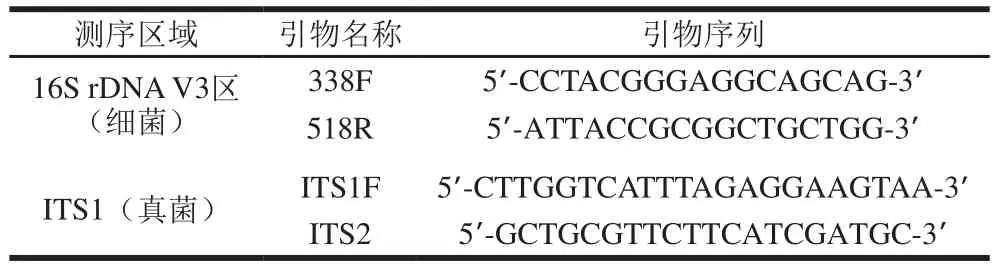
表1 细菌、真菌的PCR扩增引物设计Table1 1 Primers used for PCR amplification of bacterial 16S rDNA V3 variable region and fungal ITS1 variable region
细菌PCR体系(50 μL):10×Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,DNA模板 2 μL,Taq酶0.25 μL,引物338F 2 μL,引物518R 2 μL,用dd H2O补至50 μL;反应条件:94 ℃预变性5 min,94 ℃变性1 min,48 ℃退火1 min,72 ℃延伸1 min(30 次循环),最后72 ℃延伸10 min。
真菌巢式第1轮P C R体系(5 0 μ L):10×Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,DNA模板2 μL,Taq酶0.25 μL,引物ITS1F 2 μL,引物ITS2 2 μL,用dd H2O补至50 μL;反应条件:94 ℃预变性2 min,94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸1.5 min(35 次循环),最后72 ℃保温10 min。真菌巢式第2轮PCR体系(50 μL):10×Buffer 5 μL,2.5 mmol/L dNTPs 4 μL,DNA模板36.75 μL,Taq酶1 μL,引物ITS1F 2 μL,引物ITS2 2 μL;反应条件:94 ℃预变性10 min,94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸1 min(5 次循环),最后72 ℃保温10 min。
PCR产物用1.0%琼脂糖凝胶电泳检测,并使用琼脂糖凝胶DNA回收试剂盒(DP208)PCR纯化产物,建库并于Illumina MiSeq和Illumina HiSeq测序平台上机分别对样品中的细菌和真菌序列测序,测序工作委托北京理化分析测试中心完成。
1.4 数据处理
根据Barcode将下机数据,拆分成不同样品,去除Barcode序列和PCR扩增引物序列。使用FLASH(version 1.2.7)软件,通过Overlap对每个样品的reads进行拼接,得到原始Tags数据(Raw Tags),再使用Trimmomatic (version 0.33)软件,对原始Tags数据进行过滤,得到高质量的Tags数据(Clean Tags),最后使用UCHME v4.2软件,鉴定并去除嵌合体,得到最终有效数据(Effective Tags)。
将最终有效数据用QIIME(version 1.8.0)软件中的UCLUS在97%的相似度水平下进行可操作分类单元(operational taxonomic units,OTU)聚类,利用Mothur(version v.1.30)软件对样品的α-多样性进行评估,并基于细菌Silva和真菌UNITE分类学数据库对OTU进行分类学注释,生成不同分类水平上的物种丰度表,再利用Excel和Origin分别绘制样品各分类学水平下的群落结构图、主成分分析图。
2 结果与分析
2.1 α-多样性分析
α-多样性反映了单个样品内部物种的多样性,根据97%相似性水平下的OTU信息,采用α-多样性指标的覆盖率、Chao指数、Shannon指数对样品微生物物种的丰富度和多样性进行评估。

表2 α-多样性指数Table 2 Microbial α-diversity index of samples
每个样品的覆盖率、Chao指数和Shannon指数分别用于评估物种的测序深度、丰度和多样性。覆盖率反映了样本的真实情况,该指数越高,则样本中序列未被测出的概率越低;Chao指数是群落丰度指数,Chao指数越大,表明样品微生物群落丰度越高;Shannon指数是群落分布多样性指数,Shannon指数越大,表明样品微生物多样性越高;OTU数量亦可以代表样品物种的丰度。由表2可知,酒曲与2 种形式米酒中微生物覆盖率都大于0.9,说明样品文库中序列基本上都被测出,即样本测序结果可以反映样品的真实情况。就细菌而言,酒曲样品中细菌平均Chao指数与米酒样品差异不大,但酒曲样品中OTU数量明显高于2 种米酒样品,说明酒曲中细菌群落丰度比米酒高。酒曲样品中细菌Shannon指数也明显高于2 种米酒样品,说明酒曲中细菌群落多样性高于粗滤和精滤米酒,同时精滤米酒中细菌群落多样性较粗滤米酒略有降低。就真菌而言,根据Chao指数和Shannon指数可知,酒曲样品中真菌群落丰度低于2 种米酒,而多样性高于2 种米酒;同时,精滤米酒中真菌群落多样性明显低于粗滤米酒。
从α-多样性指数可以得出,酒曲和米酒样品中细菌物种丰度显著高于真菌,但在米酒产品中,真菌丰度大幅增加,可能是由于发酵后的米酒中的优势菌群为霉菌和酵母;米酒的精滤工艺对微生物群落均有一定影响,但对真菌微生物群落影响较明显,可能是由于真菌形态较大,易被过滤掉。
2.2 酒曲与米酒间细菌群落结构差异性分析
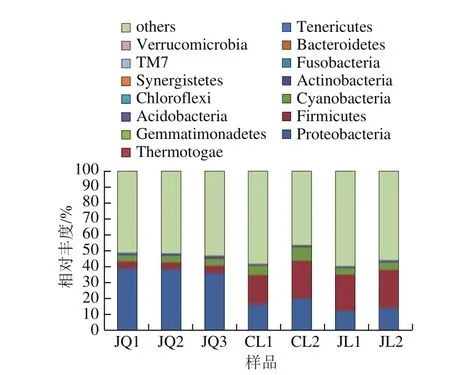
图1 门水平下酒曲与米酒样品中细菌群落结构分布图Fig. 1 Distribution of bacterial communities in the starter culture and rice wines at the phylum level
在门水平下,酒曲和米酒样品一共鉴定出25 个细菌物种,图1显示丰度水平前14的物种,其他物种合并为others。由图1可知,酒曲中主要细菌优势菌门分别为:平均相对丰度为37.68%的变形菌门(Proteobacteria)、4.58%的厚壁菌门(Firmicutes)、4.28%的蓝藻菌门(Cyanobacteria)和4.20%的放线菌门(Actinobacteria);2 种米酒样品中细菌主要优势菌群与酒曲相同,但是相对丰度差异较大,即粗滤米酒这4 种菌门的平均相对丰度分别为18.14%、21.17%、5.15%、1.24%,精滤米酒平均相对丰度分别为13.26%、23.28%、4.37%、1.08%。说明在门水平下,酒曲中细菌群落结构组成与2 种米酒相同,仅组成比例存在一定差异,而2 种形式米酒间细菌群落结构组成及其比例均相似,即精滤工艺对米酒中门水平下细菌群落结构无明显影响。在酒曲样品中,变形菌门为绝对优势菌群,而2 种米酒的绝对优势菌群为厚壁菌门,这可能是由于变形菌门的一部分细菌为好氧型,不能适应米酒发酵过程中缺氧、产酸、产醇的环境,因而丰度降低;而厚壁菌门中的乳杆菌和乳球菌大多数为厌氧细菌,能够产酸且在高酸环境下生长[11],因而其丰度在米酒产品中增加。本研究酒曲中蓝藻菌门平均相对丰度为4.28%,可能来源酒曲原料中植物中的叶绿体。
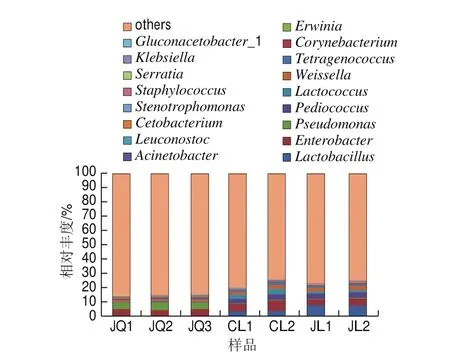
图2 属水平下酒曲与米酒样品中细菌群落结构分布图Fig. 2 Distribution of bacterial communities in the starter culture and rice wines at the genus level
在属水平下,酒曲和米酒样品中一共检测出147 个细菌物种,图2显示丰度前17的物种,其他物种合并为others。由图2可知,酒曲中主要细菌分别为平均丰度5.00%的假单胞菌属(Pseudomonas)、4.28%的肠杆菌属(Enterobacter)、1.21%的魏斯氏菌属(Weissella)、1.11%的棒状杆菌属(Corynebacterium)、0.53%的欧文氏菌属(Erwinia)和0.47%的不动杆菌属(Acinetobacter)。2 种米酒中主要细菌均为乳杆菌属(Lactobacillus)、肠杆菌属、片球菌属(Pediococcus)、乳球菌属(Lactococcus)、魏斯氏菌属、球菌属(Tetragenococcus)、棒状杆菌属,其中粗滤米酒中这7 类菌群的平均相对丰度分别为3.72%、6.31%、3.38%、3.44%、2.25%、1.39%、0.68%,精滤米酒中相对丰度为7.73%、4.41%、3.73%、1.66%、2.71%、1.08%、0.90%。说明酒曲与米酒样品中属水平下细菌群落结构差异较大;而2 种米酒间细菌菌群组成相似,只是丰度有所差异。肠杆菌属和假单胞菌属是酒曲样品中的优势菌群,而隶属于乳酸菌的乳杆菌属、片球菌属、乳球菌属、魏斯氏菌在米酒样品中大幅增加,成为米酒样品的优势菌。这与韩国米酒中发现乳杆菌属细菌在米酒发酵阶段逐渐成为优势菌结果一致[12]。乳酸菌在米酒发酵过程中能利用发酵糖类产生乳酸等,降低米酒中的pH值,并且乳酸与乙醇发生反应生成酯类是米酒重要的风味物质,同时乳酸菌代谢过程中产生乙酰和双乙酰,赋予米酒特色风味[13-14]。另外乳酸菌能生成具有抗菌作用的细菌素[15],这对抑制米酒中致病、致腐菌具有重要意义。肠杆菌属一般为非条件致病菌或条件致病菌,部分为人体肠道内正常微生物,能利用糖酵解和戊糖磷酸途径对糖进行降解产生有机酸[16],该属细菌在酒曲和精滤米酒样品中丰度差异不大,但在粗滤米酒中丰度增加。而假单胞菌属多为条件致病菌,且为严格好氧菌[17],该属细菌几乎不能在酸性、缺氧的条件下生长,因而在米酒产品中比例大幅下降。
本研究通过高通量测序技术研究朝鲜族米酒及其酒曲中细菌群落结构发现,酒曲中优势细菌主要为假单胞菌属和肠杆菌属,其米酒中优势细菌主要为乳杆菌属、肠杆菌属。Lü Xucong等[18]用PCR-DGGE对红曲糯米酒的酒曲微生物群落进行分析,表明其主要细菌为芽孢杆菌和乳酸菌,如人参土芽孢杆菌(Bacillus ginsengihumi)、巨大芽孢杆菌(Bacillus megaterium)、类肠膜魏斯氏菌(Weissella paramesenteroides)、戊糖片球菌(Pediococcus pentosaceus)。Song等[3]收集韩国各地区42 份Nuruk酒曲分析微生物群落,发现在所有的酒曲中主要的优势菌是芽孢杆菌属(Bacillus),如解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)。芽孢杆菌属具有很高的α-淀粉酶和糖化酶活性[19],对米酒糖化有利,而本研究不论是在酒曲中还是在米酒中,都未发现芽孢杆菌。可能是由于酒曲原料和制作工艺的不同,导致了酒曲中微生物群落结构有所不同。Cai Haiying等[20]研究孝感米酒微生物群落发现,其主要优势菌为芽孢杆菌属、魏斯氏菌属和乳杆菌属,其中乳杆菌属也是本研究2 种朝鲜族米酒中的优势菌。本研究在米酒和酒曲中发现肠杆菌属,该类菌属中有一部分细菌产酸,在米酒发酵过程中,乳杆菌属和肠杆菌属可能会共同产酸,因而导致了朝鲜族米酒酸味口感突出。
2.3 酒曲与米酒间真菌群落结构差异性分析

图3 门水平下酒曲与米酒样品中真菌群落结构分布图Fig. 3 Distribution of fungal communities in the starter culture and rice wines at the phylum level
在门水平下,从酒曲和米酒样品中一共鉴定出5 个真菌物种,但酒曲中有0.16%、米酒中有1.12%为未被鉴定出物种和酒曲中0.06%、米酒中0.15%比例为未知物种。由图3可知,酒曲和米酒门水平下真菌群落均主要是子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉亚门(Mucoromycota)。酒曲和米酒中绝对优势菌群均为子囊菌门,二者中的相对平均丰度分别为85.9%、98%。子囊菌门的真菌群落在米酒产品中丰度大幅增加并占有绝对主导,说明其在米酒发酵中起重要作用。而担子菌门相对丰度由酒曲中15.31%降低至米酒中0.18%,表明担子菌门真菌群落可能在低氧、酸性、高醇的环境下难以生存。毛霉亚门真菌群落的相对丰度由酒曲中2.3%增加至粗滤米酒中5.3%,而在精滤米酒中显著降低至0.7%,这可能是由于毛霉在米酒发酵过程中有一定的糖化力[21],而又由于毛霉菌丝体较大,不能通过精滤设备的0.22 μm的筛孔,因此,粗滤米酒中其丰度增加,而精滤米酒中降低。
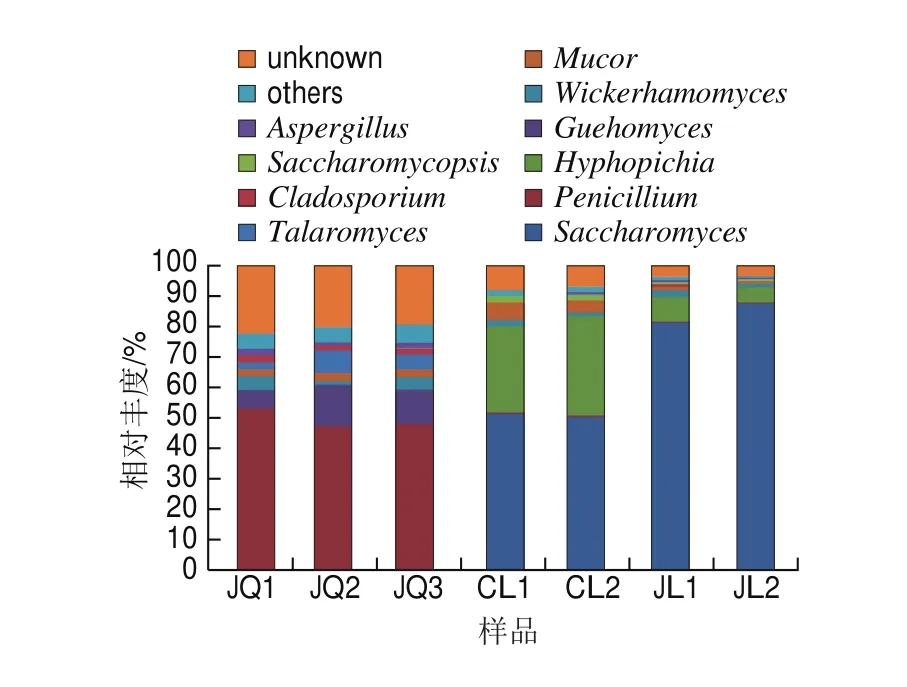
图4 属水平下酒曲与米酒样品中真菌群落结构分布图Fig. 4 Distribution of fungal communities in the starter culture and rice wines at the genus level
在属水平下,从酒曲和米酒中一共鉴定出12 个真菌物种,图4显示丰度前10的物种,但酒曲中有1.28%、米酒中有5.23%为未被鉴定出物种和酒曲中5.88%、米酒中20.85%为未知物种。如图4所示,酒曲中真菌群落与米酒中存在较大差异,米酒间真菌群落组成相似,但丰度有所差异。酒曲中优势菌属是青霉菌属(Penicillium)和兰久浩酵母属(Guehomyces),平均相对丰度分别为49.45%、10.28%;粗滤米酒样品中优势菌属为酵母属(Saccharomyces)和丝孢毕赤氏酵母属(Hyphopichia),相对丰度分别为50.93%、30.15%;精滤米酒中,真菌群落比例发生一定变化,优势菌属亦为酵母属和丝孢毕赤酵母属,丰度分别增至84.12%、降至6.47%。青霉具有很强产葡萄糖淀粉酶能力,对大米淀粉具有重要水解作用[22],但随着发酵时间延长,米酒体系中有机酸和醇不断积累,破坏青霉的生长环境,因而其比例在米酒样品中大幅降低。目前,在其他酒曲和米酒中较少发现有报道兰久浩酵母属,Bhadra等[23]研究发现兰久浩酵母属能够在用于乙醇发酵的含糖基质上生长。酵母属具有较强的发酵能力、高产乙醇能力,乙醇耐受性强,是白酒酿造过程中最主要的功能菌株[24-25],因此其含量在米酒样品中持续增加,一跃成为米酒中的优势菌。丝孢毕赤酵母属是发酵饮料中常见的产香酵母,对米酒有增香作用[26],但有可能该类酵母菌体大,不能通过0.22 μm筛孔的精滤设备,因而其比例在粗滤米酒中增加,精滤米酒中降低。
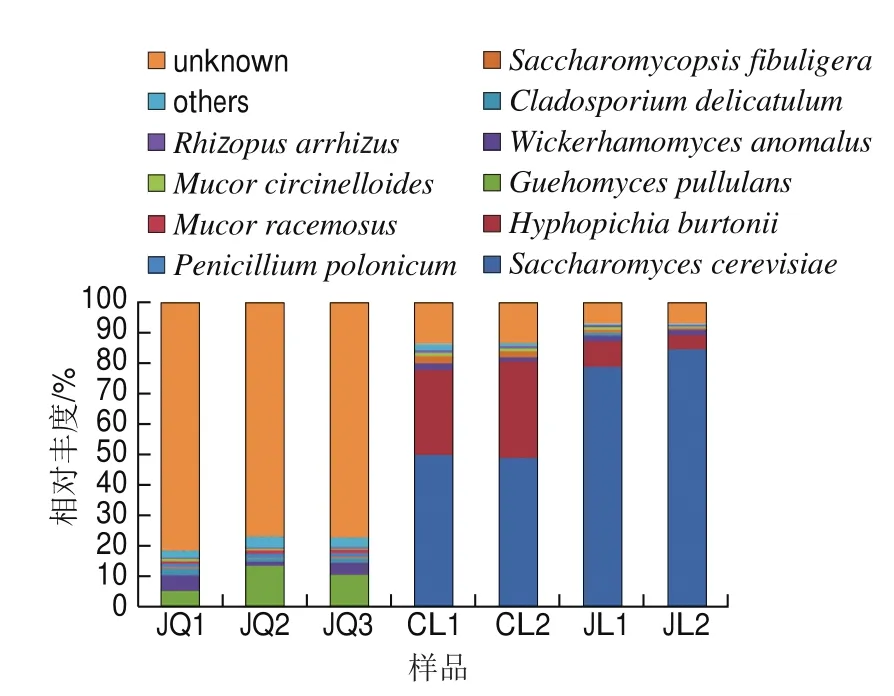
图5 种水平下酒曲与米酒样品真菌群落结构分布Fig. 5 Distribution of fungal communities in the starter culture and rice wines at the species level
在种水平下,酒曲和米酒中一共鉴定出12 个物种,图5显示丰度前10的物种,但酒曲中有0.99%、米酒中有3.01%比例合并为others,酒曲中10.52%、米酒中78.21%比例为未知物种。由图5可知,酒曲中主要真菌为:平均相对丰度为10.22%的普鲁兰久浩酵母(Guehomyces pullulans)、3.41%的异常威克汉姆酵母(Wickerhamomyces anomalus)、1.56%的枝孢霉(Cladosporium delicatulum)、1.16%总状毛霉(Mucor racemosus)、1.15%波兰青霉(Penicillium polonicum)等。普鲁兰久浩酵母属于耐冷酵母,在低温下有高活性,是一种能高产乳糖酶的菌株[27],目前在东北的酸汤子玉米面团[28]和黏豆包[29]中有发现,因此,可以推断出该菌株为东北地区特色菌种;并有研究表明普鲁兰久浩酵母能够在用于乙醇发酵的含糖基质上生长,说明普鲁兰久浩酵母在米酒发酵过程中产醇[23]。异常威克汉姆酵母是一种产香酵母,具有较高的产3-甲基-1-丁醇能力[30],对米酒的风味有很好的贡献作用。另外,枝孢霉是一种植物中的内生真菌,推测可能来源于制作酒曲的各种植物原料中;总状毛霉具有产淀粉酶和脂肪酶的能力[31],对糖化有利;波兰青霉通常在谷物、玉米、肉制品中都存在,本酒曲中的波兰青霉可能来源于酒曲原料的发芽玉米粉和糯米粉。米酒中主要真菌为酿酒酵母(Saccharomyces cerevisiae)、伯顿丝孢毕赤酵母(Hyphopichia burtonii)、异常威克汉姆酵母、卷枝毛霉(Mucor circinelloides)、扣囊复膜酵母(Saccharomycopsis fibuligera)和少根根霉(Rhizopus arrhizus)等。其中,粗滤米酒中酿酒酵母平均相对丰度为49.48%、伯顿丝孢毕赤酵母为29.47%,精滤米酒中其相对丰度分别为81.52%、6.43%。酿酒酵母是酿酒过程主要的功能菌株[25,32],有很强的发酵能力,高产乙醇,因此在米酒中比例持续增加;伯顿丝孢毕赤酵母是酿酒过程中的产香酵母,具有较强的产乙酸乙酯、乙酸异戊酯和苯乙醇能力[24],能够赋予米酒浓郁的花香味。此外,卷枝毛霉在我国甜酒曲以及韩国酒曲Nuruk中均有发现[3,33],其可以在菌丝内积累大量具有治疗心血管疾病、降低胆固醇等功能的脂肪酸[34]。米酒中扣囊复膜酵母也是产香酵母,具有良好的产乙酸乙酯、乙酸异戊酯、苯乙醇、乙酸苯乙酯等风味物质能力[26],能够赋予米酒果香味;少根根霉具有较高的淀粉酶活力,并能产生脂肪酶[35],能够有效地分解大米中淀粉和脂肪。
研究朝鲜族米酒及其酒曲中微生物群落发现,酒曲中优势菌主要为青霉菌属和兰久浩酵母属,其米酒中优势菌主要为酵母属和丝孢毕赤氏酵母属。与本研究不同,Ponnusamy等[36]研究韩国米酒Nuruk酒曲制备过程中微生物群落,表明米曲霉(Aspergillus oryzae)是其主要真菌。Park等[37]报道,红曲米酒发酵前期主要优势菌为米根霉(Rhizopus Oryzae)、季也蒙毕赤酵母(Pichia guilliermondii),后期为酿酒酵母,该结果与本研究结果类似,说明在米酒发酵后期,酿酒酵母是优势菌,且在产品中起着至关重要的作用。而研究孝感米酒中真菌群落发现,其优势菌主要为根霉菌属(Rhizopus)、曲霉菌属(Aspergillus)、酵母属[20];与之不同,本研究的朝鲜族米酒中少量存在根霉菌属,不存在曲霉菌属。Lü Xucong等[38]从10 份红曲米酒酒曲中分离鉴定丝状真菌,发现米根霉、米曲霉、黄曲霉(Aspergillus flavus)很强的α-淀粉酶或糖化酶活性,这表明曲霉属和根霉属在米酒发酵过程中能够有效地分解淀粉,增加小分子糖的含量,因而使米酒含糖量高且口感偏甜。而朝鲜族米酒中根霉含量少,曲霉不存在,使米酒在发酵过程中淀粉降解程度偏低,因而酸味口感突出。
2.4 酒曲与米酒间微生物群落相似性分析
主成分分析可以直观地将样品间相似或差异程度体现在二维坐标图上,距离越近则表示越相似。如图6所示,主成分1和主成分2分别解释了酒曲与米酒样品中细菌群落95.61%和3.83%的信息,两主成分之和大于80%,则表明两个成分较好地代表了样品中的细菌群落信息。3 份酒曲平行样品距离米酒样品有一定距离,说明酒曲中细菌群落与米酒有一定差异;相比之下,2 种米酒间样品距离较近,差异不大,说明米酒间的细菌群落相似性高,这与细菌群落结构差异性分析一致。由图7可知,真菌群落主成分析的两个主成分分别解释了酒曲与米酒中真菌群落90.81%和7.47%的信息,也较好地代表了样品中真菌群落信息,说明酒曲中真菌群落与米酒样品中存在一定差异,米酒间真菌群落相似性要低于细菌群落,说明精滤工艺对米酒中真菌群落影响较大。
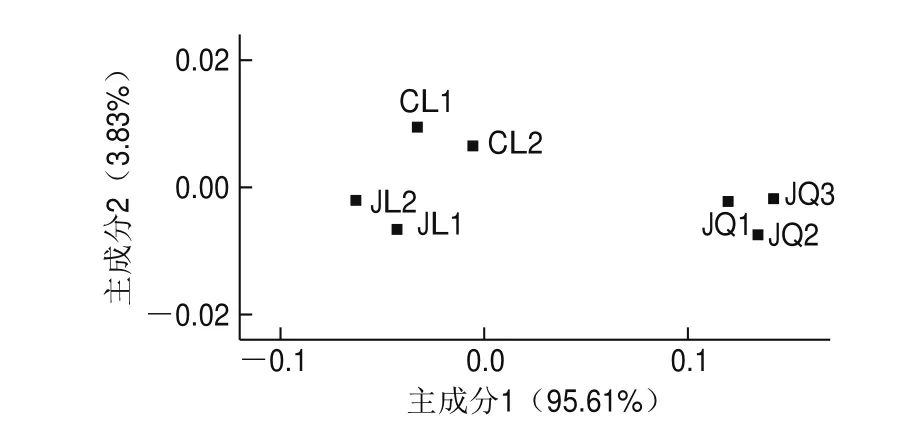
图6 酒曲与米酒样品中细菌群落主成分分析图Fig. 6 Principal coordinate analysis of bacterial communities in the starter culture and rice wines
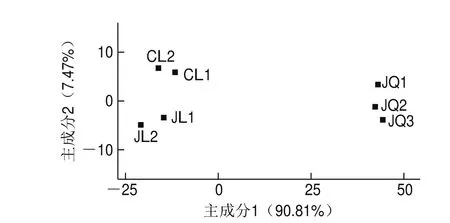
图7 酒曲与米酒样品真菌群落主成分分析图Fig. 7 Principal coordinate analysis of fungal communities in the starter culture and rice wines
3 结 论
本研究通过高通量测序技术对朝鲜族传统米酒及其酒曲中微生物多样性进行分析,对其中优势菌群组成进行研究,结果发现,朝鲜族米酒中主要优势菌为乳杆菌属、肠杆菌属、酵母属和丝孢毕赤氏酵母属;而酒曲中主要优势菌为假单胞菌属、肠杆菌属、青霉菌属和兰久浩酵母属,这表明,朝鲜族米酒与其他种类米酒及其酒曲中微生物菌群存在显著差异。研究还表明,精滤工艺对米酒的微生物群落结构影响不大,但对微生物丰度有一定的影响。该结果能够为日后深入研究朝鲜族米酒及酒曲微生物提供借鉴与参考,也能为进一步开发品质安全、风味优良的朝鲜族米酒提供理论支持。
