高效液相色谱法测定东北农家酱中的5 种生物胺
2019-09-06马艺荧解双瑜李天一
郝 宇,孙 波*,张 宇,马艺荧,解双瑜,李天一
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
生物胺是一类具有生物活性的含氮有机小分子化合物,包括组胺、酪胺、尸胺、腐胺、色胺、胍丁胺、精胺、亚精胺等,其广泛存在于生物体及多种食品中,如酒类[1-2]、水产品[3-4]、肉类[5-6]、发酵食品[7-8]、乳制品[9-10]等。生物胺是生物活性细胞不可缺少组分之一,是机体中生物碱、核苷酸、蛋白质和荷尔蒙等物质合成的前体物质[11]。适量的生物胺对人体有益,但是当人体摄入过量的外源性生物胺时,会引起诸如头痛、恶心、心悸、血压变化、呼吸紊乱等过敏反应,严重的还会危及生命[12]。
食品中生物胺的存在有3 个必要条件,首先是具有氨基酸脱羧酶活性的微生物的存在,其次是具有合成生物胺的前体物质——游离氨基酸的存在,最后是有适合微生物生长繁殖的环境条件。故在富含蛋白质和游离氨基酸的食品或在其制作过程中有微生物参与的发酵食品中则更容易积累生物胺。发酵豆制品就是一类极易积累生物胺的食品,在酱油[13]、豆豉[14]、腐乳[15]等发酵豆制品中的生物胺含量和种类均有研究报道,但在具有地域特色的东北农家酱中的生物胺种类和含量鲜见报道。东北农家酱是我国北方特有的传统发酵食品,其以大豆为原料,依靠环境中的米曲霉、酵母菌、乳酸菌等微生物[16]自然发酵而成。其生产环境开放,微生物区系复杂,这一特点使得东北农家酱中存在生物胺含量积累的可能性,故检测东北农家酱中生物胺的种类和含量变得尤为重要。
目前,食品中生物胺的检测和分析方法主要包括毛细管电泳法[17]、生物传感器法[18]、薄层色谱法[19]、气相色谱法[20]、离子色谱法[21]和反相高效液相色谱法[22],其中高效液相色谱法是定量分析生物胺的主要检测方法,具有检测灵敏度高、线性关系良好、分析定量准确等优点,是目前较理想的检测方法。而东北农家酱因其成分复杂,含有较多的蛋白质和油脂,使其前处理和定量检测受到了一定限制。因此,本实验对东北农家酱中生物胺处理条件:提取剂的选择、衍生剂用量的使用和衍生物萃取剂的选择进行研究,从而建立一种适合测定东北农家酱生物胺含量的高效液相色谱法,并使用建立的方法测定市售东北农家酱中的5 种生物胺,该方法稳定性和重复性良好,准确度和灵敏度高,可为东北农家酱的质量安全控制提供可靠依据。
1 材料与方法
1.1 材料与试剂
东北农家酱 市售。
标准品:组胺盐酸盐(CAS号:56-92-8,98%)、酪胺盐酸盐(CAS号:60-19-5,98%)、腐胺盐酸盐(CAS号:333-94-7,98%)、亚精胺(CAS号:124-20-9,97%)、β-苯乙胺(CAS号:64-04-0,98%) 上海士锋生物科技有限公司;丹磺酰氯(CAS号:605-65-2,99%) 美国Sigma公司;甲醇、丙酮(均为色谱纯);三氯乙酸、正己烷、三氯甲烷、乙酸乙酯、乙醚、谷氨酸钠、碳酸氢钠、氯化钠、盐酸均为分析纯。
1.2 仪器与设备
高效液相色谱仪(配2487紫外检测器、Empower工作站) 美国Waters公司;LG10-2.4A高速离心机北京医用离心机厂;ZGDCY-24孔水浴氮吹仪 上海梓桂仪器有限公司;HWS-24电热恒温水浴锅 上海齐欣科学仪器有限公司;FA2004分析天平 上海衡平仪器仪表厂;SZ-1型快速混匀器 江苏金坛市金城国胜实验仪器厂。
1.3 方法
1.3.1 标准溶液的配制
组胺盐酸盐、酪胺盐酸盐、腐胺盐酸盐、亚精胺、β-苯乙胺分别称取16.91、12.89、18.67、10.31、10.20 mg,用0.1 mol/L HCl溶液配制质量浓度为1 000 mg/L的生物胺标准储备溶液,4 ℃贮存备用。分别取上述溶液,用0.1 mol/L HCl溶液稀释,充分混匀,配制成质量浓度为100 mg/L的生物胺标准混合使用液。
1.3.2 样品预处理
准确称取东北农家酱10.0 g,加入10 mL 5%的三氯乙酸溶液,混匀,振荡提取30 min,6 000 r/min离心10 min,转移上清液至25 mL容量瓶中,残渣用10 mL 5%三氯乙酸溶液再提取一次,合并上清液,用5%三氯乙酸稀释至刻度,待净化。移取上述试样提取液5 mL于25 mL具塞试管中,加入0.5 g氯化钠涡旋振荡至氯化钠完全溶解后加入5 mL正己烷,涡旋振荡5 min,静置分层后弃去上层有机相,下层试样溶液加入5 mL正己烷再除脂一次,过滤,待衍生。
1.3.3 样品衍生化
在1.3.2节待衍生的试样溶液中依次加入1 mL饱和碳酸氢钠溶液、100 μL氢氧化钠溶液(1 mol/L)、0.8 mL丹磺酰氯溶液(10 mg/mL,溶剂为丙酮),涡旋混匀1 min后置于60 ℃恒温水浴中衍生15 min,取出,分别加入100 μL谷氨酸钠溶液,振荡混匀,60 ℃恒温反应15 min。取出,冷却至室温,于每个离心管中加入1 mL水,涡旋混合1 min,40 ℃水浴下氮吹除去丙酮,加入0.5 g氯化钠涡旋振荡至氯化钠完全溶解后加入3 mL乙酸乙酯,涡旋振荡2 min,静置分层后,吸出上层有机相,再萃取一次,合并乙酸乙酯萃取液,40 ℃水浴下氮气吹干。加入1 mL甲醇涡旋振荡使残留物完全溶解,0.22 μm滤膜针头滤器过滤于进样小瓶,待测定。
1.3.4 标准曲线的建立
分别取生物胺标准混合使用液,用0.1 mol/L HCl溶液稀释,配制成质量浓度为1.0、2.5、5.0、10.0、15.0、25.0、50.0 mg/L的生物胺标准系列溶液。分别移取1 mL生物胺标准系列溶液,操作同样品的衍生步骤并进行检测,每个质量浓度重复3 次,计算平均值。
1.3.5 色谱条件
色谱柱:C18(250 mm×4.6 mm,5 μm);检测波长:254 mm;流动相A:甲醇,流动相B:超纯水;采用梯度洗脱,经实验调整,最终确定本研究最佳洗脱程序见表1。流速:0.8 mL/min;柱温:30 ℃;进样量:10 μL。

表1 梯度洗脱程序Table 1 Gradient elution program
1.4 数据处理
采用Origin 8.0、SPSS 21.0软件进行数据统计分析。每组平行3 次,测定结果以平均值表示。
2 结果与分析
2.1 提取剂的选择

表2 3 种溶剂提取东北农家酱中不同添加量的5 种生物胺的RSD(n=3)Table 2 RSDs for 5 biogenic amines at 5.0, 10.0 and 15.0 mg/L (n= 3)
东北农家酱中含有蛋白质、脂肪、游离氨基酸及其他复杂成分,这些成分的存在影响生物胺的有效分离和准确定量。故合适的前处理方法,可以降低杂质含量,降低干扰,得到较高的回收率,提高灵敏度。常见的提取剂有酸性介质和有机介质。对于肉类、水产品及植物性食品中生物胺的提取一般以盐酸[23]、高氯酸[24]、三氯乙酸[25]等酸性介质提取,但5%三氯乙酸在这类样品中沉淀蛋白效果好于盐酸;而在奶酪中盐酸对生物胺的提取效果较好[26]。提取剂种类的选择与所分析的样品基质特性有关,故本研究选取0.1 mol/L盐酸、5%三氯乙酸和无水乙醇进行对比,在5.0、10.0、15.0 mg/L三种不同添加水平下对东北农家酱中的5 种生物胺进行提取,实验结果见表2、图1~3。
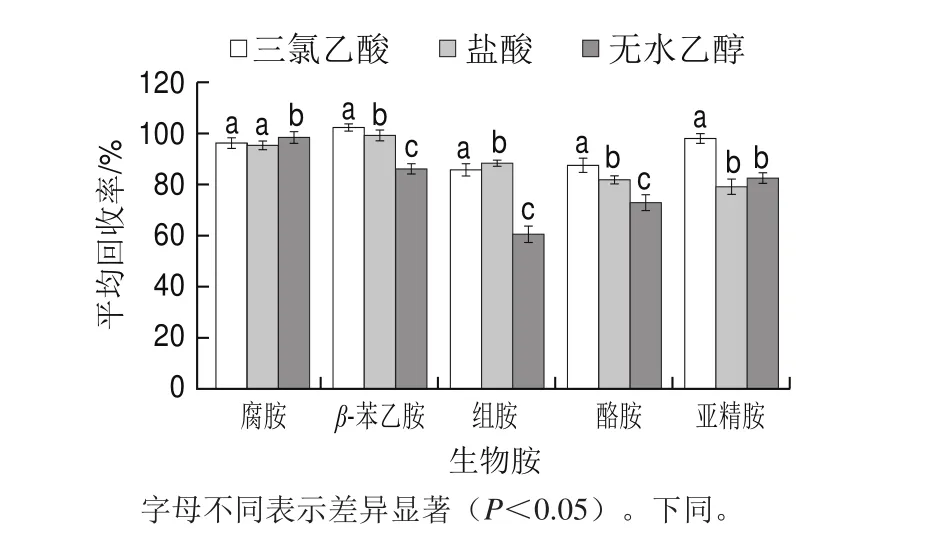
图1 3 种溶剂提取东北农家酱中添加量5.0 mg/L的5 种生物胺的添加回收率(n= 3)Fig. 1 Recoveries of 5 biogenic amines from spiked sample at 5.0 mg/L (n = 3)
当5 种生物胺添加量为5.0 mg/L时,三氯乙酸对5 种生物胺的提取回收率为85.7%~102.3%,相对标准偏差(relative standard deviation,RSD)不高于6.1%;盐酸对5 种生物胺的提取回收率为79.1%~99.2%,RSD不高于8.2%;无水乙醇对5 种生物胺的提取回收率为60.5%~98.4%,RSD不高于10.3%。其中三氯乙酸对β-苯乙胺、酪胺、亚精胺的回收率均高于盐酸和无水乙醇对这3 种生物胺的回收率,差异性显著(P<0.05),无水乙醇对腐胺的提取回收率高于三氯乙酸和盐酸,但是其对组胺的回收率为60.5%,远低于另外两种提取剂。

图2 3 种溶剂提取东北农家酱中添加量10.0 mg/L的5 种生物胺的添加回收率(n=3)Fig. 2 Recoveries of 5 biogenic amines from spiked sample at 10.0 mg/L(n = 3)
当5 种生物胺添加量为10.0 mg/L时,三氯乙酸对5 种生物胺的提取回收率为84.2%~101.6%,RSD不大于6.0%;盐酸对5 种生物胺的提取回收率为60.7%~95.0%,RSD不大于9.3%;无水乙醇对5 种生物胺的提取回收率为50.2%~78.9%,RSD不大于16.9%。三氯乙酸对5 种生物胺的提取回收率均高于盐酸和无水乙醇,差异性显著(P<0.05),且RSD均低于另外两种提取剂,回收率及精密度均符合检测要求,而无水乙醇提取5 种生物胺的RSD高于10%,并不符合检测要求。

图3 3 种溶剂提取东北农家酱中添加量15.0 mg/L的5 种生物胺的添加回收率(n= 3)Fig. 3 Recoveries of 5 biogenic amines from spiked sample at 15.0 mg/L (n = 3)
当5 种生物胺添加量为15.0 mg/L时,三氯乙酸对5 种生物胺的提取回收率为80.7%~96.2%,RSD不大于5.5%;盐酸对5 种生物胺的提取回收率为65.1%~90.2%,RSD不大于8.4%;无水乙醇对5 种生物胺的提取回收率为52.7%~70.4%,RSD不大于20.4%。三氯乙酸对5 种生物胺的提取回收率均高于盐酸和无水乙醇,差异性显著(P<0.05),且RSD均低于另外两种提取剂,回收率及精密度均符合检测要求,而盐酸对生物胺的提取回收率相对于三氯乙酸较低,不符合检测要求,无水乙醇RSD高于10%,没有良好的重复性,同样不符合检测要求。
综上,在5.0、10.0、15.0 mg/L的添加水平下,三氯乙酸对5 种生物胺提取回收率分别为85.7%~102.3%、84.2%~101.6%和80.7%~96.2%,RSD分别不大于6.1%、6.0%和5.5%。回收率和精密度均符合检测要求,可以说明三氯乙酸是一种提取东北农家酱中生物胺的理想溶剂。且三氯乙酸对东北农家酱的处理时间只需30 min,从整体提取效果来看,三氯乙酸提取具有操作简单快速、回收率相对较高的优点,是分析东北农家酱中生物胺的一种较为理想的提取溶剂。
2.2 衍生剂的选择及用量
生物胺自身没有荧光或紫外发光基团,且其属于极性分子,需经过对其进行衍生来提高其在柱子中的溶解性,使其极性得到降低,才能对其含量进行准确测定。生物胺衍生剂有苯甲酰氯、丹磺酰氯、邻苯二甲醛、荧光胺、N-羟基丁二酰亚胺酯类化合物等,目前最常使用的衍生剂是丹磺酰氯和邻苯二甲醛。但邻苯二甲醛和生物胺反应后需立即测定,存在反应产物不稳定的缺点,而丹磺酰氯与单胺和二胺均可反应,且反应后产物稳定,有较强的紫外吸收等优点。董伟峰等[27]将丹磺酰氯和生物胺反应后的衍生物放置-20 ℃避光环境6 个月后发现其成分无太大变化。故选择丹磺酰氯作为衍生剂,并对其最适衍生用量进行研究,分别添加2、4、6、8、10 mg/mL丹磺酰氯的丙酮溶液与质量浓度为50 mg/L的生物胺混标溶液进行反应,结果见图4。
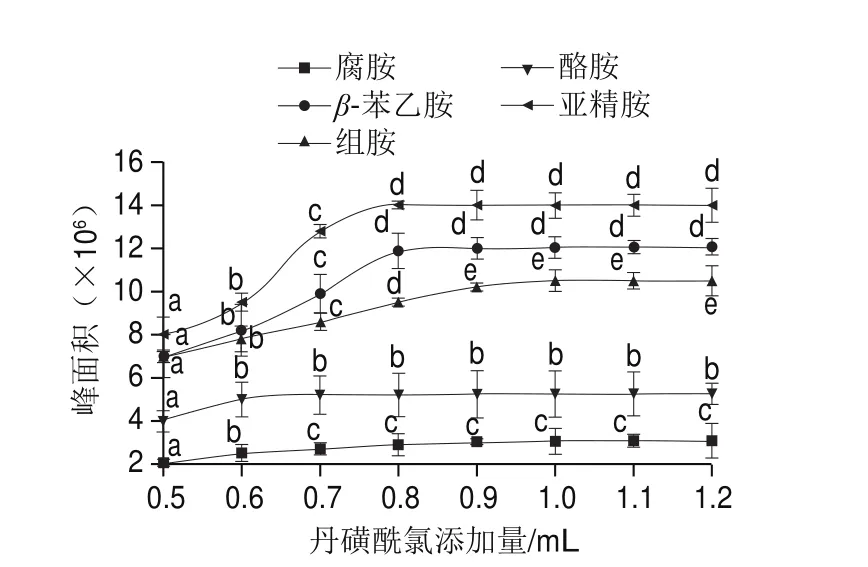
图4 丹磺酰氯添加量对生物胺衍生物生成量的影响Fig. 4 Effects of addition level of sulfonyl chloride on the production of biogenic amine derivatives
由图4可以看出,随着丹磺酰氯添加量的增加,5 种生物胺衍生物也在不断增加,当丹磺酰氯添加量为0.8 mL时,衍生物峰面积达到最大,且随着衍生剂用量的增加,衍生物的量并未明显增加,当衍生剂用量为1.0 mL时,组胺衍生物达最大量,但与丹磺酰氯添加量为0.8 mL时并无显著差异(P>0.05),考虑到衍生剂过量会对生物胺色谱图产生干扰,故选择0.8 mL作为衍生剂的最适用量。
2.3 衍生物萃取剂的选择
本研究使用丹磺酰氯进行样品衍生化处理,过程中加入碱性缓冲溶液,使衍生物溶液中含有无机盐;而东北农家酱基质复杂,并且衍生后生物胺衍生物存在浑浊现象,为避免检测中色谱柱受到杂质损害并保证检测的准确性,经查阅文献,本研究选择三氯甲烷、乙酸乙酯、乙醚作为衍生物萃取剂对东北农家酱样品中的生物胺进行进一步的富集纯化,结果见图5。衍生物萃取结果表明,这3 种溶剂均可将生物胺衍生物萃取出来,但经三氯甲烷和乙醚萃取的生物胺衍生物,峰形均不正常且存在峰没有完全分离的现象,这可能是由于东北农家酱样品经衍生后还产生其他一些物质,乙酸乙酯只能将生物胺衍生物萃取出来,而乙醚和三氯甲烷可能将生物胺衍生物和其他物质一同萃取出来[28]。并且使用氮气吹干萃取剂时,三氯乙酸的挥发速度明显低于另外两种萃取剂;而又因为乙醚毒性高于乙酸乙酯,综合考虑,选择乙酸乙酯作为本研究的生物胺衍生物萃取剂。

图5 乙酸乙酯(A)、乙醚(B)、三氯甲烷(C)萃取生物胺衍生物的图谱Fig. 5 HPLC chromatograms of ethyl acetate (A), ether (B), and chloroform (C) extracts of biogenic amine derivatives
2.4 标准曲线和线性关系

图6 生物胺标准品(A)和东北农家酱(B)中生物胺色谱图Fig. 6 HPLC chromatograms of biogenic amine standards (A) and biogenic amines from soybean paste (B)
由图6A可知,5 种生物胺在40 min内可以完全分离,且峰形对称。东北农家酱样品中生物胺色谱图见图6B。以生物胺标准系列溶液浓度为横坐标,峰面积为纵坐标绘制标准曲线,得出线性范围;将加标样品逐渐稀释,衍生后进样,以3 倍信噪比作为检出限,结果见表3。

表3 生物胺的线性回归方程Table 3 Linear regression equations for biogenic amines
由表3可知,5 种生物胺在1~50 mg/kg范围内线性良好,相关系数R2不小于0.99,峰面积和生物胺含量之间具有显著线性相关。检出限在0.02~0.06 mg/kg之间,该方法灵敏度高,可以满足生物胺测定的要求。
2.5 重复性、精密度及加标回收实验结果
选取同一东北农家酱样品经衍生后连续进行重复测定5 次,RSD低于5%,表明该方法重复性良好,精密度良好,达到分析要求,结果见表4。

表4 方法的精密度实验(n=5)Table 4 Results of precision tests (n= 5)

=3)Table 5 Recoveries of biogenic amines from spiked sample (n= 3)表5 生物胺加标回收率的测定(n
选取东北同一农家酱样品,在线性范围内选取5.0、10.0、15.0 mg/L三个质量浓度添加标准品溶液,经衍生后进行测定,每个样品进行3 次平行测定,得平均加标回收率在82.23%~104.87%之间,RSD在1.56%~4.28%(n=3)之间,符合检测要求,结果见表5。
2.6 样品测定结果
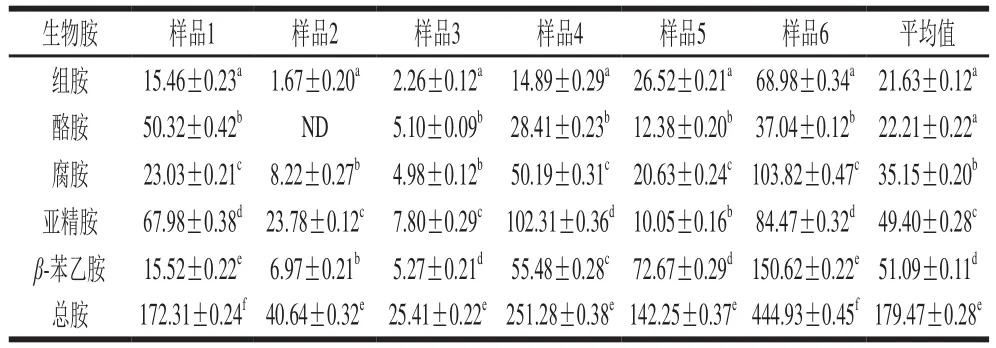
表6 市售东北农家酱中生物胺含量Table 6 Contents of 5 biogenic amines in farmhouse soybean paste samples from northeastern China mg/kg
由表6可知,不同东北农家酱中的5 种生物胺含量不尽相同,这可能是由于不同东北农家酱的发酵环境不同导致的。总体来说,组胺、腐胺、亚精胺和β-苯乙胺在6 种样品中均检测到,其中1 种样品中未检测到酪胺。6 种样品生物胺总含量范围为25.41~444.93 mg/kg,其中对人体危害较大的组胺和酪胺含量分别在1.67~68.98 mg/kg和0~5 0.3 2 m g/k g之间,腐胺含量范围为4.98~103.82 mg/kg,亚精胺含量范围为7.80~102.21 mg/kg,β-苯乙胺含量范围为5.27~150.62 mg/kg。
在东北农家酱发酵过程中,大量的环境微生物进入其中。其发酵过程具有不确定性和随意性,且自然发酵周期长,微生物发挥较大作用。这些微生物既有有益微生物,又有有害微生物,都存在产生氨基酸脱羧酶的可能性,如若有害微生物含量存在过多,产胺微生物对其中氨基酸利用的比较彻底,导致东北农家酱中生物胺含量的增高。欧洲食品安全管理局证实组胺和酪胺毒性最大,特别与食品安全有关[29]。斯洛伐克共和国营养法典[30]确定了以下两种生物胺的最大耐受限量:组胺(啤酒为20 mg/kg,鱼和鱼制品为200 mg/kg)和酪胺(200 mg/kg)。且荷兰乳制品研究所和捷克建议肉制品中组胺的推荐上限为100~200 mg/kg。由此可知,东北农家酱中的生物胺对人体存在潜在的安全问题,监测东北农家酱中生物胺含量及微生物的存在情况和以生物胺为检测指标建立东北农家酱的安全评价体系势在必行。
3 结 论
本研究建立的高效液相色谱法适用于东北农家酱中5 种生物胺的测定。该方法线性范围较广、重复性好、准确性高,能快速简便地对东北农家酱中的生物胺进行检测分析。使用本研究建立的高效液相色谱法测定不同市售东北农家酱中的5 种生物胺,其含量存在较大差异,故在东北农家酱生产中应注意控制其发酵环境,减少微生物的污染,从而进一步控制东北农家酱发酵过程中存在的生物胺。且东北农家酱发酵过程中生物胺的形成机制和变化规律尚不明确,有待日后进一步深入研究。
