乌龙茶加工过程中儿茶素的稳定性及化学变化
2019-09-06刘洪林曾艺涛
刘洪林,曾艺涛,赵 欣,*
(1.重庆第二师范学院 重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,功能性食品研发重庆市工程实验室,重庆 400067;2.重庆市辅仁中学校,重庆 400067)
中国的6 大茶类均含有大量的多酚类化合物,因发酵程度不同而存在于不同的化合物中。绿茶中含有大量未氧化的儿茶素包括(-)-儿茶素(gallocatechin,GC)、(-)-表没食子儿茶素(epigallocatechin,EGC)、(+)-儿茶素(catechin,C)、(-)-表儿茶素(epicatechin,EC)、(-)-表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、没食子儿茶素没食子酸酯(epigallocatechin gallate,GCG)、(-)-表儿茶素没食子酸酯(epicatechin gallate,ECG)和(-)-儿茶素没食子酸酯(catechin gallate,CG);儿茶素的氧化衍生物茶黄素(theaflavins,TFs)和茶红素(thearubigins,TRs)存在于部分发酵茶(乌龙茶、黄茶和白茶)、全发酵茶(红茶)和后发酵茶(黑茶)中[1-3]。6 大茶类中绿茶儿茶素的含量是最高的,而红茶、黑茶等因其氧化时间较长而大大减少。儿茶素是主要的活性成分,绿茶中占干质量的25%。
由于茶中多酚类化合物的健康益处,各制造商试图生产出多酚含量高的茶叶产品。然而,茶叶生产中多酚的含量和稳定性取决于多种因素,如品种、收获季节、植物的年龄、气候、环境条件和加工条件[4]。在这些因素中,加工条件是决定茶叶产品质量的最重要因素之一。目前,研究加工对茶叶多酚含量的影响,主要集中在绿茶中[5-10]和红茶[11-13],很少有研究关注乌龙茶[14-15]。这可能是因为全世界人们饮用最多的茶类是红茶(78%),其次是绿茶(20%),而乌龙茶在世界范围内的消费量仅为2%。现如今,乌龙茶在世界上越来越受欢迎,但与对绿茶和红茶中活性成分的积极研究相比,对乌龙茶的研究却少得多。
乌龙茶中儿茶素有EC、EGC、ECG、EGCG、C、GC、CG、GCG,化学结构如图1所示。这些儿茶素在茶叶中含量高,对健康有益[16-17]。儿茶素的鉴定与测定一直是乌龙茶化学控制的重点[9,18-19],因此,茶叶生产商试图生产高儿茶素含量的乌龙茶,以应对日益增长的功能性食品市场。然而,儿茶素的含量和稳定性取决于加工过程中的多种因素[6,9,20]。
乌龙茶中儿茶素在加工过程中会发生化学变化,如差向异构化作用和降解反应[21-22],这些反应会导致现在的商业茶饮儿茶素含量略有下降。因此,对儿茶素在加工和贮存过程后在饮茶水溶液中的稳定性进行了大量研究[23-24],但在乌龙茶加工过程中的研究却鲜见报道。特别是在刚开始的鲜叶采摘、乌龙茶严格由同一位专家控制的情况下加工过程中关于儿茶素变化的相关研究更为鲜见。要生产高品质的乌龙茶,高含量的儿茶素是因素之一,故了解乌龙茶加工过程中酚类化合物的稳定性,以获得最佳的健康效益非常重要。因此,本实验研究加工过程中乌龙茶中儿茶素的变化,评价每道加工工艺对乌龙茶生产中儿茶素变化的影响,以期为乌龙茶加工技术提供一定的参考数据,为茶叶产业提供酚类化合物的确切信息。

图1 儿茶素、咖啡因和没食子酸的化学结构Fig. 1 Chemical structures of catechins, caffeine and gallic acid
1 材料与方法
1.1 材料与试剂
标准品:包括GC(≥98%)、EGC(≥98%)、C(≥98%)、EC(≥90%)、EGCG(≥95%)、GCG(≥98%)、ECG(≥98%)、CG(≥98%) 美国Sigma-Aldrich公司;Folin-Ciocalteu试剂、乙腈、三氟乙酸、甲醇(均为色谱纯) 瑞士Fluka公司;无水碳酸钠德国默克公司;其他化学试剂均为分析纯。
1.2 仪器与设备
Whatman No.4滤纸 美国Whatman有限公司;0.45 µm聚四氟乙烯过滤器 美国贝德福德微孔有限公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Aglient公司;Platinum EPS C18液相色谱柱(53 mm×7 mm,3 µm) 美国Whatman公司;DFT-200型200 g手提式粉碎机 温岭市林大机械有限公司;FA2004A型分析天平 海津天电子仪器有限公司;Mili-Q超纯水仪 美国密理博公司;Centrifuge5810高速离心机 德国Eppendorf公司;TU 1900型双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 乌龙茶加工
在福建武夷山采取同一地点生长的12 个品种的一芽二叶采取乌龙茶加工工艺对茶叶进行加工。实验开始前对乌龙茶的加工工艺进行了调查,将每个品种采摘的鲜叶分成3 组,然后加工成乌龙茶(发酵程度约为10%~20%)。采摘、萎凋、做青、杀青、揉捻、烘焙每个加工工艺步骤后采集茶叶样本(250 g),每一道工艺抽取3 个样本。分析之前立即用聚丙烯塑料袋真空包装和-20 ℃贮存样本大约3~5 d,备用。
1.3.2 样本提取
由于从各加工工艺收集的茶叶样本水分含量不同,因此称取样本的质量不同。对采摘后的鲜叶、萎凋、做青、杀青、揉捻、烘焙步骤分别称量茶样10、10、10、5、2 g和2 g(精确到0.001 g)。茶叶样本细磨成粉和200 mL 80 ℃蒸馏水用搅拌机或均质器提取15 min,提取的混合物(渣用蒸馏水洗净(3×10 mL))通过滤纸(Whatman No. 4)过滤,将过滤后的茶汤冷却至室温,用蒸馏水调至250 mL。所有样品均为一式3 份,备用。
1.3.3 各儿茶素单体、TCC测定
采用ISO方法[25]对各儿茶素单体、儿茶素总量(TCC,8 种儿茶素单体的总和)进行测定,并进行细微修改。GC、EGC、C、EC、EGCG、GCG、ECG、CG标准曲线制定:将标准品用甲醇溶解并定容至1 000 µg/mL的标准母液,混合标准母液是通过混合每个标准母液的等量体积制备。制作标准曲线的稀释混合标准品和样品(蒸馏水稀释10 倍)透过0.45 µm聚四氟乙烯过滤器过滤并进行HPLC分析。利用Platinum EPS C18反相色谱柱(53 mm×7 mm,3 µm),柱温30 ℃。流动相A为含体积分数0.05%三氟乙酸溶液,B相为乙腈溶液,A、B相体积比为87∶13,流速2 mL/min。进样量20 µL,检测波长为210 nm。用标准曲线对各儿茶素单体进行量化,计算质量分数。
1.4 数据统计分析
数据表示为 ±s。利用SPSS 16.0进行数据方差分析,P<0.05,差异显著。
2 结果与分析
2.1 HPLC分析
利用AOAC国际指南对膳食补充剂和植物制剂的化学方法进行单实验室验证[26]方法HPLC结果验证。通过比较在190~400 nm紫外光谱标准范围内的的保留时间鉴别儿茶素、没食子酸和咖啡因。校准曲线的绘制是用9 种水平构成的,覆盖了茶叶样品预期的质量浓度范围。由表1得知,GC、EGC、C、EC、EGCG、GCG、ECG、CG的线性检测范围质量浓度分别为0.10~51.9、0.09~43.1、0.20~100.0、0.19~97.0、0.16~80.0、0.11~52.9、0.20~98.0、0.09~44.1 µg/mL。所有分析物相关系数R2范围为0.996 5~0.999 9,均表现出良好的线性关系。
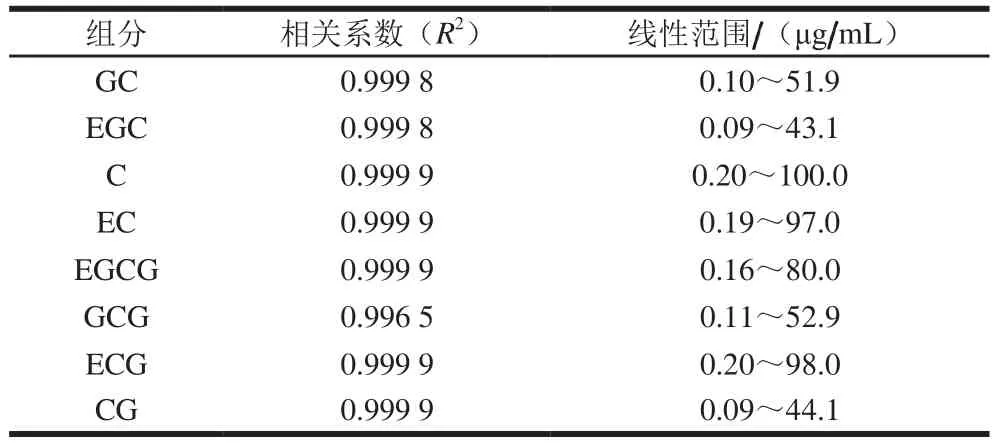
表1 8 种儿茶素单体测定的线性相关性Table 1 Linear equations for 8 individual catechins

图2 标准品(A)、鲜叶(B)和乌龙茶(C)的HPLC图Fig. 2 Typical chromatograms of standard compounds (A), fresh tea shoots (B) and Oolong tea from drying step (C)
如图2所示,乌龙茶加工开始和结束之间的HPLC图存在差异。在鲜叶中检测到7 个儿茶素单体,通过与标准品比较保留时间和真实值,从左到右被鉴定为GC、EGC、C、EC、EGCG、GCG、ECG,未检出CG。将HPLC峰面积与标准品进行比较,对GC、EGC、C、EC、EGCG、GCG、ECG进行量化。发现鲜叶中儿茶素含量中,EGCG质量分数最高,为(4.94±0.28)%;其次是EC质量分数为(1.92±0.14)%;EGC质量分数为(1.90±0.24)%,C质量分数为(1.66±0.17)%,ECG质量分数为(1.16±0.08)%;微量的GC质量分数为(0.37±0.04)%,GCG质量分数为(0.26±0.03)%。根据儿茶素单体质量分数得到儿茶素总量为(12.25±0.17)%。这些结果与之前报道一致[27-29],然而,研究发现个别品种酚类化合物的含量存在差异。这可能是由于化合物的种类和含量受到许多因素的影响,包括子品种和品种种类、生长环境的要素和采收条件等[27-29]。
2.2 TCC和儿茶素单体含量的变化

表2 茶叶中TCC和儿茶素单体的含量Table 2 Contents of total catechins and individual catechins in tea samples from each processing step%
如表2所示,鲜叶中TCC为(12.25±0.17)%。在加工过程中,TCC含量在萎凋过程中保持不变。做青加工过程中TCC大大减少,质量分数为(10.05±0.36)%;杀青过程中含量又略有增加,是由于儿茶素单体EGC、GC和GCG含量的增加导致;干燥后,TCC为(11.06±0.45)%,大约是鲜叶中的90%。
儿茶素含有两个芳香环和几个羟基,可分为两类:游离儿茶素和酯型儿茶素。C、EC、GC和EGC为非酯型,而酯型儿茶素为CG、ECG、GCG和EGCG。此外,儿茶素可根据其立体化学构型分为“非表儿茶素或非表儿茶素结构”(如C、CG、GC、GCG)和“表儿茶素或表儿茶素结构”(包括EC、ECG、EGC、EGCG)。表儿茶素可以转化为非表儿茶素GC、GCG、CG和C,这被称为儿茶素的异构化,儿茶素的异构化是可逆的。表儿茶素和非表儿茶素的化学结构中仅在2R、3R(2,3-cis、表儿茶素结构)和2S、3R(2,3-trans,非表儿茶素结构)之间存在差异[30-31]。
C的结构与EC相似,但与EC不同的是它有2S、3R结构(2,3-trans,非表儿茶素结构),而EC有2R、3R结构(2,3-cis、表儿茶素结构)[32]。鲜叶中EC和C质量分数分别为(1.92±0.14)%和(1.66±0.17)%。在萎凋的步骤质量分数保持不变,干燥步骤后分别稳步下降到(0.84±0.11)%和(0.95±0.17)%。EC和C含量的做青和干燥步骤均有明显的下降,EC含量分别下降为鲜叶含量的81%和43%,C含量分别下降为鲜叶含量的89%和57%。
EGC和EC具有相似的结构,但EGC与EC的不同之处在于其碳3’,4’,5’在B环上。GC具有与EGC相同的结构,但与EGC不同的是它有2S、3R(2,3-trans,非表儿茶素结构),而EGC有2R、3R(2,3-cis、表儿茶素结构)[32]。研究结果表明,鲜叶中EGC质量分数为(1.90±0.24)%。EGC含量在萎凋中保持恒定,在做青阶段显著降低,在杀青过程中显著增加,在干燥过程中显著增加。做青步骤EGC含量减少到约为鲜叶中的81%,这可能是因为在部分发酵过程中酶的氧化作用。而两个热加工过程(杀青和干燥步骤)显著增加了EGC含量,在热加工过程中EGC的增加可能是由于EGCG的热降解。EGCG可能降低,导致EGC的形成和游离态G的释放。鲜叶中GC只含微量,为(0.37±0.04)%。加工过程中GC含量的变化和其表位结构EGC一致。许多研究表明,儿茶素在茶叶生产、酿造和贮存过程中转化为其异构体,在高温环境下会发生异构化[30]。研究表明,儿茶素在热水溶液中处于C2位置时发生表面聚合,这种外显作用可使表儿茶素变为非表结构儿茶素,反之亦然[30,33-35]。本研究发现,GC含量的增加,可能是热加工过程中EGC的异构化导致GC含量增加。
ECG与EC具有相似的结构,但ECG在碳环C3处的没食子结构不同。CG与ECG结构相同,但与EGC不同的是,它有2S、3R(2,3-trans,非表儿茶素结构),而ECG有2R、3R(2,3-cis表儿茶素结构)[32]。鲜叶和乌龙茶中ECG质量分数分别为(1.16±0.08)%、(0.71±0.04)%。单因素方差分析表明,ECG在做青过程首次略有下降,质量分数为(1.02±0.29)%;杀青步骤后稍微增加,质量分数为(1.19±0.45)%;在揉捻和干燥过程中均有明显下降。结果表明,做青、揉捻和干燥步骤使ECG含量降低,分别约为鲜叶含量的88%、72%和61%。ECG含量波动的原因可能是加工过程中的许多因素和反应。在做青过程中,ECG可能经历部分发酵导致ECG发生酶促氧化,形成二聚体或高度络合的化合物群。在热加工过程中,ECG可能会发生降解,导致游离态G的释放。此外,ECG可能是由EGCG的热降解形成。本研究未在鲜叶中检测到CG,ECG上的异构化作用不能增加CG含量,说明异构化作用可能不会导致ECG的下降。因此,可以合理地得出结论,在乌龙茶加工过程中,茶叶中的ECG变化相当复杂,但这种变化并非来自异构化作用。
EGCG具有与EGC相似的结构,但EGCG与EGC不同的是,在C环碳3上的EGCG的没食子酸酯部分与EGC不同。GCG与EGCG具有相同的结构,但与EGCG不同的是,EGCG有一个2S、3R(2,3-trans、非表儿茶素结构),而EGCG有2R、3R(2,3-cis、表儿茶素结构)[32]。EGCG是鲜叶中含量最多的的酯型儿茶素,质量分数为(4.94±0.28)%。在加工过程中,EGCG含量在做青过程中显著降低,并一直保持恒定,直至揉捻为止,干燥过程中其含量再次显著降低。结果表明,做青和干燥步骤显著影响EGCG含量,分别使其下降为鲜叶中含量的80%和61%。可以得知,乌龙茶的加工对EGCG的稳定性有很大影响,可能是EGCG在做青过程中,在湿度充足的环境下非常敏感发生了氧化作用。在做青过程中,EGCG损失的另一个原因可能是酶氧化,形成二聚儿茶酚和复合酚类化合物。在热加工过程中,EGCG损失的主要原因可能是在干燥的过程中,在极高温度下,会发生异构化和降解作用。这与之前报道的EGCG化学特征的理论理解是一致的[36]。EGCG是一种酯型多酚化合物,在这种条件下,EGCG可氧化成二聚体,降解成EGC和异构化作用成GCG[30,34-35]。
GCG在鲜叶中微量,质量分数为(0.26±0.03)%。在做青时,GCG显著降低,在杀青阶段则又显著增加,在干燥过程中,它再次显著增加,干燥步骤之后,GCG质量分数增加到(0.95±0.06)%,变化趋势与EGCG相同。
2.3 加工工艺对酚类化合物含量变化的影响
鲜叶采摘后,在阳光直射下萎凋。与鲜叶相比,凋萎步骤中茶叶儿茶素的含量保持不变,这表明萎凋步骤不影响儿茶素的含量。研究表明,此步骤仅用于鲜叶中去除水分和散发青草味。在做青过程中,TCC、EC、C、EGC、GC、ECG、EGCG、GCG含量均有所下降。导致儿茶素显著减少的一个原因可能是酶促氧化,形成二聚儿茶素和复合酚化合物。
在杀青、揉捻和干燥加工过程中,儿茶素经氧化、水解、聚合和转化后,儿茶素含量降低。结果表明,杀青和烘干均能显著提高EGC、GC、GCG的含量。从表1可以看出,乌龙茶中EGC、GC和GCG的含量比鲜叶中超过100%,这表明其他的儿茶素在杀青和干燥过程中会被转化为EGC、GC和GCG。在热加工过程中EGC的增加可能是由于EGCG的热降解,导致EGC的形成和游离态G的释放[30]。由于EGCG在热加工过程中呈下降趋势,EGCG的降解较为明显。EGC和EGCG的异构化作用可能会导致GC和GCG的增加,因为异构化会在高温下发生[30],这种异构化作用可使表儿茶素变为非表儿茶素。这一事实可以通过前面研究得到支持,研究发现,EGCG生成的GCG进一步转化为其他产物或自由基,甚至无法被检测到[37]。虽然异构化可以将表儿茶素转化为非表儿茶素,反之亦然,但随着EGCG含量的降低,GCG的含量升高,这可能是由于EGCG含量高于GCG,EGCG的转化程度大于GCG。因此,EGCG含量与GCG含量趋于平衡,儿茶素的异构化作用,尤其是EGCG,被认为是乌龙茶生产中最重要的反应之一[30,33-35]。此外,导致儿茶素变化的其他原因可能是加工过程中可用的氧和金属离子,高氧水平会增加儿茶素氧化,儿茶素能与金属离子反应形成金属络合物,且金属离子优先与ECG和EGCG的基团结合[38-39]。
3 结 论
结果表明,在乌龙茶生产过程中,儿茶素质量分数略有下降,约为10%。儿茶素单体变化不一,其中EC质量分数下降为鲜叶的43%,C质量分数下降为鲜叶的57%,EGC质量分数增加为鲜叶的1.67 倍,GC质量分数增加为鲜叶的4 倍,ECG和EGCG质量分数均降低约为鲜叶的61%,GCG质量分数增加为鲜叶的3.65 倍。
在加工过程中,做青、杀青和干燥步骤对儿茶素含量有影响。儿茶素单体的变化可能是由于酶的氧化、热降解和异构化。由于人们越来越意识到茶叶中含有的生物活性多酚类化合物对健康的潜在益处,茶叶市场得到了广泛的发展。因此,本研究的结果为茶叶产业提供了酚类化合物的确切信息。
