非小细胞肺癌患者射频消融术后肿瘤相关性死亡危险因素的研究
2019-09-05张卫华
张卫华
山东省医学科学院附属医院(山东第一医科大学)内五科,山东济南 250031
近年来,肿瘤的发病率逐年升高,其中以原发性肺癌的发病率为最高,且致死率较高。早期非小细胞肺癌(NSCLC)主要通过手术切除辅助与化疗的方式来进行治疗的,且效果显著。然而一部分患者因为心肺功能较差、或者自身原因而失去了外科治疗的机会。
射频消融术的原理是通过消融电极产生无线电波直接作用于癌体,运用其产生的能量造成肿瘤细胞蛋白质变性坏死,进而控制癌组织地生长。RFA的主要优点在于定位精准、微创操作、效果显著,不良反应较少。并能够诱导机体的特异性免疫功能,产生全身性免疫反应的二次(或者远端)效应[1]。该文回顾分析了2016年10月—2017年2月进行RFA的100例NSCLC患例者的相关资料,以探讨术后相关性死亡影响因素,现报道如下。
1 资料与方法
1.1 一般资料
进行非小细胞肺癌的RFA患者100例,其中男性64例,女性 36 例;平均年龄(69.5±9.5)岁;≥65 岁 76 例,<65岁24例;进行术后辅助治疗(包括术后辅助化疗、放疗、靶向治疗)者 56例,未行辅助治疗者44例;术前癌胚抗原(CEA)升高 55例,正常45例;肿瘤分期:Ⅰ~ⅢA期 31例,ⅢB~Ⅳ期 64 例;术前肿瘤平均直径(4.2±1.5)cm;术前肿瘤直径≥3 cm 78例,<3 cm 22例。对患者进行电话随访1年。所选病例均经过伦理委员会批准,并签署知情同意书。
1.2 RFA操作方法
根据患者肿瘤位置选取合适的体位。①行胸部CT检查并给予三维重建,放置定位器,行定位扫描。②确定病灶的大小、范围等,通过光标测量出进针方向、深度等参数。③确定位置后,常规外科消毒、麻醉,再次行胸部CT确定肿瘤位置,以明确进针的方向、角度,嘱患者平静呼吸并进针,到达肿瘤位置后行胸部CT以明确射频消融针是否到达肿瘤内部最佳位置,并根据肿瘤的大小选取针伞长度,并保证射频消融灶边缘超过肿瘤边缘的0.5~1.0 cm为标准。再次行CT检查,确保消融范围后开始消融,消融温度为90℃。操作前后密切观察患者的一般情况。
1.3 统计方法
对临床资料中收集到的数据采用SPSS 17.0统计学软件分析。用(±s)描述计量资料,百分比(%)表示计数资料,计量资料进行t检验,计数资料进行χ2检验、Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 非小细胞肺癌患者射频消融术后肿瘤相关性死亡影响因素的单因素分析
生存率为 55.0%(55/100),死亡率为 45.0%(45/100)。瘤直径<3 cm与≥3 cm患者的生存率分别为 90.9%(20/22)、33.3%(26/78), 接受辅助治疗与非接受辅助治疗患者的生存率分别为 62.5%(35/56)、25.0%(11/44), 两组比较差异有统计学意义(P<0.05),见表1。
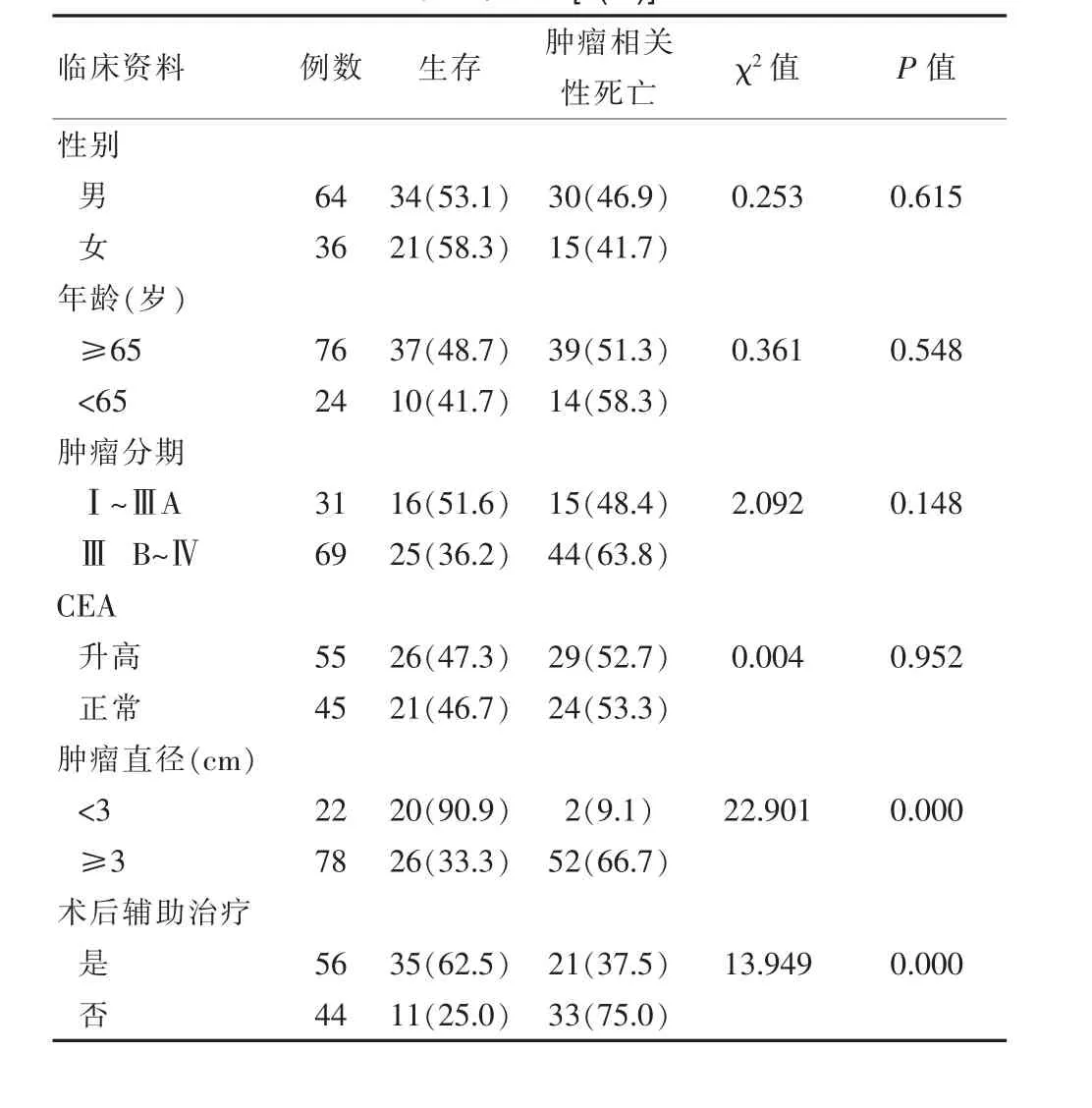
表1 非小细胞肺癌患者射频消融术后肿瘤相关性死亡影响因素的单因素分析[n(%)]
2.2 非小细胞肺癌患者射频消融术后肿瘤相关性死亡影响因素的Logistic多因素分析
将影响微波消融患者病死的因素为自变量,病死率作为因变量进行逻辑回归分析,非小细胞肺癌患者经皮微波消融术后肿瘤相关性死亡的重要危险因素为肿瘤分期、肿瘤直径与术后辅助治疗,差异有统计学意义 (P<0.05),见表 2。
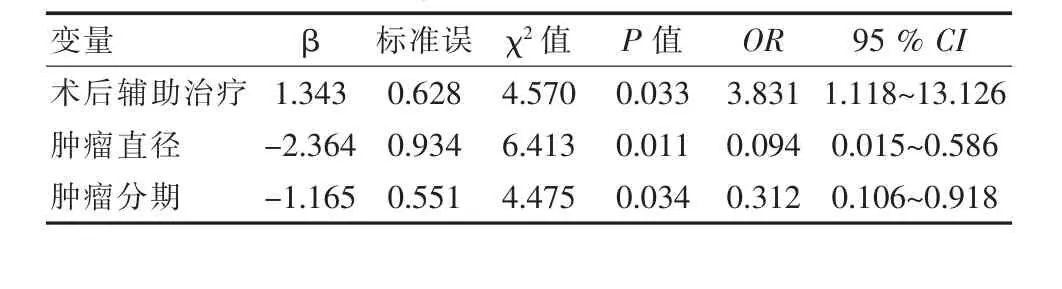
表2 非小细胞肺癌患者微波消融术后肿瘤相关性死亡影响因素的Logistic多因素分析
3 讨论
该研究显示,宿主因素、肿瘤本身因素、治疗干预因素是RFA后影响非小细胞肺癌患者生存的三大因素。
3.1 宿主因素
该研究显示,非小细胞肺癌患者射频消融术后肿瘤相关性死亡影响因素的单因素分析,其中性别(χ2=0.253,P>0.05)、年龄(t=0.361,P>0.05),差异无统计学意义(P>0.05)。这也就提示影响非小细胞肺癌患者射频消融后的危险因素不包括年龄和性别,这与相关文献[2-3]报道一致,他们研究对象的性别(χ2=0.255,P>0.05)和年龄(t=0.378,P>0.05),也就显示老年人射频消融术后的安全性分析相一致。这提示射频消融术的本质都是通过热量使肿瘤组织变性坏死,成功率较高,创伤小,对年龄和性别的要求不高。然而该研究的方向重点不在RFA的安全性,故对气胸、胸腔积液等并发症未进行观察。发现的年龄不作为肺癌相关性死亡因素,显然不是指RFA安全性得到肯定,只是在侧面提示年龄不影响患者的长期生存。
癌胚抗原(CEA)是一种酸性糖蛋白,在各种恶性肿瘤发病时常常出现上升趋势,而以胃肠道肿瘤最常见。有相关文章指出,胃肠恶性肿瘤伴肺转移时,CEA的水平对肺癌MWA患者的生存有一定的影响[4],该究发现,单因素分析显示,CEA升高或正常的,生存率分别为 47.3%(26/55)、46.7%(21/45), 两组比较差异无统计学意义 (χ2=0.004,P>0.05),也有文章[4]显示,他们研究对象的 CEA 升高或正常的,生存率分别为 48.3%、47.7%,两组比较差异无统计学意义(χ2=0.005,P>0.05),两者观点一致。提示他们认为CEA的水平越高提示肿瘤组织体积、数量在一定程度上可能增大增多,也就提示肿瘤可能存在进展的可能。而该文发现,RFA前后CEA的水平不同对非小细胞肺癌治疗患者的生存率几乎无影响。另外报道指出,CEA假阴性率很高,究其原因是CEA在不同分型肺癌中的敏感的各异,不推荐其作为独立筛选因素[6]。总之,CEA水平能否作为对RFA术后非小细胞肺癌的生存率构成相关性,需要寻找更多的证据加以支持。
3.2 肿瘤本身因素
该研究发现,瘤直径<3 cm与≥3 cm患者的生存率分别为 90.9%(20/22)、33.3%(26/78),两组比较差异有统计学意义(χ2=22.901,P<0.05)。提示肿瘤分期是影响RFA后肺癌患者生存率的危险因素之一,这也就说明ⅢB~Ⅳ期的RFA患者的生存率明显低于早期发现的患者。目前,手术切除还是治疗早期肺癌的主要手段,因其可以清扫淋巴结,最大程度断绝肿瘤转移的可能,从而降低患者病死率,故早期肺癌很少有患者选择RFA。有数据[5]表示,外科切除、RFA后的肺癌患者,两者生存率无明显差异,但RFA能否作为早期肺癌的首选手段,仍需以后进一步论证。目前,ⅢB期以上的肺癌患者,RFA常常作为放化疗后效果不佳的手段之一。
有的文献指出,他们研究肿瘤直径>3 cm和<3 cm的两组患者比较患者的生存率分别为89.4%和32.6%(χ2=23.12,P<0.05),与该次的研究一致。也就提示RFA治疗肿瘤直径小于3 cm的肺癌患者的临床疗效最为显著[6-8]。该研究也表明,肿瘤的直径是RFA术后影响非小细胞肺癌生存率的重要因素,且直径是否小于3 cm对患者的生存率有着明显的差异。考虑造成这种结果的原因与射频消融的直径大于肿瘤直径约0.5~1.0 cm,而直径较大的肿瘤因射频消融针大小的原因使得消融不能达到直径0.5~1.0cm,使得射频消融范围不够,不能完全将肿瘤细胞完全去除,也不能形成有效的凝固带减少肿瘤的发生发展。
3.3 治疗干预治疗
目前肺癌的其它干预手段主要通过放化疗、靶向治疗等实现,其主要原理是将残存的肿瘤细胞,甚至血液中的转移灶全部杀灭,从而最大程度的预防转移的发生来提高患者的生活质量。该实验发现,RFA联合其他干预治疗效果显著,能明显改善患者的预后。放疗、化疗、靶向治疗、RFA四者均有着各自的优缺点。化疗的缺点在于肿瘤对药物的敏感度差、患者不能耐受其不良反应,进而造成不能达到理想的临床疗效,其优势则是能够控制较远处的转移灶。肿瘤细胞对放疗不敏感,就会造成不能完全将机体内的肿瘤病灶,尤其是存在远处转移的患者,放疗被认为最后的救命稻草所被使用。RFA则主要作用于局部,能够达到局部较为满意的效果,但是远处转移灶还需要放化疗的辅助支持。
国外相关研究显示,将一群肺叶切除术后的非小细胞肺癌患者,根据是否行化疗辅助治疗分为两组,中位数随访了7.0年,最后的研究显示化疗能减少术后的复发率和脑转移的发生率[9-11],而国内外对非小细胞肺癌RFA后辅助放化疗的研究少只有少,没有参考价值。我们的分析发现,RFA术后行辅助治疗的患者的预后明显增加,这也说明了,RFA术后辅助放化疗是相当必要的,这可能与辅助干预治疗更大程度地杀死其他残存的肿瘤细胞,乃至血液中微小转移灶,极大地降低了肿瘤的复发率。
综上所述,该研究结果表明肿瘤的分期和直径影响NSCLC患者RFA后生存,术后辅助治疗对减少患者肿瘤相关性死亡具有积极作用。
