致犊牛脑炎大肠杆菌生物膜形成特性的研究
2019-09-05李蓓蓓晁金平蒋建军马勋王鹏雁
李蓓蓓,晁金平,蒋建军,马勋,王鹏雁
(石河子大学动物科技学院, 新疆 石河子 832000)
大肠埃希氏菌(Escherichiacoli),通常被称为大肠杆菌,属于埃希氏菌属,肠杆菌科,大多为温血动物肠道中占优势的兼性厌氧寄居菌群[1]。根据大肠杆菌的致病机制,可将其分为共生型、肠道致病型、肠外致病型3种类型,其中,肠外致病性大肠杆菌可寄生在宿主肠道外的其它组织中,然后在幼畜和婴儿中引起脑膜炎、腹泻和败血症,具有高发病率、高死亡率的特点[2-3]。
犊牛患脑膜炎通常是由某些致病力较强的革兰氏阴性菌感染产生,1周龄以内的初生犊牛常发生该病[4]。在未获得足够量初乳的情况下, 初生犊牛没有足够量的免疫球蛋白,不能抵挡致病微生物的侵袭,体内的某些微生物,通过血液、淋巴等途径进入大脑感染致病,但也可能由脐部感染、口食引起[5]。
临床表现上,一般呈典型的高热,有嗜睡、癫痫、垂头等症状,当犊牛患重度败血症时,会出现虚脱和失血性休克等症状。病理变化主要表现为:肠系膜淋巴结发生肿大,肝、肾呈苍白缺血状态,包膜有出血点,患有腹泻症状的病畜,胃肠黏膜会呈现出血性炎症变化[6-9]。
细菌生物膜(Biofilms,BF),是指附着于有生命或无生命物体表面被细菌胞外大分子包裹的有组织的细菌群体,属于一种细菌在险恶环境中的生长方式[10]。大肠杆菌生物膜的形成与其本身的结构有关,如黏附因子、毒力因子、细胞坏死因子和铁载体[11]等,此外,它还与细菌生存环境有关,例如,培养环境中的温度、pH、营养成分、铁离子浓度和氧化还原电位变化等因素,都会影响生物膜的形成状态及生长周期变化[11]。细菌对抗生素产生耐药性主要是因为形成了生物膜[12-14]。在形成生物膜后,细菌可以通过多条途径产生耐药性,使抗生素根本不能进入其中发挥作用[15]。同时,细菌本身也会因为基因突变或者基因重组等变异现象,致使抗生素失去其真正的作用,给临床疾病的防治带来很大的困难[16]。
因此,本实验以实验室前期分离的致犊牛脑炎大肠杆菌为研究对象,通过设定不同pH、不同温度以及不同时间观察致犊牛脑炎性大肠杆菌生物膜特性,确定其生物膜形成的最适条件;在最佳条件下,与肠内共生型和禽肠外致病性大肠杆菌生物膜的形成进行比较。结果为后期研究其生物膜与耐药性、毒力的相关性等提供实验依据。
1 材料与方法
1.1 菌株
致犊牛脑炎大肠杆菌NJY9957及肠内共生型大肠杆菌,由石河子大学动物科技学院微生物实验室鉴定保存,禽肠外致病性大肠杆菌由扬州大学老师惠赠。
1.2 主要仪器和试剂
超净工作台(上海博讯实业公司);酶标仪(美国BioTek公司);倒置显微镜(上海光学仪器公司);96孔培养板、LB培养基、结晶紫、乙醇丙酮等相关试剂(广州东盛生物科技有限公司)。
1.3 菌株的复苏
取-20 ℃冻干保存的菌株,吸取适量无菌水以溶解冻干菌块,用接种环挑取菌液,于普通琼脂平板上划线,在37 ℃温箱中培养16 h后,挑选单个菌落接种于LB肉汤中,37 ℃ 温箱中摇菌培养12~16 h后备用。
1.4 生物膜定量检测
1.4.1 生物膜的制备
在96孔培养板上每孔滴加LB液体培养基180 μL,滴加菌液20 μL,轻轻地做“十”字水平振晃,以混匀板孔中菌液和培养基。置于37 ℃温箱中培养一定时间后,用移液枪吸出培养基弃去,200 μL PBS缓冲液(高温灭菌)缓缓冲洗板孔,反复洗3次以上,以除去孔中浮游的细菌,然后将培养板置于60 ℃烘箱中烘干。空白组加200 μL LB液体培养基作对照。
1.4.2 结晶紫染色
从烘箱中取出培养板,每孔滴加1%的结晶紫染液50 μL,室温下染色,静置15~20 min后,用移液枪吸出板孔中的结晶紫染液,流水轻轻冲洗掉多余的染液,倒置培养板于滤纸上将剩余水分除去,放置于烘箱中烘干。
1.4.3 生物膜形态结构观察及OD值测定
彻底干燥后的培养板可以直接在倒置显微镜下观察生物膜形态结构,通过调节显微镜选取较清晰且典型的视野采集图像并记录。
在培养板每孔滴加乙醇-丙酮200 μL进行脱色处理,静置15~20 min后,在600 nm,37 ℃的条件下,用酶标仪测定每孔中溶液的OD值,对数据进行分析。
判定标准,基于临界值ODc,可以分为4种不同生物膜类型菌株:OD>4×ODc为强黏附型,2×ODc 1.5.1 培养时间对生物膜形成的影响 对分离株进行生物膜制备,37 ℃条件下,培养8、12、24、36、48、72 h后,在倒置显微镜下观察各时间段分离株生物膜形成状态,采集图像。并按照上述方法对各时间段分离株生物膜进行定量检测,绘制折线图,确定其形成周期。 1.5.2 温度对生物膜形成的影响 将培养板分别放置于30、33、37、42 ℃温箱中培养24 h,然后按照上述方法对不同温度下培养的分离株生物膜形成状况进行定量检测。 1.5.3 pH值对生物膜形成的影响 配制LB液体培养基,pH值分别调节至4.0、5.0、6.0、7.0、8.0,将分离株分别在各pH值培养基环境下进行生物膜的制备,37 ℃温箱中培养24 h,然后按照上述方法对不同pH值下培养的分离株生物膜形成状况进行定量检测。 通过上述实验,最终确定NJY9957株生物膜形成所需最佳条件后,分别将分离株、肠内共生型及禽肠外致病性大肠杆菌3株菌置于此条件下进行生物膜制备,并对3种菌株生物膜形成状况进行定量检测,作比较分析。 大肠杆菌NJY9957株在37 ℃条件下分别培养8 、12、24、36、48、72 h后,倒置显微镜下观察生物膜的形成,结果见图1。 注:A~F,依次为大肠杆菌培养8、12、24、36、48、72 h后,生物被膜的生长状态图1 NJY9957在不同培养时间内形成生物膜的结构特点(×300)Fig.1 The characteristics of NJY9957 biofilm at different time (×300) 由图1可知,8 h时有少量菌体开始黏附在载体表面,部分生物膜已开始生成,有趋势向网状继续生长(图1 A);12 h时出现大量菌体黏附现象,生物膜结构较为连续,网格状结构开始变得较为明显(图1B);24 h时呈连续的致密的较为清晰的网格状结构(图1C);36-72 h网格结构逐渐开始脱落,部分呈零星散落状,生物膜的完整性也随时间的延长逐渐下降(图1D、图1E、图1F)。 结果表明,NJY9957株生物膜在8 h处于起始黏附阶段,12~23 h大量菌体黏附,属于集聚阶段,24 h时形成完整的生物膜结构,属于成熟稳定期,24 h后生物膜完整性开始降低,出现脱落现象,属于播散期。 NJY9957株在37 ℃条件下分别培养8 h、12 h、24 h、36 h、48 h、72 h后进行定量检测,结果见图2。 图2 NJY9957株分别在不同培养时间的OD值Fig.2 The influence of incubation time on NJY9957 biofilm formation NJY9957株分别在30 ℃、33 ℃、37 ℃、42 ℃温度条件下培养24 h后进行定量检测,结果见图3。 图3 NJY9957株分别在不同温度下的OD值Fig. 3 The influence of incubation temperature on NJY9957 biofilm formation 由图3可知,4种不同培养温度检测的OD600 nm值存在差异,温度的不同对分离株生物膜形成具有一定的影响,在培养相同的时间后,确定最适合其生物膜形成的温度为37 ℃。 温度37 ℃条件下,NJY9957株分别在pH为4.0、5.0、6.0、7.0、8.0的培养基环境培养,24 h后进行检测OD600 nm值,结果见图4。 图4 NJY9957株分别在不同pH的OD值Fig.4 The influence of incubation pH on NJY9957 biofilm formation 由图4可知,分离株生物膜的形成能力会受到培养环境pH值的影响,pH=4.0~7.0内,OD600 nm值随pH增高逐渐升高,在pH=7.0时OD600 nm值最大,之后开始下降,由此确定最适合其生物膜形成的pH值为7.0。 通过前3个试验确定分离株形成生物膜所需最佳条件是温度为37 ℃,培养基pH=7.0,培养时间为24 h,将分离株、共生型及禽肠外致病性大肠杆菌3种菌株在此条件下培养,基于临界值ODc,以OD>4×ODc为强黏附型,2×ODc 表1 3株大肠杆菌生物膜粘附性分析结果Tab.1 Results of NJY9957, symbiotic type and poultry Extraintestinal Pathogenic E. coli biofilm adhesion 图5 3株大肠杆菌的生物膜形成情况比较Fig.5 Comparing on the biofilm formation of NJY9957, symbiotic type and poultry Extraintestinal Pathogenic E. coli 本试验对致犊牛脑炎大肠杆菌NJY9957株的研究发现,其生物膜在一定培养条件下能很快形成,8 h开始有菌体黏附,24 h形成成熟的生物膜,具有完整的网格状结构,24 h后开始降解。这为确定大肠杆菌生物膜形成成熟结构的时间提供了相关依据,但不同菌株由于生物学特性等因素,其生物膜的形成能力不同,形成稳定状态所需培养时间也存在差异, 如致病性大肠杆菌O157:H7,其生物膜形成成熟的生物膜结构需要48 h[11]。生物膜的形成能力会受到环境中温度、pH值等影响。研究发现, 当培养环境的温度降低时, 李斯特杆菌的生物膜形成能力会随之降低[4],而分枝杆菌生物膜在不同温度环境下的形成能力表现不同;肠炎沙门氏菌生物膜形成的能力很容易受到pH值的影响,而粪肠球菌对pH值的耐受能力却很强[18]。本研究对NJY9957生物膜在不同温度和pH值条件下形成情况的研究发现,其生物膜的生成量,在一定范围内随温度或pH值的升高而升高,分别在温度为37 ℃、pH为7.0时达到最大值,之后开始降低。在所查阅文献中,对大肠杆菌生物膜形成过程中受pH和温度因素影响的试验数据较少,本实验过程中,pH和温度的取值设定没有明确的参考范围,需要通过多组试验进行选择确定适合的取值。 有研究表明,生物膜形成的能力与细菌的耐药性和毒力有关[12,14]。本试验在对比3株大肠杆菌形成生物膜能力的结果中发现,共生型大肠杆菌形成生物膜的能力较其他两株致病菌明显要强。这也说明生物膜与毒力之间不存在直接正相关,但是与细菌的粘附力和数量具有直接关系。当然,本试验只是对致犊牛脑炎大肠杆菌NJY9957株生物膜在不同条件下的形成情况做了相关的研究分析,为后期研究其生物膜与耐药性、毒力的相关性等提供实验依据。细菌生物膜形成的遗传物质基础、形成能力与毒力之间的关系以及耐药机制等问题还需进一步的研究。 本研究确定了致犊牛脑炎大肠杆菌NJY9957株形成生物膜最适生长条件是温度为37 ℃,培养基pH=7.0,培养时间为24 h,其生长周期:8 h有少量菌体开始黏附,处于起始黏附阶段,12~23 h有大量菌体不断地黏附,属于集聚阶段,24 h形成完整的生物膜结构,属于成熟稳定期,24 h后出现脱落现象,生物膜开始降解,属于散播期。在最佳条件下,与共生型和禽肠外致病性大肠杆菌比较结果为共生型大肠杆菌为强黏附型,NJY9957大肠杆菌为中等黏附型,禽肠外致病性大肠杆菌为弱黏附型。1.5 生物膜形成的影响因素
1.6 3株大肠杆菌的生物膜形成比较
2 结果与分析
2.1 生物膜形态的显微镜观察结果

2.2 不同时间形成生物膜OD值测定结果
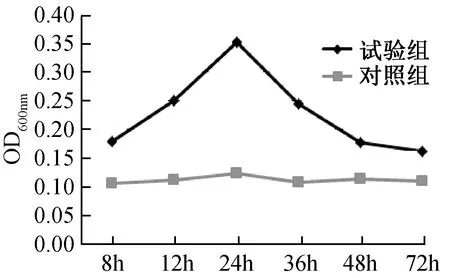
2.3 不同温度形成生物膜OD值测定结果
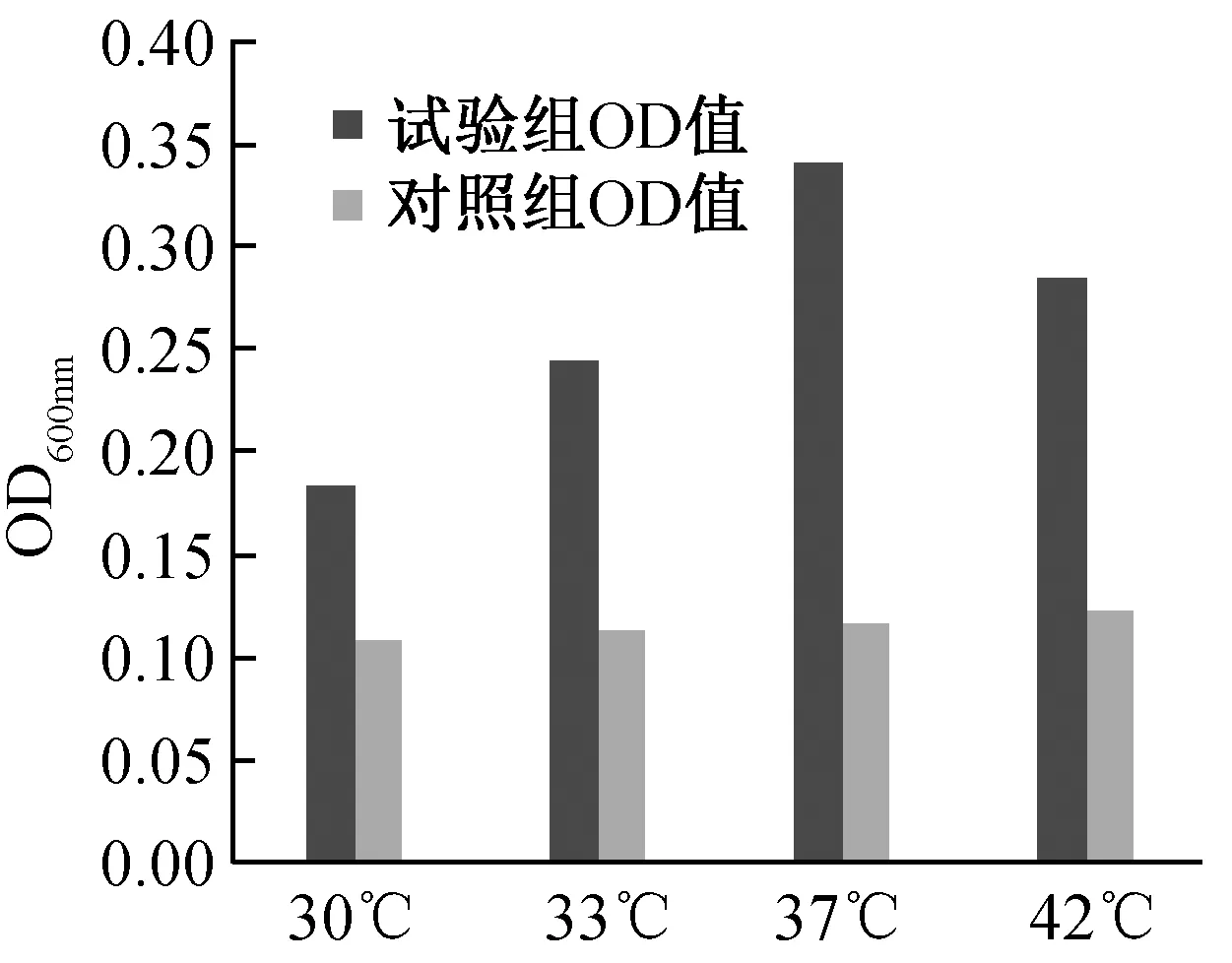
2.4 不同pH值形成生物膜OD值测定结果
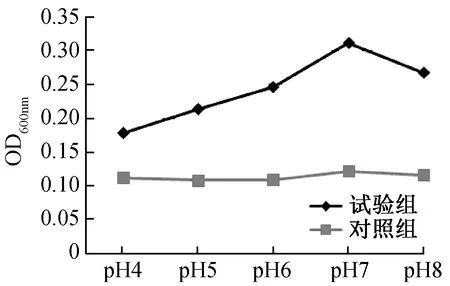
2.5 3株大肠杆菌的生物膜形成比较结果分析


3 讨论与结论
