胰蛋白酶消化法测定牛胶原蛋白三股螺旋结构的含量
2019-09-05梁健华李奕恒
梁健华,梁 杏,李奕恒
广州创尔生物技术股份有限公司,广州 510000
胶原蛋白是脊椎动物细胞外基质中的一个重要组成部分,是哺乳动物中最丰富的蛋白质,约占总蛋白质量分数的20%~30%。由于胶原蛋白具有显著的成纤维结构,良好的生物降解性,优越的生物相容性及较低的抗原性等优点,其已经广泛运用生物医学领域上。天然的胶原蛋白分子由三部分组成:非螺旋氨基末端部分,中心三股螺旋部分和非螺旋羧基末端部分。三股螺旋结构部分是由约为300个重复的“Gly-X-Y”单元组成,其中X通常是脯氨酸(Pro),Y通常是羟脯氨酸(Hyp),该重复单元约占总肽链长度的95%以上。胶原蛋白的三股螺旋结构,能使细胞吸附、迁移于胶原蛋白基上,甚至能调节和促进细胞的分化,并有助于维持组织和器官的稳定性和完整性。可见,三股螺旋结构是胶原蛋白生物活性的一个重要标志,是其发挥功能特性的前提[1]。此外,胶原蛋白的三股螺旋结构决定了其物理、化学性能,是胶原蛋白应用于各领域的重要前提,例如利用具有三股螺旋结构胶原蛋白的成纤维能力制备的胶原蛋白海绵,可用于体内止血[2]。然而,天然的胶原蛋白的三股螺旋结构容易受加工环境的影响[3],在胶原蛋白的生产加工中不可避免会引入物理热[4]、辐照[5,6]、剪切、酸及其他化学试剂[7,8]等,这会对胶原蛋白的三股螺旋结构造成破坏甚至完全破坏,导致其失去天然的生物活性功能,最终影响产品的质量。
目前,胶原蛋白三股螺旋结构的检测方法主要为圆二色谱法(CD)[9]和红外光谱法(FTIR)[10]。然而,这两种方法都只能定性的判断胶原蛋白中三螺旋结构的破坏程度,却无法定量检测三股螺旋结构的含量。通常通过测定胶原蛋白中Hyp的含量可以间接地测定胶原蛋白的含量[11,12]。设想在测定Hyp含量前,是否可通过预处理分离胶原蛋白中三股螺旋结构完整的胶原蛋白和三股螺旋结构破坏的胶原蛋白,从而实现完整三股螺旋结构胶原蛋白含量的测定。
本研究依据上述设想,利用完整三股螺旋结构的胶原蛋白不能被胰蛋白酶酶解,而三股螺旋结构完全破坏或部分破坏的胶原蛋白则能被胰蛋白酶酶解的原理[13],通过摸索胶原蛋白或明胶与多肽的分离条件、利用三螺旋结构破坏的明胶液为底物摸索胰蛋白酶酶解条件,建立适用于含胶原蛋白的溶液体系中三股螺旋结构质量分数检测的方法,以弥补现今检测方法的不足,为胶原蛋白基产品的质量评估提供有效的检测方法。
1 材料与方法
1.1 材料与试剂
片状的去筋膜及除杂蛋白/脂肪后的牛筋由广州创尔生物技术股份有限公司提供;牛I型胶原蛋白标准品和L-羟脯氨酸(纯度≥98.0%,分子量为131.13 g/mol)购自Sigma;胃蛋白酶(比活力1∶10 000)和胰蛋白酶(酶活力为3 000 U/mg,)购自阿拉丁;α-氨基丁酸(AABA,纯度>98.0%,分子量为103.12 g/mol)购自麦克林;Waters AccQ·Fluor试剂盒(包含硼酸缓冲液(Buffer 1),衍生剂粉末(6-氨基喹啉基-N-羟基琥珀酰亚氨基甲酸酯,2A),衍生剂稀释液(2B),Eluent A缓冲溶液)和氨基酸水解标样(含17种水解氨基酸各2.5 mmol/L(仅胱氨酸为1.25 mmol/L,不含羟脯氨酸))购自Waters;其它用于液相色谱分析的化学试剂为色谱级,其余为分析纯。
1.2 样品液制备
1.2.1 牛筋胶原蛋白的制备
胶原蛋白的提取参考文献的方法[14],描述如下:往粉碎后的牛筋中加入浓度为0.5 M的醋酸溶液(1∶50(w/v),含0.3%的胃蛋白酶(w/w))搅拌提取。提取后的蛋白液在4 ℃下离心(10 000 rpm,30 min)得到上清胶原蛋白液,置于4 ℃下透析处理48 h,用于后续胶原蛋白三股螺旋结构的分析。
1.2.2 明胶液的制备
明胶液的制备参考文献[13]。取上述胶原蛋白液于60 ℃下处理10 min,恢复至常温后,作为胰蛋白酶酶解条件摸索的底物。
1.3 仪器与设备
5804R高速冷冻离心机,德国eppendorf公司;DYY-8C型电泳仪,北京六一仪器公司;Waters Alliance e2695-2489,配Waters AccQ·Tag氨基酸分析柱,美国Waters公司;Chirascan圆二色谱仪,英国Applied Photophysics公司;DSC 214 差式扫描量热仪,德国NETZSCH公司;Vertex 70红外光谱仪,德国Bruker公司。
1.4 方法
1.4.1 胶原蛋白三股螺旋结构质量分数测定方法的建立
1.4.1.1 TCA沉淀胶原蛋白/明胶条件的单因素试验
TCA能沉淀蛋白溶液体系中的蛋白质,本试验考察了TCA的质量分数和离心转速两个因素分别对胶原蛋白、明胶沉淀效果的影响,以蛋白质的沉淀率为评价指标。
(1)TCA质量浓度的确定
分别取一定质量的胶原蛋白液和明胶液,各加入相同体积的4 ℃的TCA溶液,以保证TCA溶液的终质量分数分别为0%、5%、10%和15%。混匀后,置于5 000 rpm下离心10 min。取上清液,根据Lowry法测定上清液的蛋白浓度。蛋白质的沉淀率以S(%)表示,结果按下式(1)计算,实验平行测定3次。
(1)
式中:S为蛋白的沉淀率,单位为%;Cx%TCA为当TCA为5%,10%和15%时,上清液蛋白质的浓度,单位为mg/mL;C0%TCA为当TCA为0%时蛋白质的浓度,单位为mg/mL。
(2)沉淀离心转速的确定
根据1.4.1.1的结果,分别取一定质量的胶原蛋白液和明胶液,各加入相同体积的4 ℃的TCA溶液,以保证TCA的终质量分数为10%。混匀后,分别置于1 000、5 000、8 000 rpm下离心10 min。取上清液,使用Lowry法测定上清液的蛋白质的质量浓度。蛋白质的沉淀率以S(%)表示,结果按下式(2)计算,实验平行测定3次。
(2)
式中:S为蛋白质的沉淀率,单位为%;CCrs为当离心转速为1 000、5 000、8 000 rpm时,上清液蛋白质的质量浓度,单位为mg/mL;C0%TCA为当TCA为0%时蛋白质的质量浓度,单位为mg/mL。
1.4.1.2 胰蛋白酶酶解条件的摸索试验
1.4.1.2.1 酶酶前的处理
用0.5 M NaOH溶液或者醋酸溶液调节明胶液(200 mL,4 mg/mL)pH为3.6~3.7,加入10 mL胰蛋白酶液(1 mM HCl含0.05 mol/L CaCl2溶液溶解),得到待酶解体系液;取待酶解体系液(m),加入盐酸溶液,水解后,使用柱前衍生-高效液相色谱法测定水解液中Hyp的质量浓度,得到酶解前待酶解体系液中Hyp的质量浓度。
1.4.1.2.2 酶解
将待酶解体系液置于恒温振荡条件下进行酶解反应;分别对酶解时间(0~48 h)[15]、酶与底物比例(根据阿拉丁试剂的推荐配置比例选取1∶20、1∶50和1∶100 )和酶解温度(20、25、30 ℃)这三个因素进行探索。
1.4.1.2.3 酶解后的处理
取酶解后溶液(m),加入质量比为1∶0.5的4 ℃的30%的TCA溶液,以保证TCA溶液的终质量浓度为10%,混匀后,在4 ℃,5 000 rpm离心10 min。弃去上清液,用4 ℃的5%TCA溶液清洗沉淀表面3次后,加入盐酸溶液,水解,同上方法测定沉淀样品中Hyp的质量浓度,得到酶解后沉淀样品中Hyp的质量浓度。
1.4.1.2.4 降解率的计算
明胶的降解率以Hyp的剩余率表示,明胶的降解率按式(3)计算:
(3)
式中:Y为明胶的降解率,单位为%;X1为酶解前待酶解体系液中Hyp的质量浓度,单位为mg/g,X2为酶解后沉淀样品中Hyp的质量浓度,单位为mg/g。
特别的,由于牛筋胶原蛋白的热变性温度约为41 ℃[16],对热较为敏感,因此有必要对酶解的温度进行探索。试验如下:分别取胶原蛋白液和明胶液,加入胰蛋白酶液后,置于25、30、37 ℃恒温振荡酶解反应,结合蛋白电泳(SDS-PAGE)方法对酶解前后胶原蛋白和明胶进行分析。
1.4.1.3 柱前衍生-高效液相色谱法测定Hyp的质量浓度
1.4.1.3.1 Hyp的衍生处理
Hyp的衍生及内标AABA的使用参照Waters衍生试剂盒说明书。
1.4.1.3.2 色谱条件
色谱柱:Waters AccQ·TagTM (3.9×150 mm);柱温:37 ℃;进样量:10 μL;流速:1 mL/min。流动相梯度如下表1所示。使用内标法计算Hyp的含量,Hyp及AABA的液相色谱图如图1所示。
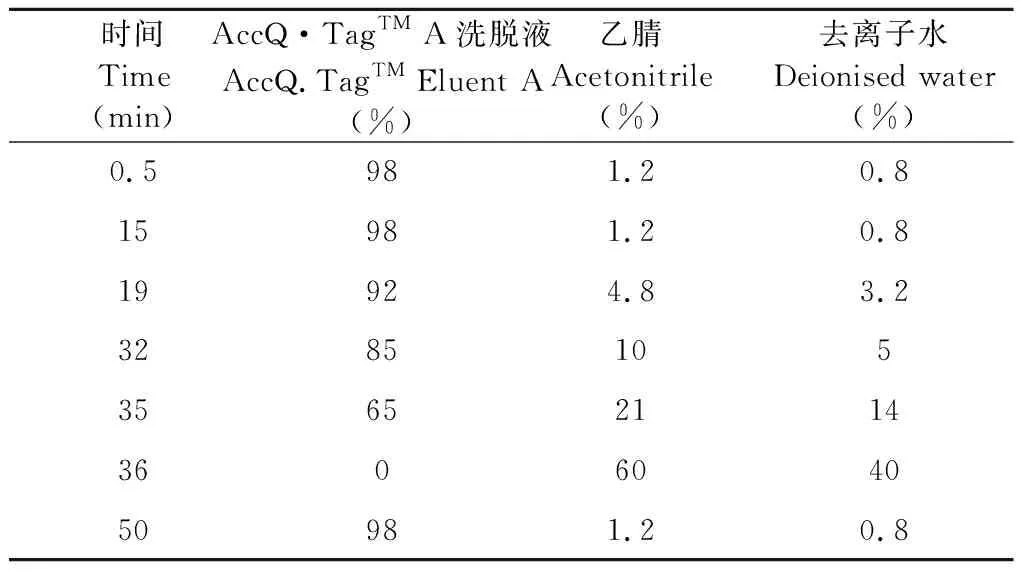
表1 梯度洗脱条件
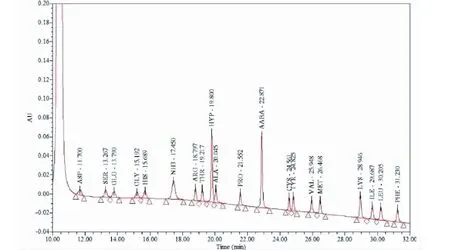
图1 十八种氨基酸及AABA的液相色谱图Fig.1 Liquid chromatography of 18 amino acids and AABA
1.4.2 胶原蛋白溶液体系中三股螺旋结构质量分数的测定
使用上述1.4.1所建立的方法,对明胶胶原混合液、不同提取批次的胶原蛋白液,和不同纯化处理后的胶原蛋白液这三种样品(三种样品的制备如下表2所示)中的三股螺旋结构进行检测。此外,为了验证所建立的方法与现用方法的差异,使用CD法[17]和FTIR法[18]分别对不同提取批次(A、B和C)的胶原蛋白液的结构进行测定,获得胶原蛋白的二级结构特征吸收峰数据,与所建立的方法进行对比。
胶原蛋白三股螺旋结构的质量分数按式(4)计算:
(4)
式中:NC为样品中胶原蛋白三股螺旋结构的质量分数,单位为%;X1为酶解前待酶解体系液中Hyp的质量浓度,X2为酶解后沉淀样品中Hyp的质量浓度,单位为mg/g。

表2 不同提取时间胶原蛋白中羟脯氨酸的质量浓度
1.5 数据分析
每个样品设3个平行,采用Origin 8.0和SPSS 19软件进行数据分析,采用Tukey法对不同样品平均值进行方差分析,求出显著性差异,方差分析置信度为95%。
2 结果与讨论
2.1 胶原蛋白三螺旋结构质量分数测定的方法建立
2.1.1 TCA质量分数、离心转速对蛋白质沉淀率的影响
图1是不同的TCA质量分数和离心转速时明胶和胶原蛋白沉淀率的变化图。TCA是一种良好的沉淀剂,能分离溶液中的大分子蛋白和多肽及氨基酸。在TCA溶液体系中,蛋白质分子相互聚集而沉淀,溶解度表现最小[19]。从图2可知,随着TCA质量分数的增大,明胶或胶原蛋白的沉淀率均增大并最终达到最大——当TCA的质量分数为5%时,明胶的沉淀率为39.04%;当TCA浓度为10%和15%时,明胶的沉淀率分别为69.49%和70.22%,两者没有显著性差异。当TCA的质量分数为5%时,胶原蛋白的沉淀率为37.58%;而当TCA浓度为10%和15%时,胶原蛋白的沉淀率分别为89.74%和91.48%,两者没有显著性差异。随着离心转速的增大,明胶或胶原蛋白的沉淀率也呈现相似的规律,当离心转速为5 000 rpm时,明胶和胶原蛋白的沉淀率分别为70.22%和91.34%,两者均与离心转速为8 000 rpm时蛋白质的沉淀率无显著性差异。此外,对比相同的沉淀条件(如相同的TCA质量分数或离心转速),明胶的沉淀率较胶原蛋白的沉淀率低,这是因为,明胶中的分子量较小的多肽不能被TCA沉淀而保留在上清液。综合图2可得到,质量分数为10%的TCA溶液,在5 000 rpm离心转速下,足以将溶液中的蛋白质和分子量较小的多肽分离。

图2 TCA的质量分数(A)和离心转速(B)对明胶和胶原蛋白沉淀率的影响Fig.2 Effects of mass fraction of TCA (A) and centrifugal speed (B) on the yield of gelatin and collagen sediment注:不同小写字母a-b表示明胶的蛋白沉淀率在不同TCA质量分数或不同离心转速处理后,具有显著性差异(P<0.05,n=3);不同大写字母A-B表示胶原蛋白的蛋白沉淀率在不同TCA质量分数或不同离心转速处理后,具有显著性差异(P<0.05,n=3)。Note∶Different lower-case letters a-b means gelatin treated by different mass fraction of TCA or centrifugal speed indicated significant difference (P<0.05,n=3);Different uper-case letters A-B means gelatin treated by different mass fraction of TCA or centrifugal speed indicated significant difference (P<0.05,n=3).
2.1.2 胰蛋白酶酶解条件对明胶降解率的影响
2.1.2.1 酶解时间和酶与底物比例对明胶降解率的影响
胰蛋白酶能酶解三螺旋结构被破坏的胶原蛋白,能稳定的作用于明胶分子链中的赖氨酸和精氨酸,使明胶酶解为多肽或者氨基酸[20]。以明胶作为胰蛋白酶酶解底物评价不同酶用量对明胶酶解反应体系的影响,如图3所示。图3-A是当胰蛋白酶与明胶的比例为1∶50、酶解温度为25 ℃时不同酶解时间的明胶降解率,随着酶解时间的延长,明胶的降解率呈先缓慢增加到最大再维持不变的趋势,且当酶解时间为3 h时,明胶的降解率达到最大,约为91.61%。图3-B是不同酶与底物的比例对明胶的降解率的影响。由图可知,当酶的用量为1∶20时,随着酶解时间的延长(0.5~6 h),明胶的降解率维持在82%到88%之间,提高酶的用量(从1∶50到1∶20)有利于酶解反应的进行。当酶与底物的比例为1∶100时,相同时间的降解率相对标准偏差较大(如当酶解时间为4和5 h时,明胶降解率的相对标准偏差分别为12.98%和10.38%),且明胶的降解率变化趋势不规律。这可能是因为当胰蛋白酶的用量较少时,酶解反应体系会不稳定。综合图3可得,当胰蛋白酶与底物为1∶50时,3 h能将明胶体系完全降解。
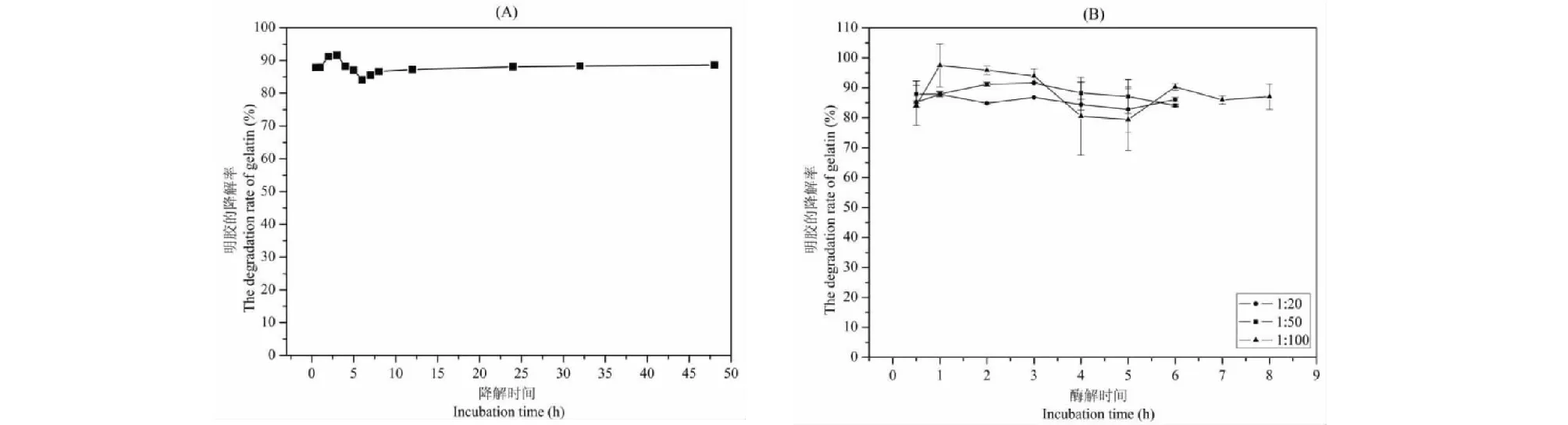
图3 酶解时间(A)和酶与底物的比例(B)对明胶降解率的影响Fig.3 Effects of incubation time (A) and enzyme/substrate ratio (B) on the degradation rate of gelatin
2.1.2.2 酶解温度对明胶降解率的影响
胶原蛋白具有热不稳定性的特征,酶解温度的确定是该方法建立的关键影响因素之一。图4是酶解温度分别为20、25、30 ℃时明胶的降解率图。如图所示,当酶解温度为20 ℃时,明胶的降解率逐渐增大,直至5 h才达到最大,约为92.68%;而当酶解温度为30 ℃时,在1~6 h内,明胶的降解率由70.17%逐渐增大至99.67%,这可能是因为在30 ℃时,随着酶解时间的增加,明胶液中未破坏的三股螺旋结构也遭到一定程度的破坏;但当酶温度为25 ℃时,明胶的降解率在3 h内达到最大,约为91.61%。从不同酶解温度处理的明胶和胶原蛋白电泳图(图5)中也发现,在25 ℃和30 ℃时(图5-A和图5-C),胶原蛋白的α、β条带的颜色深度和位置均未有明显的变化;而明胶在25 ℃酶解时(图5-B),随着酶解时间的延长,分子量较大的α链条带其以下的条带逐渐消失;这表明30 ℃及其以下的温度,酶解后胶原蛋白的三股螺旋结构不会发生改变;而在30 ℃酶解时,明胶中部分的完整的三股螺旋结构会遭到破坏。从图5-D发现,当酶解温度为37 ℃时,随着酶解时间的延长,胶原蛋白的α、β链条带的颜色逐渐变浅,这是因为在37 ℃酶解时,胶原蛋白的完整三股螺旋结构遭到破坏,致使胰蛋白酶作用三股螺旋结构破坏的胶原蛋白。综上所述,一方面,37 ℃及其以上的温度会使胶原蛋白的三螺旋结构破坏,而30 ℃会破坏明胶中存在的三股螺旋结构;另一方面,较低的温度(如20 ℃及其以下的温度),酶解反应的速率会较慢。因此,选择25 ℃为该方法的最适酶解温度。综合2.1.2所述,为了保证胶原蛋白体系酶解反应的完全,胰蛋白酶酶解反应体系的最适条件为25 ℃,胰蛋白酶与底物的比例为1∶50时,酶解3 h即可将胶原蛋白溶液体系中三股螺旋结构破坏的成分酶解完全。
2.2 胶原蛋白溶液体系中三股螺旋结构质量分数的测定
2.2.1 明胶胶原混合体系中胶原蛋白三股螺旋结构的质量分数测定
明胶是胶原蛋白三螺旋结构破坏后的产物,使用所建立的方法测定明胶胶原的混合体系中三螺旋结构的质量分数,以表征该方法对复杂的含胶原蛋白三股螺旋结构的溶液体系的适应性。如表3所示,当明胶胶原混合体系中胶原蛋白的质量分数为80%、50%、40%、20%和0%时,使用所建立的方法测得的混合液中三股螺旋结构的胶原蛋白质量分数分别为76.97%、50.03%、33.67%、12.38%和3.84%;测定的不同质量分数梯度的胶原蛋白的混合液,均具有显著性差异。从测定结果发现,当胶原蛋白的百分含量分别为80%、40%和20%时,所测得的结果较理论值小,而当胶原的百分含量为50%和0%时,所测得的结果较理论值大,这可能是因为胶原蛋白的三股螺旋结构在提取过程中有所破坏,导致在混合体系中测出的结果出现偏差。综上所得,使用所建立的方法能较准确的得到不同比例的明胶胶原混合体系中三股螺旋结构的质量分数。

图4 不同酶解温度(20、25和30 ℃)下明胶的降解率酶解Fig.4 Degradation rate of gelatin incubated at different temperature (20,25 and 30 ℃)

图5 不同酶解温度(25、30和37 ℃)酶解处理(0~24 h)后胶原蛋白的电泳图Fig.5 SDS-PAGE patterns of proteins incubated in enzymatic treatment (0-24 h) at 25,30 and 37 ℃
2.2.2 不同提取批次的胶原蛋白中三股螺旋结构的质量分数测定
使用所建立的方法对相同方法不同提取批次的牛胶原蛋白液中的三股螺旋结构的质量分数进行测定(如表4所示)发现,提取批次A、B和C的胶原蛋白中三股螺旋结构的质量分数分别为89.48%、83.36%和85.37%,三股螺旋结构的含量均高于80%。而使用CD和FTIR法测定这三个提取批次胶原蛋白的结构发现:如图6-A所示,胶原蛋白在198 nm处有一负吸收,在222 nm处有一正吸收,符合胶原蛋白的典型吸收波长,说明胶原蛋白液的三股螺旋结构较完整;从图6-B胶原蛋白FTIR图可知,胶原的酰胺II键(1 638 cm-1)及酰胺III键(1 239 cm-1)的吸收均符合胶原蛋白完整二级结构的特征吸收,说明胶原蛋白的三股螺旋结构相对完整。这与本方法所获得的结果较吻合。但CD和FTIR的方法均无法定量胶原蛋白三股螺旋结构的质量分数,而本方法能定量的判断其三股螺旋结构的质量分数,弥补了现有定性检测方法的不足。
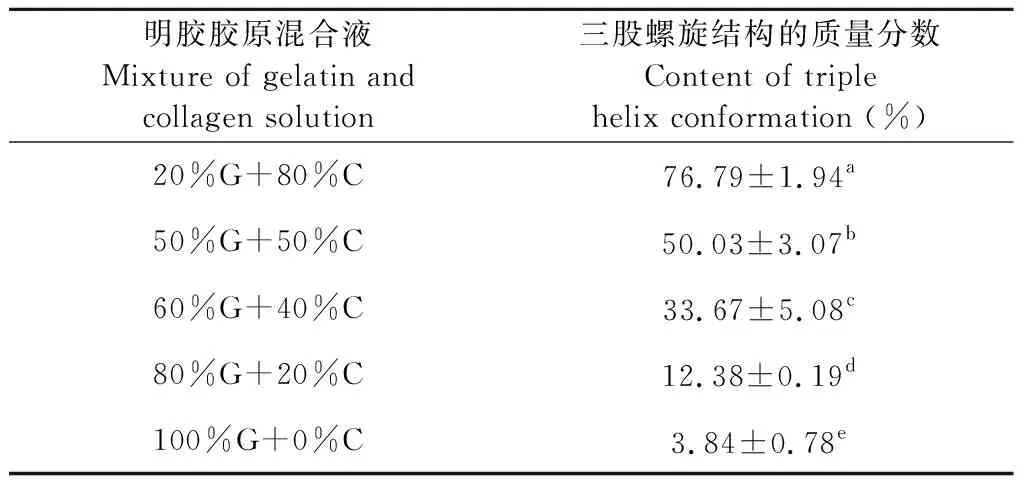
明胶胶原混合液Mixture of gelatin and collagen solution三股螺旋结构的质量分数Content of triple helix conformation (%)20%G+80%C76.79±1.94a50%G+50%C50.03±3.07b60%G+40%C33.67±5.08c80%G+20%C12.38±0.19d100%G+0%C3.84±0.78e
注:C为胶原蛋白溶液;G明胶液;数值后面不同的字母表示数值间有显著性差异(P<0.05)。
Note:C refered to collagen solutions;Grefered to gelatin solutions;values followed by different letters are significantly different (P<0.05).

提取批次Extraction batch三股螺旋结构的质量分数Content of triple helix conformation (%)A89.48±0.68aB83.36±1.98bC85.37±1.11b
注:数值后面不同的字母表示数值间有显著性差异(P<0.05)。
Note:Values followed by different letters are significantly different (P<0.05).
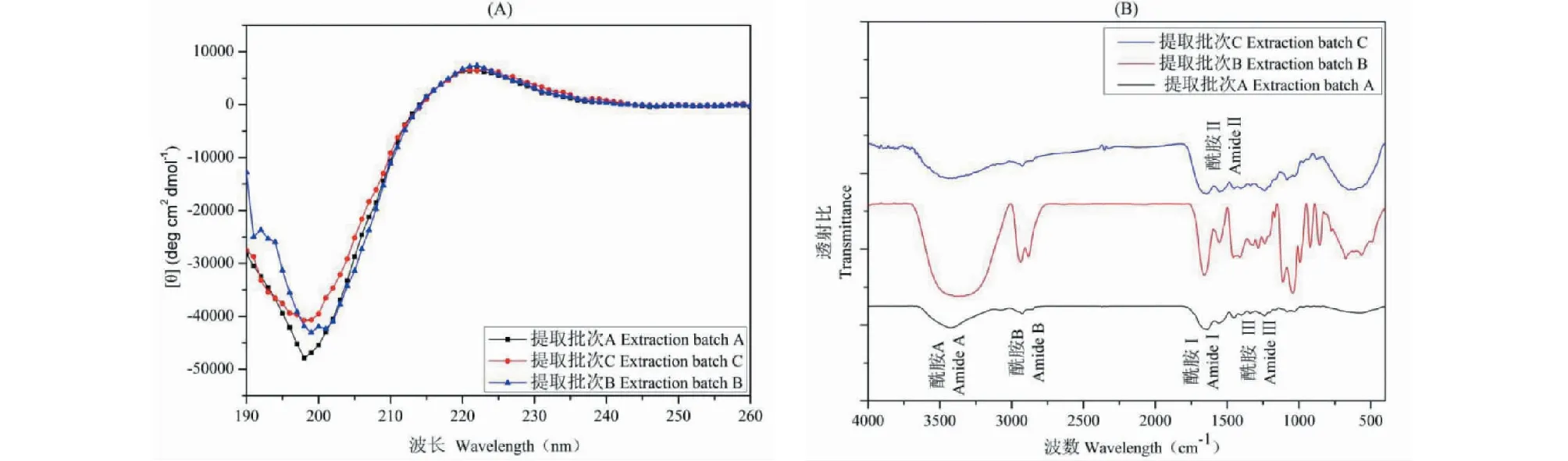
图6 胶原蛋白的圆二吸收光谱图(A)和红外吸收光谱图(B)Fig.6 CD(A)and FTIR(B)spectra of collagen
2.2.3 不同纯化处理的胶原蛋白三股螺旋结构的质量分数测定
目前,胶原蛋白提取后的纯化处理通常采用超滤和透析这两种方法,使用本研究所建立的方法测定不同纯化处理对胶原蛋白三股螺旋结构的影响可用于筛选合适的纯化处理方式。表5是三种纯化处理方式后胶原蛋白三股螺旋结构的质量分数。如表5所示,经过超滤处理1后,胶原蛋白的三螺旋结构质量分数约为48.60%,远低于超滤处理2的处理(97.80%)和透析处理(95.18%),这表明超滤处理1该纯化处理会使胶原蛋白中部分三螺旋结构破坏。除此之外,该方法还可用于胶原蛋白生产制备时工艺的评价(该部分数据未列出)。因此研究所建立的方法可用于辅助测定胶原蛋白加工处理后三股螺旋结构变化,从而选择合适的处理方法。
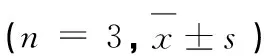
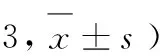

纯化方式Purification treatment三股螺旋结构的质量分数Content of triple helix conformation (%)超滤处理1Ultrafiltration treatment 148.60±0.56a超滤处理2Ultrafiltration treatment 297.80±9.86b透析处理Dialysis treatment95.18±8.98b
注:数值后面不同的字母表示数值间有显著性差异(P<0.05)。
Note:Values followed by different letters are significantly different (P<0.05).
本研究利用具有完整三股螺旋结构的胶原蛋白不能被胰蛋白酶酶解,而三股螺旋结构破坏或部分破坏的胶原蛋白能被胰蛋白酶酶解的原理,建立胶原蛋白三股螺旋结构的检测方法。如图7所示,加入胰蛋白酶酶解胶原溶液体系,通过TCA沉淀分离酶解后体系中的胶原蛋白和多肽,测定酶解前后体系中胶原蛋白的特征氨基酸——Hyp的质量浓度变化,从而得到胶原蛋白三股螺旋结构的质量分数。

图7 利用胰蛋白酶酶解法检测胶原蛋白三股螺旋结构示意图Fig.7 Schematic illustration of determination triple helix conformation of collagen through trypsin digestion
3 结论
三股螺旋结构是胶原蛋白生物活性的一个重要标志,是其发挥功能特性的前提。在生物医学、生物医药、生物工程等领域中通常需要对胶原蛋白三股螺旋结构的质量分数进行测定。现今胶原蛋白三股螺旋结构的检测一般使用光谱法,这些方法只能定性的检测三股螺旋结构是否破坏。而本研究利用完整螺旋结构的胶原蛋白对胰蛋白酶的耐受性建立了胶原蛋白三股螺旋结构质量分数的定量检测方法。一方面,利用胰蛋白酶(胰蛋白酶/底物=1∶50)在25 ℃下,酶解处理3 h,使三股螺旋结构破坏的胶原蛋白酶解为分子量较小的多肽,另一方面,使用质量分数为10%的TCA溶液分离酶解后的小分子多肽及含有完整螺旋结构的胶原蛋白。通过使用柱前衍生高效液相色谱法测定酶解前后胶原蛋白复杂体系中羟脯氨酸的含量,从而获得胶原蛋白三股螺旋结构的质量分数。该方法可有效应用于胶原蛋白制备、加工及胶原蛋白产品等含胶原蛋白复杂体系中三股螺旋结构含量的测定。
