川陈皮素对糖尿病肾病大鼠的治疗作用研究
2019-09-05武俊紫胡冬雄贾亚敏和凤军杨榆青
武俊紫,侯 伟,胡冬雄,赵 微,贾亚敏,和凤军,宋 波*,杨榆青*
1云南中医药大学基础医学院,昆明 650504;2太原理工大学水利科学与工程学院,太原 030024
近年来随着人们生活方式和饮食结构的改变,糖尿病发生率逐年升高[1]。糖尿病肾病(diabetic nephropathy,DN)作为糖尿病最常见的微血管病变之一,不仅可造成肾损害,也可累及其他脏器,因此需积极关注。川陈皮素是中药陈皮中有效活性药理成分之一,其来源广泛,具有广谱抗菌、抗癌以及消炎等多种药理活性[2]。目前关于川陈皮素对糖尿病肾病的研究还没有文献报道,但是陈皮提取物的研究已有文献报道,如钟志华等[3]采用金柚提取物(含有川陈皮素)治疗糖尿病肾病大鼠,发现其对糖尿病肾病大鼠具有很好的保护作用,并分析其作用机理可能和p38 MAPK/NF-κB P65信号通路有关。此外,何伟等[4]采用橙皮苷(陈皮的另一种有效药理成分)治疗糖尿病肾病大鼠,也发现其对肾功能具有很好的保护作用。基于上述推测,川陈皮素可能对其也具有一定的保护作用,为此,本研究构建了糖尿病肾病大鼠模型,观察川陈皮素的治疗效果,为糖尿病肾病的治疗和川陈皮素的开发提供参考。
1 材料和方法
1.1 动物、试剂及仪器
1.1.1 实验动物
雄性清洁级SD大鼠120只(6~7周龄),体重180±20 g,(动物许可证号:SCXK-(云) 2011-004),购于昆明医科大学动物实验中心,普通饲料和高脂饲料(许可证号:苏饲证(2018)10030)购于昆明医科大学动物实验中心。大鼠购买后饲养于云南中医药大学动物实验中心,饲养环境为温度22~26 ℃,湿度40%~60%,光照/黑暗=12/12 h。
1.1.2 药物、试剂和试剂盒
川陈皮素(陕西永健生物工程科技有限公司,批号:170719);贝那普利(北京诺华制药有限公司,国药准字H20030514); 链脲佐菌素(streptozocin,STZ,美国Sigma公司,批号:170224);尿蛋白定量试剂盒、尿肌酐试剂盒、血肌酐试剂盒和血尿素氮测定试剂盒(南京建成生物工程研究所,批号分别为:170321、170324、170112和170402);胰岛素、总胆固醇和甘油三脂试剂盒(北京普利莱基因技术有限公司,批号分别为:170423、170312和170506);兔抗大鼠Bcl-2多克隆抗体、兔抗大鼠Bax多克隆抗体、兔抗大鼠caspase-3多克隆抗体以及兔抗大鼠单克隆抗体β-actin (美国Santa公司,批号分别为: C2342、C2351、C3104和C2019);生物素化山羊抗兔IgG抗体和DAB显色试剂盒(北京中衫金桥生物技术有限公司,批号ZB-2305);RNA引物(上海生物生工设计和生产,批号:171105);IL-1、IL-6和TNF-α测定试剂盒(武汉博士德生物科技公司,批号分别为:170614、170622和170524)。
1.1.3 主要实验仪器
酶标仪(PT-3502,北京普天新桥技术有限公司);分光光度计(752N,上海精密科学仪器有限公司);血糖测定仪(安稳免调码型,三诺生物传感股份有限公司);光学显微镜(XSP-9CA,上海光学仪器厂);电热鼓风干燥箱(101-0ab,上海徐吉电气有限公司);低温高速离心机(TG16-WS型,常州市万合仪器制造有限公司);超低温冰箱(DW-86L288,海尔集团);电子分析天平(HZK-110型,赛恩斯仪器设备有限公司);蛋白电泳仪(Mini-PROTEAN Tetra,美国伯乐);实时荧光定量PCR仪(StepOne TM,美国应用生物系统公司)。
1.2 方法
1.2.1 模型构建
大鼠在购买后先给予适应性喂养2周,2周后随机选取20只作为正常组,其余100只给予高脂高糖饲料喂养1月,之后给予腹腔一次性注射STZ 30 mg/kg造模,STZ注射1周后检验造模是否成功,糖尿病造模成功标准参照文献[5]进行。
1.2.2 分组及给药
造模成功后,随机选取50只按照随机数字法分为:(1)模型对照组(生理盐水1 mL/kg灌胃);(2)川陈皮素低剂量组(100 mg/mL/kg/天 川陈皮素灌胃);(3)川陈皮素中剂量组(200 mg/mL/kg/天 川陈皮素灌胃);(4)川陈皮素高剂量组(400 mg/mL/kg/天 川陈皮素灌胃);(5)贝那普利组(4 mg/mL/kg/天 贝那普利灌胃),另挑选正常大鼠10只作为正常组(生理盐水1 mL/kg灌胃),连续给药6周,(川陈皮素给药剂量根据文献确定[6])6周后处死大鼠,处死前一天大鼠置入代谢笼收集尿液,次日10%水合氯醛 0.3 mL/100 g麻醉后固定于解剖板,腹主动脉取血;血液收集后剖取肾脏,检测下述相关指标的变化特点。
1.3 观察指标
1.3.1 一般情况
实验期间记录大鼠一般情况,包括饮食状态、大小便特点、毛色、精神活动量以及死亡情况等。
1.3.2 血糖和胰岛素
血糖的测定采用血糖仪测定,胰岛素的测定采用胰岛素试剂盒,胰岛素测定的检测仪器为分光光度计。
1.3.3 24小时蛋白尿定量和尿液以及肾功能指标
24 h尿蛋白定量、尿肌酐、血肌酐和血尿素氮测定采用相应试剂盒进行,检测仪器为分光光度计。
1.3.4 炎性因子指标
炎性因子指标的测定采用对应试剂盒进行,检测仪器酶标仪。
1.3.5 血脂指标
总胆固醇和甘油三脂的测定方法为Elisa法,检测仪器为酶标仪。
1.3.6 组织病理学
组织病理学检测采用HE 染色法:中性福尔马林溶液固定48 h后,切取一小块用石蜡包埋,切成3~5 μm左右薄片,之后脱蜡冲洗,苏木精和伊红依次染色,封固,完成后照相采集图片,每张片随机选取4个不同的视野。
1.3.7 蛋白表达
称取100 mg肾脏组织用组织裂解液裂解后,4 ℃ 12 000 rpm离心10 min,后收集上清用BCA法对蛋白进行定量并调平。调平后每组各取50 μg行SDS-PAGE凝胶电泳,完成后将目的蛋白转移到PVDF膜,加入脱脂牛奶封闭2 h,后加入1抗过夜,次日取出加入2抗1 h,洗涤三次后暗室曝光洗片扫描仪扫描收集图像即可。
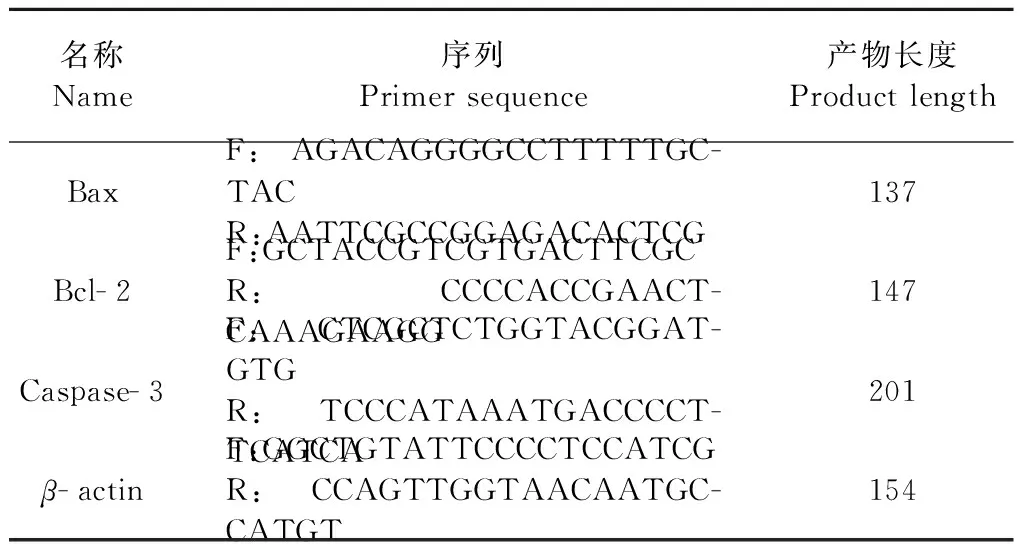
表1 引物序列设计表
1.3.8 mRNA表达
用天根总RNA试剂盒提取各组大鼠总RNA后定量并调平,然后将其逆转录为cDNA,逆转录完成后,每组取2 μg行实时荧光定量PCR扩增反应,扩增条件:95 ℃ 2 min、94 ℃ 10 s、60 ℃ 10 s、72 ℃ 40 s,循环次数36次。分析方法选用2-ΔΔCt法,引物序列如下表1所示:
1.4 统计学处理

2 结果
2.1 一般情况
正常组大鼠毛色发白发亮,精神活跃、饮食、大小便均正常。模型组毛色发黄灰暗、精神相对萎靡、尿液量多且明显发臭。相较于模型组,贝那普利组和川陈皮素三个剂量组有明显改善。在整个治疗期间,正常组、模型组、贝那普利组、川陈皮素低、中和高剂量组分别死亡0、2、1、1、0、1 只。
在整个治疗期间,与正常组相比,模型组、贝那普利组、川陈皮素低、中和高剂量组体重均明显降低(P<0.05),治疗0周时模型组和贝那普利组、川陈皮素低、中和高剂量组没有差异。治疗2周后,贝那普利组和川陈皮素高剂量组明显高于模型组(P<0.05),治疗4周和6周后,贝那普利组、川陈皮素中剂量和高剂量组明显高于模型组(P<0.05),详见表2。

表2 药物治疗后大鼠体重变化
注:表2和表4,与正常组相比,*P< 0.05;与模型组相比,#P< 0.05。
Note:Table 2 and Table 4,compared with normal group,*P< 0.05;compared with model group,#P< 0.05.
2.2 肾脏组织病理学结果
肾脏组织病理学结果可见,正常组切片肾小球正常,没有明显病理损害特征,而模型组则出现明显肾小球增大,同时可见有部分的系膜增生和间质纤维化(图中箭头处为肾小球增大,同时系膜增生位置),贝那普利组和川陈皮素三个剂量组相较于模型组肾小球病变减轻,系膜增生和间质纤维化也没有模型组严重,详见图1。
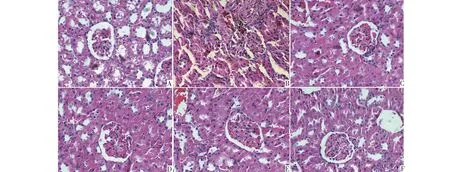
图1 各组大鼠肾脏组织HE染色结果(×400)Fig.1 HE staining results of kidney tissues (×400)注:图中A、B、C、D、E和F分别为正常组、模型组、贝那普利组以及川陈皮素低、中和高剂量组。Note:A,B,C,D,E and F are the normal group,the model group,the benazepril group and the low,medium and high dose nobiletin group in the figure.
2.3 尿液肾功能指标
各组大鼠尿肌酐(Urine Creatinine,UCr)和24 h蛋白尿定量比较,与正常组相比,模型组二者均明显升高(P<0.05),与模型组相比,贝那普利组和川陈皮素低、中、高剂量组二者均明显降低(P<0.05),此外川陈皮素高剂量组24 h蛋白尿定量明显低于贝那普利组(P<0.05),UCr则没有统计学差异(P>0.05),详见表3。
表3 各组大鼠尿肌酐(UCr)和24h蛋白尿定量比较
注:表3、表5、表6、表7、表8和表9,与正常组相比,*P< 0.05;与模型组相比,#P< 0.05;与贝那普利组相比,^P< 0.05。
Note:Table 3,Table 5,Table 6,Table 7,Table 8 and Table 9,compared with normal group,*P< 0.05;compared with model group,#P< 0.05;compared with benazepril group,^P< 0.05.
2.4 血液肾功能指标比较
各组大鼠肾功能指标血清肌酐(serum creatinine,Scr)和血清尿素氮(Blood Urea Nitrogen,BUN)比较,与正常组相比,模型组BUN和Scr均明显升高(P<0.05);与模型组相比,贝那普利组和川陈皮素低、中和高剂量组BUN和Scr均明显降低(P<0.05);此外川陈皮素三个剂量组和贝那普利组相比并没有差异(P>0.05),详见表4。
2.5 血糖和胰岛素
各组大鼠血糖和胰岛素比较,与正常组相比,模型组血糖明显升高(P<0.05),胰岛素明显降低(P<0.05);与模型组相比,贝那普利组和川陈皮素低、中和高剂量组血糖降低(P<0.05),胰岛素水平升高(P<0.05);此外川陈皮素三个剂量组血糖明显低于贝那普利组(P<0.05),胰岛素明显高于贝那普利组(P<0.05),详见表5。
表4 各组大鼠肾功能指标BUN和Scr比较
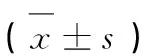
表5 各组大鼠血糖和胰岛素水平比较
2.6 血脂
各组大鼠血脂指标总胆固醇(Total Cholesterol,TC)与甘油三酯(Triglyceride,TG)比较,与正常组相比,模型组TG和TC均明显升高(P<0.05);与模型组相比,贝那普利组和川陈皮素低、中和高剂量组TG和TC均明显降低(P<0.05);此外川陈皮素三个剂量组TG和TC明显低于贝那普利组(P<0.05),详见表6。
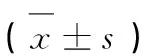
表6 各组大鼠血脂指标TG和TC比较
2.7 各组大鼠炎性因子比较
各组大鼠血清炎性因子指标白介素-1(Interleukin-1,IL-1)、白介素-6(Interleukin-6,IL-6)和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)比较,与正常组相比,模型组上述三个指标均明显升高(P<0.05);与模型组相比,贝那普利组和川陈皮素低、中和高剂量组均明显降低(P<0.05);此外川陈皮素高剂量组明显低于贝那普利组(P<0.05),详见表7。
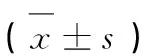
表7 各组大鼠炎性因子比较
2.8 凋亡相关蛋白和mRNA的表达
各组大鼠肾脏组织中B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)的蛋白质和半胱氨酸天冬氨酸蛋白酶-3(Cysteinyl aspartate specific proteinase,Caspase-3)蛋白及mRNA表达量比较,与正常组相比,模型组Bax和Caspase-3明显升高(P<0.05),Bcl-2明显降低(P<0.05);与模型组相比,贝那普利组和川陈皮素低、中、高剂量组Bax和Caspase-3 明显降低(P<0.05),Bcl-2 明显升高(P<0.05);此外川陈皮素三个剂量组Bax和Caspase-3明显低于贝那普利组(P<0.05),川陈皮素中剂量和高剂量组Bcl-2明显高于贝那普利组(P<0.05),详见图2、表8和表9。
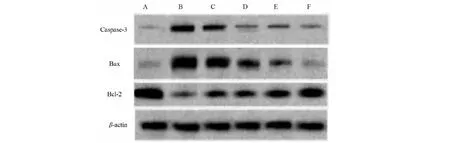
图2 大鼠肾脏组织中Bcl-2、Bax和Caspase-3蛋白表达图Fig.2 The protein expression of Bcl-2,Bax and Caspase-3 注:图中A、B、C、D、E和F分别为正常组、模型组、贝那普利组以及川陈皮素低、中和高剂量组。Note:A,B,C,D,E and F are the normal group,the model group,the benazepril group and the low,medium and high dose nobiletin group in the figure.
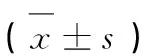
表8 各组大鼠肾脏组织中Bcl-2、Bax和Caspase-3蛋白的相对表达量
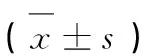
表9 各组大鼠肾脏组织中凋亡相关Bcl-2、Bax和Caspase-3的mRNA表达结果
3 结论
基于传统中药学理论,采用现代化技术手段开发低毒和高效作用的中药单体对糖尿病肾病的治疗和我国中医药的发展具有重要的意义[7-9]。正如前言推测,川陈皮素对糖尿病肾病具有一定的保护作用,但作用机理未明。为此本研究构建了糖尿病肾病大鼠模型,从细胞凋亡途径观察川陈皮素对其的作用。结果从尿液肾功能指标和血液肾功能指标BUN、Scr、UCr 和24 h尿蛋白定量可看出,相较于正常组,模型组均BUN、Scr、UCr 和24 h尿蛋白定量均明显升高,这证明糖尿病肾病大鼠模型成功构建。采用川陈皮素治疗后,大鼠BUN、Scr、UCr 和24 h尿蛋白定量均降低,这证明了川陈皮素对糖尿病肾病具有调节作用。
关于DN的发病机制,目前的研究认为高血糖可能是其最直接的因素[10]。肾脏在长期高血糖的浸润下,可引起炎性细胞过量分泌,而炎性细胞可激活核因子、丝裂元活化蛋白激酶家族等多种炎性通路,诱发IL-1、IL-6和TNF-α等分泌[11-13]。本次研究发现,与模型组相比,贝那普利和川陈皮素均可有效降低血糖和炎性因子指标IL-1、IL-6和TNF-α,同时还可升高血清胰岛素含量,这提示川陈皮素对降低血糖、降低炎症反应和升高胰岛素方面具有明显优势。此外有文献报道[14]约有25%血糖控制良好的患者仍会发生DN,这提示高血糖并不是糖尿病肾病发生的唯一原因,可能存在其他因素造成糖尿病肾病的发生,其中高血脂可能是造成DN发生的关键。有研究显示,在对炎症因子的刺激方面,高血脂和高血糖具有相似性,高血脂也会造成炎性细胞在肾脏聚集,进而导致IL-1、IL-6和TNF-α等炎性因子的释放[15],为此本次研究考查了川陈皮素治疗后血脂TG和TC的变化特点,研究结果发现,与模型组相比,贝那普利组和川陈皮素低、中、高剂量组血清中TG和TC均明显降低,这提示川陈皮素对糖尿病肾病血脂具有明显的调控作用。在研究中同时发现贝那普利也可以降低血糖同时调节血脂,这与文献报道[16,17]有一定差异,分析原因可能是由于本研究中给予大鼠贝那普利灌胃,大鼠进食量有一定减少造成的,也可能是贝那普利有明显保护肾脏的作用,肾功能改善后,大鼠精神活动有明显增加,运动量的增加对糖尿病血糖降低是有一定作用的,但具体原因仍需要后续进一步研究证实。
除上述机制外,肾脏细胞凋亡也在糖尿病肾病的发生和发展中伴有重要作用[18,19]。肾脏细胞在凋亡初始就参与了糖尿病肾病的各个环节。在肾脏凋亡的发生过程中,Bcl-2蛋白家族在其中占有十分重要的地位, Bcl-2蛋白家族中Bcl-2/Bax的比值决定着细胞凋亡的走向,当Bcl-2/Bax比值上调时,可以抑制细胞凋亡;当Bcl-2/Bax比值下调时,则促进细胞凋亡[18]。除Bcl-2家族蛋白,Caspase-3蛋白也与糖尿病肾病肾脏凋亡密切相关[20,21]。因此本次研究观察了川陈皮素对上述三个蛋白Bcl-2、Bax和Caspase-3的影响,结果发现,与模型组相比,贝那普利组和川陈皮素低、中和高剂量组Bax和Caspase-3 明显降低,Bcl-2 明显升高,这提示川陈皮素在抗糖尿病肾病大鼠肾脏组织凋亡方面具有明显的优势,通过改善凋亡,进而保护肾脏组织。
综合提示,川陈皮素对对糖尿病肾病大鼠血液肾功能和尿液肾功能具有很好的改善作用,其作用机理可能与川陈皮素可降低血糖、升高胰岛素,同时调节血脂TG和TC,以及通过调控Bcl-2、Bax和Caspase-3蛋白和mRNA表达,进而抑制细胞凋亡有关。
