吸入用乙酰半胱氨酸溶液中有关物质的检测和质量评价
2019-09-04何文秀陆恩浩陈依婷沙先谊
何文秀 陆恩浩 陈依婷 沙先谊
乙酰半胱氨酸是L-半胱氨酸的天然衍生物,其 含有的活性巯基通过破坏黏液蛋白的二硫键,分解 痰液中的黏蛋白,还可提高纤毛清除力,利于痰液液化和咳出,是经典的化痰药物[1]。近年来研究发现乙酰半胱氨酸具有多种药理学作用,可通过清除自由基、抑制炎症反应、调节免疫和抗凋亡等机制,对心、肺、肝、肠和脑等组织器官产生广泛保护作用[2],已广泛应用于临床。吸入用乙酰半胱氨酸溶液是赞邦公司研发的吸入用祛痰药物,以乙酰半胱氨酸为主要成分,被世界卫生组织、美国心肺血液研究所等组织共同推荐作为治疗慢性阻塞性肺疾病(COPD)和肺纤维化的常规抗氧化药物。目前,国内已有多家企业上市该类型产品,但关于乙酰半胱氨酸吸入制剂的质量评价报道较少。本研究参考各国药典收载情况及原研厂质量标准,评价3 个厂家生产的吸入用乙酰半胱氨酸溶液制剂的有关物质与含量,旨在提供该制剂的关键质量评价方法,以期为临床合理用药提供依据。
1 材料与方法
1.1 材料
1.1.1 样品与试剂 吸入用乙酰半胱氨酸溶液(富露施,3 ml:0.3 g,意大利赞邦制药有限公司,批号28003590);吸入用乙酰半胱氨酸溶液(B 制剂,3 ml:0.3 g,批号1806075);吸入用乙酰半胱氨酸溶液(C制剂,3 ml:0.3 g,批号18080602);乙酰半胱氨酸标准对照品(纯度为99.8%,中国食品药品检定研究院);L-胱氨酸对照品(纯度>98%,大连美仑生物技术有限公司);L-半胱氨酸对照品(纯度>98%,大连美仑生物技术有限公司);甲醇和庚烷磺酸钠均为色谱纯,磷酸、氯化钠和磷酸二氢钠均为分析纯,水为纯水。
1.1.2 仪器 BS210S 和BT25S 分析天平(德国Sartorius 公司);DiKMA Spursil 5 μm C18 色谱柱(美国DiKMA 公司);Agilent 1260 高效液相色谱仪、Agilent OpenLab 色谱工作站。
1.2 实验方法
1.2.1 色谱条件 据吸入用乙酰半胱氨酸溶液进口质量标准中收载的乙酰半胱氨酸测定方法,使用高效液相色谱法测定。色谱柱:C18 反相柱(250 mm×4.6 mm,5 μm);流动相:庚烷磺酸钠-磷酸二氢钠缓冲液(pH 2.1)-甲醇(91︰9);柱温:40 ℃;检测波长:210 nm;流速:1.0 ml/min;进样量:20 μL;分析时间:25 min。
1.2.2 样品的配制 1)供试品溶液:取富露施1 支,取2.5 ml 置于10 ml 容量瓶,用流动相定容、摇匀;取3 ml 于25 ml 容量瓶,加入20%磷酸0.3 ml,用流动相定容、摇匀,依照有关物质测定色谱条件进样,作为稀释前样品;取适量上述溶液,用流动相稀释100 倍,依照有关物质测定色谱条件进样,作为稀释后样品。B、C 制剂的含量测定处理方法同富露施。2)对照品溶液(乙酰半胱氨酸):精密称取乙酰半胱氨酸标准对照品约7.5 mg,于25 ml容量瓶,用流动相定容,得乙酰半胱氨酸储备液(0.3 mg/ml)。3)对照品溶液(L-胱氨酸):精密称取L-胱氨酸标准对照品约7.5 mg,于25 ml 容量瓶,用流动相定容,得L-胱氨酸储备液(0.3 mg/ml)。4)对照品溶液(L-半胱氨酸):精密称取L-半胱氨酸标准对照品约7.5 mg,于25 ml 容量瓶,用流动相定容,得L-半胱氨酸储备液(0.3 mg/ml)。
1.2.3 3种制剂的有关物质测定 按稀释前后自身峰面积百分比法,计算1.2.2 项3 种供试品溶液中4 种代表性杂质含量和总杂含量。平行操作3 份,每份样品进样1 次。
1.2.4 不同放置条件下制剂中的有关物质测定 取光照10 d、40 ℃和60 ℃条件下保存10 d 的三种样品,依照1.2.2 项下方法处理,每种制剂均平行操作2 份,每份进样3 针,依照稀释前后自身峰面积百分比法计算各单杂和总杂含量。
2 结果
2.1 色谱峰定位
乙酰半胱氨酸、半胱氨酸和胱氨酸的相对保留时间(RRT)比值分别为1、1.7~1.8 和2.0~2.1,各成分的色谱峰理论板数、分离度、对称性均符合中华人民共和国药典2015 版药物分析方法的要求[3]。
2.2 各厂家乙酰半胱氨酸有关物质比较
分别按供试品溶液的配制方法处理各厂家乙酰半胱氨酸溶液,按上述色谱条件进样,记录色谱图,计算有关物质含量,结果见图1~3 和表1。采用自身对照法测定制剂中有关物质的结果表明:富露施、B 制剂与C 制剂中总杂分别为0.72%、1.30%和1.02,P<0.05;最大单杂(未知杂质2)分别为0.27%、0.93%与0.71%,P<0.05;半胱氨酸的含量分别为0.22%、0.08%与0.09%,P<0.05;3 种制剂均未检测到胱氨酸。
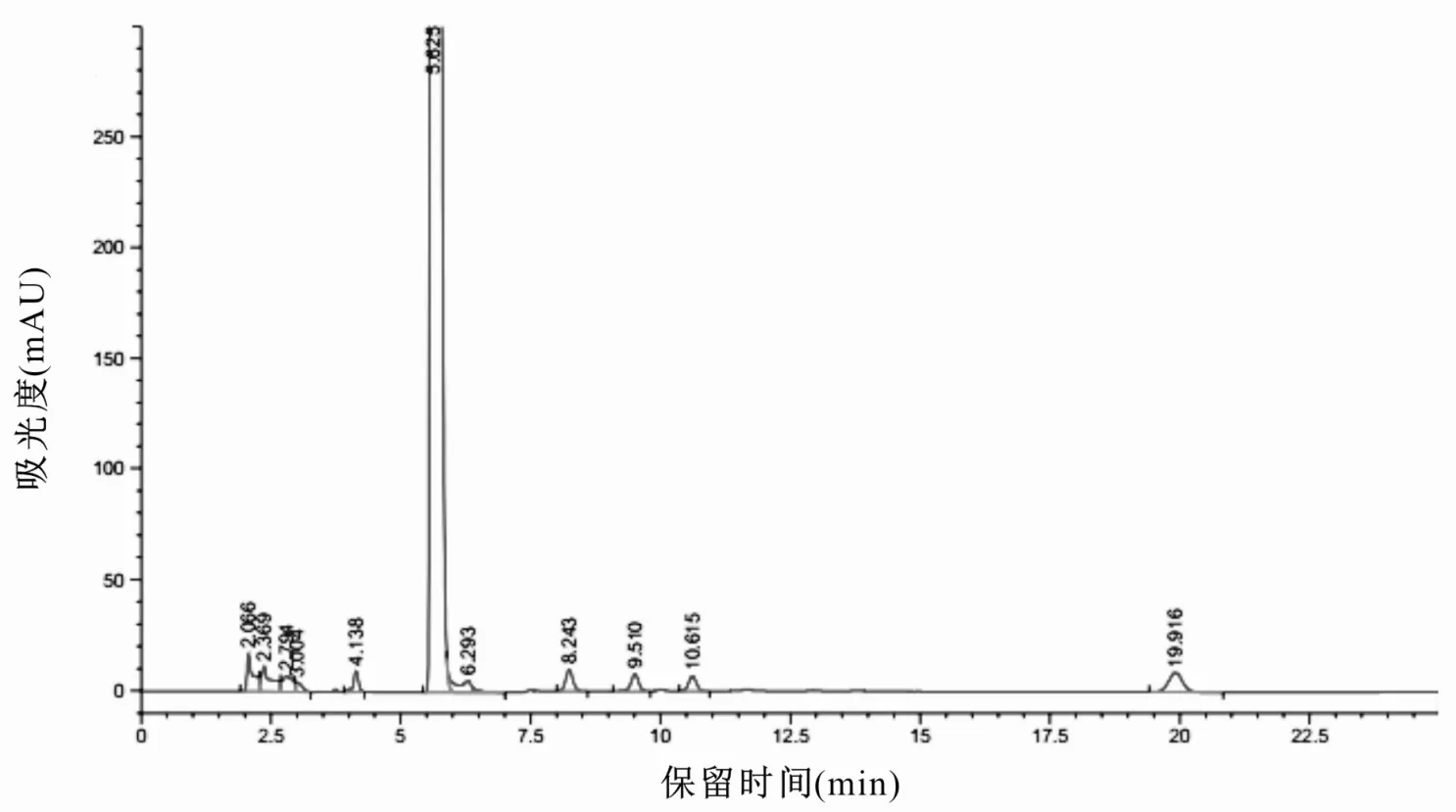
图1 富露施中有关物质测定色谱图
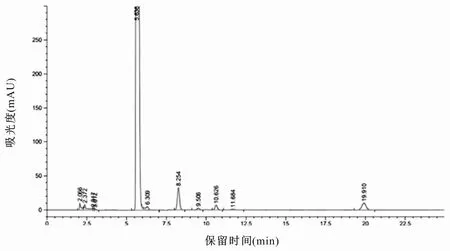
图2 B制剂中有关物质测定色谱图
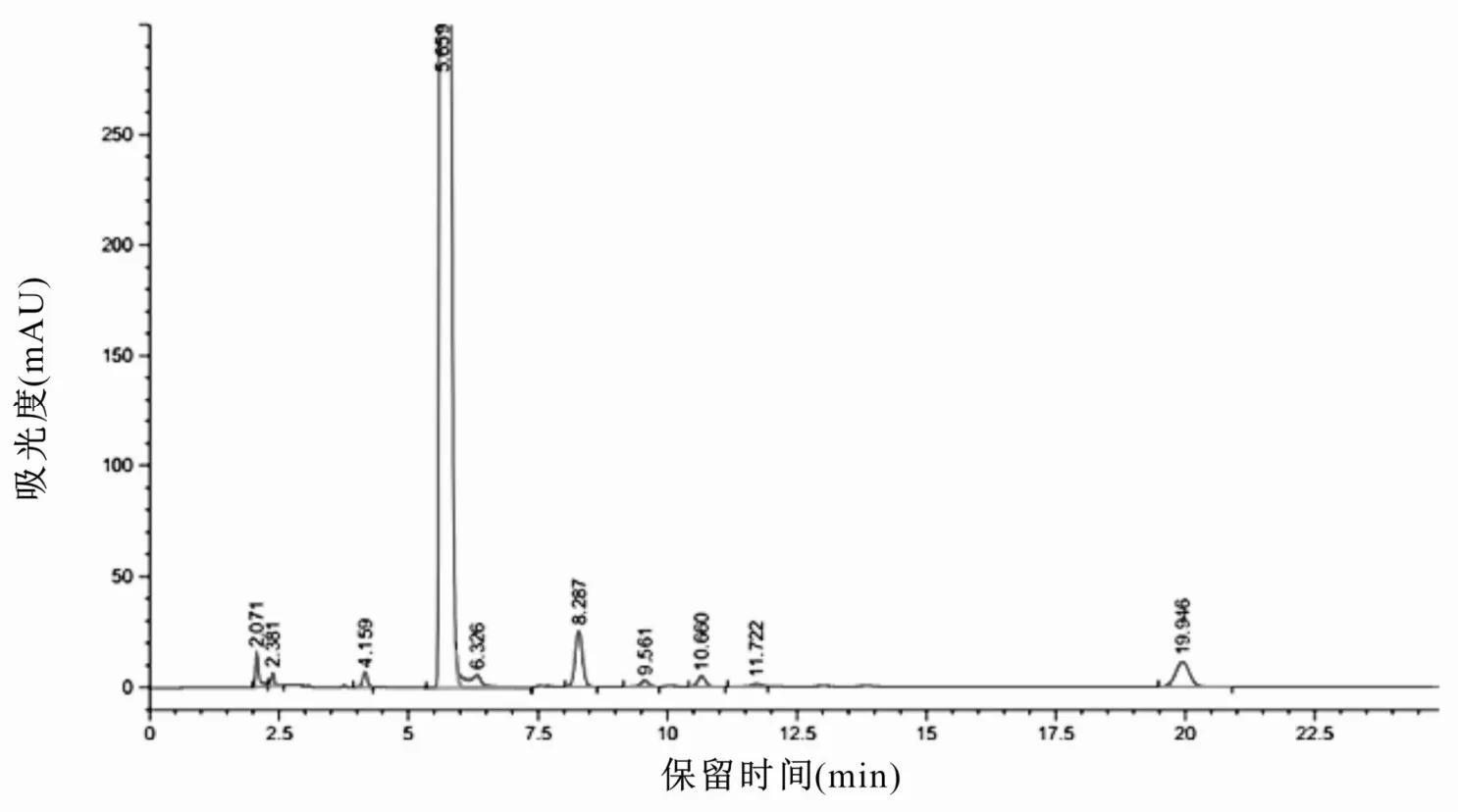
图3 C制剂中有关物质测定色谱图
2.5 不同放置条件下各厂家乙酰半胱氨酸吸入制剂有关物质比较
将3 个厂家的吸入用乙酰半胱酸溶液在不同条件保存10 d 后,分别测定制剂中的有关物质,结果表明,不同厂家的乙酰半胱氨酸吸入制剂的各单杂质和总杂质比较,差异有统计学意义(P<0.05)。见表2。在光照条件放置10 d 时,富露施、B 制剂与C制剂的总杂质分别为0.69%、1.65%和0.81%,P<0.05;未知杂质2 分别为0.27%、1.28%与0.05%,P<0.05;半胱氨酸分别为0.19%、0.07%与0.07%,P<0.05。在高温条件放置10 d 时,3 种制剂总杂质均有一定程度增加,均会产生杂质胱氨酸。
3 讨论
乙酸半胱氨酸为白色或类白色结晶性粉末,有类似蒜的臭味,在生产过程中容易引入胱氨酸、半胱氨酸、N,N’-二乙酰半胱氨酸、N,S-乙酰胱氨酸(本实验只对前两种杂质进行了确认)等相关杂质,因此在其质量评价中应考虑对其有关物质进行检测。本实验以富露施作为参比制剂,评价了不同 厂家生产的吸入用乙酰半胱氨酸制剂的含量和有关物质。研究结果表明,3 个厂家生产的吸入用乙酰半胱氨酸制剂中有关物质在总杂含量存在明显差异,富露施的未知杂质2 和总杂含量明显低于另外两种制剂。
药物杂质是药物中所含的影响药物自身纯度的物质,可能是药品生产和储存过程中受污染或药物理化性质发生改变所致。这些杂质一般与治疗作用无关,但却可能影响药物的药理活性或稳定性,从而造成药物效用偏差,甚至导致严重不良反应[4]。有研究认为,药品在临床中产生的不良反应与药品中的杂质有密切的关系[5-6]。各制剂中杂质差异的原因可能是不同生产厂家在起始原料、辅料的源头控制、制备工艺的过程控制、包装材料的优选等方面存在一定的差异[7]。虽然国产仿制药与原研药的主药成分是一致的,但不同仿制药厂家的原料生产和制剂工艺的不同,因此也会导致杂质种类和含量上的差异性。
本研究对不同厂家制剂在光照及高温条件下保存10 d 后有关物质含量变化进行了检测,结果显示3 个厂家制剂在高温条件下均有一定程度增加,且均含有胱氨酸。药品稳定性是衡量药品质量的重要标准之一,药品的安全性和有效性均是以稳定性为基础。在药品的物理、化学及生物不稳定性中,以化学不稳定性最为常见,其会对临床用药的安全性和疗效产生不良影响[8]。药品生产过程中的制剂处方工艺、原辅料控制、包材相容性等因素均可能影响药品贮存的稳定性[9],且相关研究表明,改进制备工艺可显著提高药品的稳定性[10-11]。原研制剂效期确定往往通过主要降解杂质临近限度值时的时间而定,基于三者在不同保存条件下的稳定性差异,可推测富露施与B、C 制剂比较保质期更长的原因可能是贮存包装材质的密封性、稳定性,或辅料的影响[7]。
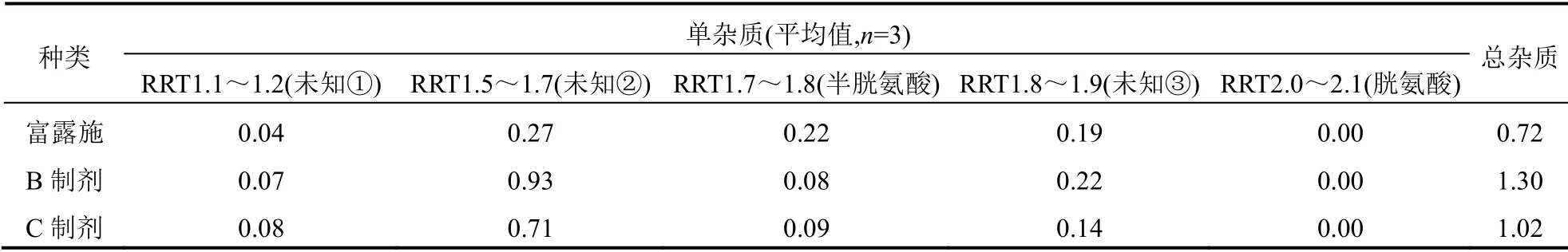
表1 参比制剂、B 制剂和C 制剂中可能杂质比较(%)
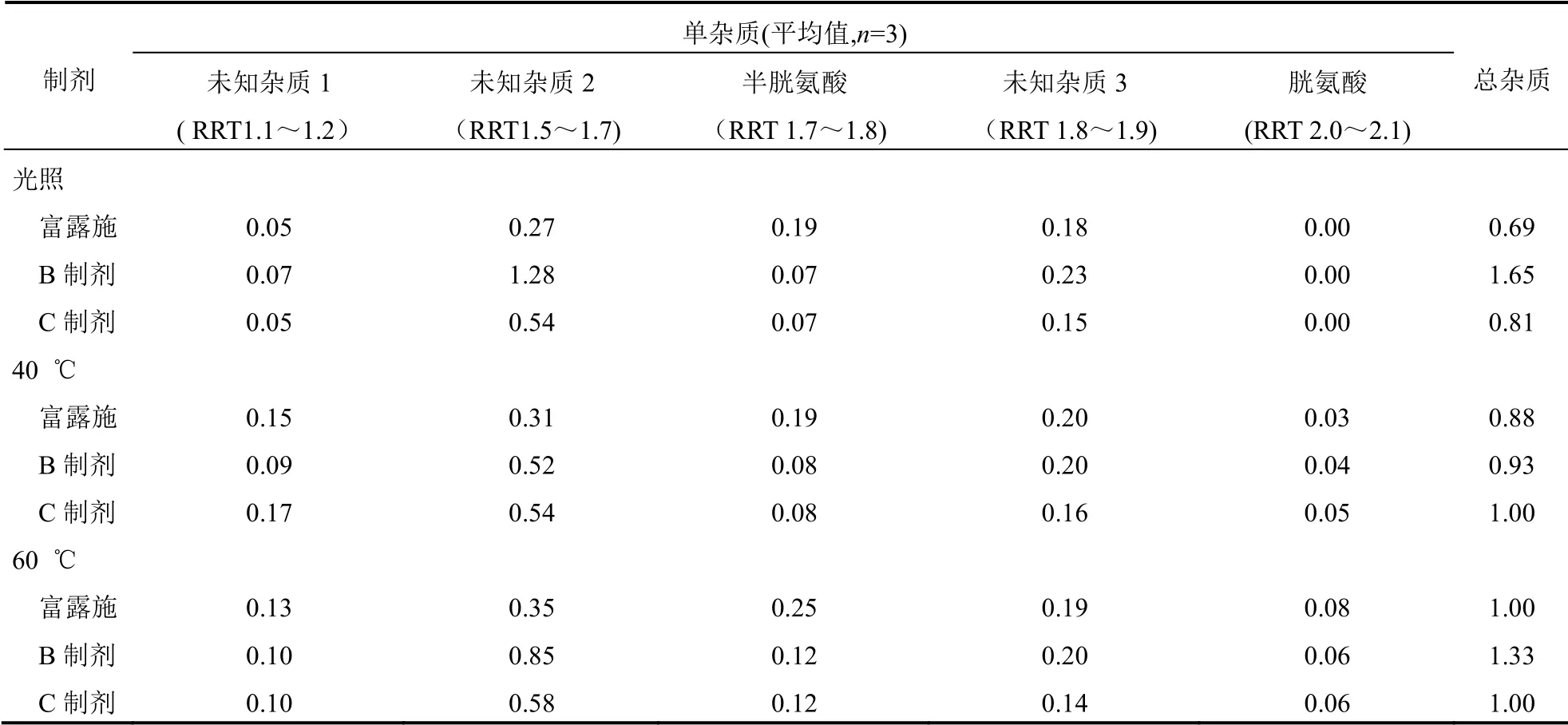
表2 不同放置条件下各厂家乙酰半胱氨酸吸入制剂有关物质比较(%)
根据上述实验研究结果,提示制剂研究人员有必要进一步对原研厂家在原辅料质量控制、未知杂质的确证与制剂工艺进行深入研究,发现影响制剂质量的关键因素,提高产品的整体质量,以期达到与原研制剂质量和疗效一致的目的。
