丁苯酞对缺血性脑卒中大鼠脑组织NF-κB p65、IL-6、TNF-α表达的影响①
2019-09-04张晓璇李佳佳焦光美单海雷窦志杰
张晓璇 朱 江 李佳佳 焦光美 单海雷 赵 亮 窦志杰
(承德医学院附属医院神经内科,承德 067000)
缺血性脑卒中(Cerebral ischemic stroke,CIS)是一种中枢神经系统疾病,主要由脑内动脉闭塞或破裂引起的急性脑血液循环障碍导致,具有高发病率、高死亡率的特点[1]。随着社会人口老年化的趋势,近年来我国缺血性脑卒中的发病率不断升高。缺血性脑卒中的发生由多因素导致,其发病机制十分复杂,目前临床主要通过溶栓剂和机械取栓治疗[2,3]。近年来研究表明炎性反应过程是缺血性脑卒中发生的主要原因,炎性因子在脑卒中病情进展及脑水肿形成中有着重要作用[4]。核因子-κB(Nuclear factor-κB,NF-κB)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)与缺血性脑卒中的发生密切相关,NF-κB可促进TNF-α、IL-6等细胞因子的表达,同时这些细胞因子又可进一步活化NF-κB,造成持续或放大的炎症反应[5]。丁苯酞临床用于治疗轻、中度急性缺血性脑卒中,具有抗神经细胞凋亡作用,但对炎性反应的影响研究甚少[6]。本实验通过线栓法制备大脑中动脉栓塞,观察丁苯酞对缺血性脑卒中大鼠脑组织NF-κB p65、IL-6、TNF-α表达的影响,探讨其对缺血性脑卒中的神经保护作用及其机制,为临床治疗提供基础依据。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级健康雄性SD大鼠50只,体重(220±20)g,购自河北医科大学,合格证号:SYXK(冀)2013-0023。适应性饲养1周,自由饮食、饮水。
1.1.2试剂 NF-κB p65单克隆抗体(Santa Cruz公司);大鼠IL-6 ELISA试剂盒、大鼠TNF-α ELISA试剂盒(美国R&D公司);2,3,5-三苯基氯化四氮唑(TTC,国药集团化学试剂有限公司的产品);辣根过氧化物酶(HRP,北京中杉金桥生物技术有限公司)。
1.2方法
1.2.1动物分组与给药 将50只大鼠随机分为假手术组、模型组、丁苯酞低、中、高剂量组。丁苯酞低、中、高剂量组大鼠建模后分别灌胃给予剂量为20、40、60 mg/kg的丁苯酞,假手术组和模型组给予等体积的生理盐水灌胃。
1.2.2模型的制备 除假手术组外,其余各组采用改良的大脑中动脉栓塞法(Zea Longa法)制备急性缺血性脑卒中模型[7]。腹腔注射7%水合氯醛麻醉大鼠,与颈部正中偏右切开皮肤,钝性分离组织暴露右侧颈总动脉,沿颈总动脉向远心端分离颈内、颈外动脉分叉稍后一段,在颈总动脉与颈外动脉下放置备用线,结扎颈总动脉近心端与颈外动脉,颈内动脉用动脉夹夹闭。在距颈总动脉分叉约4 mm处剪小口,将MCAO尼龙线圆头端栓线从小口插入,至微感阻力。结扎颈内动脉,缝合,剪去栓线多余部分约留1 cm于皮外。假手术组操作同上,但只结扎颈总动脉与颈外动脉,不插栓线。
1.2.3神经功能评分 采用Bederson等[8]建立的5分评分法对大鼠神经功能评分。0分:无神经症状;1分:提尾悬空时,大鼠对侧前肢表现肩内旋、肘外展、紧贴胸壁;2分:大鼠置于光滑平面上,推手术侧肩向对侧移动,阻力降低;3分:大鼠行走时向手术对侧倾倒或转圈;4分:无自发活动行为。
1.2.4脑梗死体积的测定 处死大鼠后,立即于冰台上取脑,置于-80℃保存,切成厚度相同的5片,采用0.1%TTC溶液于37℃避光孵育30 min,置于10%甲醛溶液固定24 h。缺血区域呈白色,正常区域呈红色,测定脑梗死体积。梗死百分比(%)=白色区域重量/脑组织总重量×100%。
1.2.5Western blot检测大鼠脑组织NF-κB p65表达水平 取大鼠脑组织50 mg,加入1 000 μl蛋白提取混合液,研磨制成匀浆,静置裂解30 min,3 000 r/min离心15 min,取上清液,得到总蛋白提取液,取1 μl上清液,加入49 μl PBS混匀,于每孔加入20 μl,加入200 μl BCA试剂,37℃孵育20 min,酶标仪570 nm下测定吸光度,绘制标准曲线,计算蛋白的浓度。10%SDS-PAGE电泳分离,每孔蛋白上样量30 μl,加入PBS,混匀,离心,95℃加热变性5 min,起始电压60 V,后用电压100 V分离蛋白。恒定电流转移至PVDF膜。加入5%脱脂牛奶于室温封闭3 h,洗膜3次,每次10 min。加入NF-κB p65抗体作为一抗(1∶1 000)。4℃过夜,洗膜后加入辣根过氧化物酶标记二抗(1∶2 000),室温封闭 60 min,漂洗3次,每次10 min。采用Quantity One 定量分析软件,对蛋白质印迹进行灰度值测定;相对定量值=目的蛋白的灰度值/内参灰度值。
1.2.6免疫组织荧光法 取大鼠脑组织切片,采用梯度二甲苯脱蜡,微波炉低温抗原修复20 min,4%多聚甲醛固定15 min,磷酸盐缓冲溶液(PBS)洗涤3次,采用0.25% Triton-X100 室温通透30 min,PBS洗涤3次,加入正常山羊血清封闭20 min,加入一抗,4℃过夜,PBS洗涤3次,加入荧光素标记的二抗,37℃包被1 h,加入细胞核染色液(DAPI)孵育5 min,PBS洗涤3次,加入荧光淬灭剂的封片液封片,荧光显微镜下观察。
1.2.7ELISA法测定脑组织IL-6、TNF-α水平 取大鼠缺血侧脑组织,制成匀浆,于3 000 r/min离心15 min,取上清液,按照试剂盒方法测定IL-6和TNF-α含量,使用酶标仪于450 nm处测定吸光度值,根据标准曲线,计算IL-6和TNF-α含量。
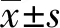
2 结果
2.1大鼠神经功能评分结果 假手术组大鼠未出现神经功能症状,记分为0,其余大鼠均表现为左侧不同程度的神经功能症状。与假手术组比较,模型组大鼠神经功能评分均显著升高(P<0.05);与模型组比较,丁苯酞低、中、高剂量组大鼠神经功能评分均显著下降(P<0.05);丁苯酞低、中、高剂量组大鼠神经功能评分随着丁苯酞剂量增加呈递减趋势,差异有统计学意义(P<0.05),见表1。
2.2各组大鼠脑梗死体积比较结果 假手术组大鼠均没发现脑梗死,模型组大鼠脑梗死体积比假手术组明显升高(P<0.05);与模型组比较,丁苯酞低、中、高剂量组大鼠脑梗死体积比显著下降(P<0.05),见表2、图1。
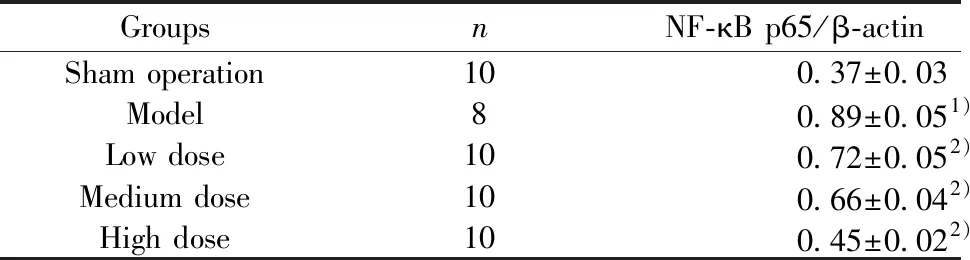
2.3各组大鼠脑组织NF-κB p65蛋白表达水平结果 与假手术组比较,模型组大鼠NF-κB p65蛋白表达水平显著升高(P<0.05)。与模型组比较,丁苯酞低、中、高剂量组大鼠NF-κB p65蛋白表达水平显著降低(P<0.05);丁苯酞高剂量组NF-κB p65蛋白表达水平明显高于丁苯酞低、中剂量组,差异具有统计学意义(P<0.05)。见表3、图2。
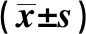
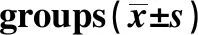

GroupsnScoreSham operation100Model82.62±0.311)Low dose101.80±0.222)Medium dose101.34±0.212)High dose101.01±0.122)
Note:Compared with sham operation,1)P<0.05;compared with model group,2)P<0.05.
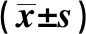
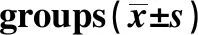

GroupsnVolume ratio of cerebral infarctionSham operation100Model817.43±2.031)Low dose1012.81±1.722)Medium dose1010.34±1.102)High dose107.26±1.492)
Note:Compared with sham operation,1)P<0.05;compared with model group,2)P<0.05.
2.4各组大鼠脑组织NF-κB p65入核情况 与假手术组相比,模型组大鼠NF-κB p65入核显著增加。与模型组相比,丁苯酞低、中、高剂量组大鼠NF-κB p65入核显著减少;丁苯酞高剂量组NF-κB p65入核明显低于丁苯酞低、中剂量组。见图3。
2.5各组大鼠脑组织IL-6、TNF-α水平比较 与假手术组比较,模型组大鼠脑组织IL-6、TNF-α水平显著升高(P<0.05)。与模型组比较,丁苯酞低、中、高剂量组大鼠脑组织IL-6、TNF-α水平显著降低(P<0.05);丁苯酞高剂量组大鼠脑组织IL-6、TNF-α水平明显低于丁苯酞低、中剂量组,丁苯酞中剂量组大鼠脑组织IL-6、TNF-α水平明显低于丁苯酞低剂量组,差异具有统计学意义(P<0.05)。见表4。
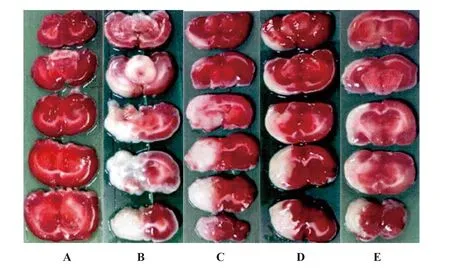
图1 大鼠脑组织TTC染色结果Fig.1 TTC staining results of brain tissue in ratsNote: A.Sham operation;B.Model;C.Low dose;D.Medium dose;E.High dose.
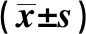
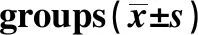
GroupsnNF-κB p65/β-actinSham operation100.37±0.03Model80.89±0.051)Low dose100.72±0.052)Medium dose100.66±0.042)High dose100.45±0.022)
Note:Compared with sham operation,1)P<0.05;compared with model group,2)P<0.05.
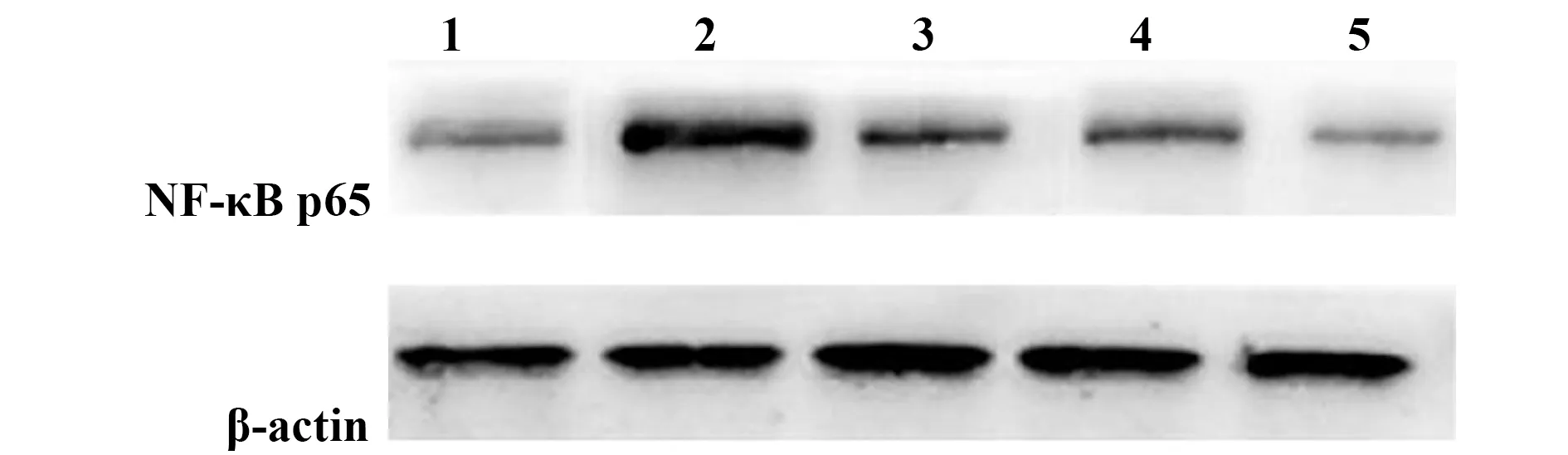
图2 各组大鼠脑组织 NF-κB p65蛋白表达水平Fig.2 Protein expression of NF-κB p65 among various groupsNote: 1.Sham operation;2.Model;3.Low dose;4.Medium dose;5.High dose.
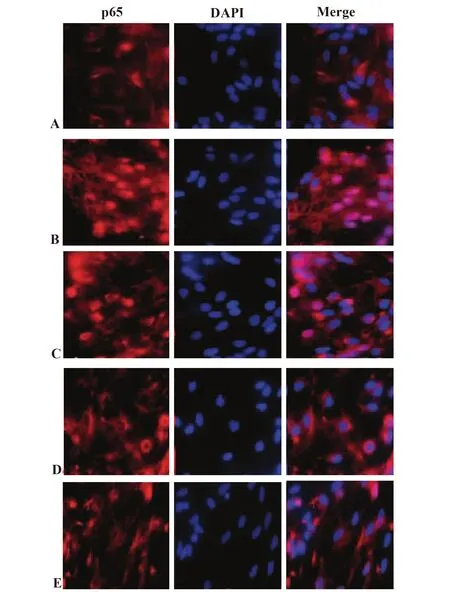
图3 各组大鼠NF-κB p65入核情况(×200)Fig.3 Nuclear displacement of NF-κB p65 among various groups(×200)Note: A.Sham operation;B.Model;C.Low dose;D.Medium dose;E.High dose.
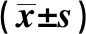
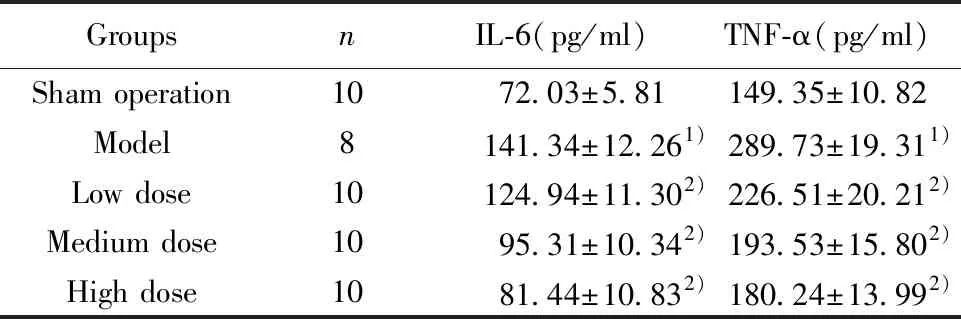
GroupsnIL-6(pg/ml)TNF-α(pg/ml)Sham operation1072.03±5.81149.35±10.82Model8141.34±12.261)289.73±19.311)Low dose10124.94±11.302)226.51±20.212)Medium dose1095.31±10.342)193.53±15.802)High dose1081.44±10.832)180.24±13.992)
Note:Compared with sham operation,1)P<0.05;compared with model group,2)P<0.05.
3 讨论
缺血性脑卒中主要由于血脑微循环障碍引起神经元损伤。脑组织缺血损伤可引起大量炎性细胞因子分泌,诱导细胞间黏附分子表达,增强白细胞与内皮细胞表面的黏附,导致小胶质细胞活化和神经元凋亡[9]。
NF-κB信号通路的激活是炎性反应的主要过程,大量研究表明,脑缺血过程中NF-κB信号通路被激活,诱导神经元细胞中炎性细胞因子的生成[10-12]。NF-κB是启动、调节炎性反应的关键核转录因子,包括p65、p50、p52、p68、p75五个亚单位,其激活过程包括p65、p50核转位[13]。IL-6是一种多能效的细胞因子,在机体免疫应答、骨髓造血及炎症反应中均发挥重要作用。研究表明,脑缺血后脑内表达IL-6增多,且在缺血再灌注后期仍维持在较高水平[14]。TNF-α主要提高机体免疫和促进组织愈合,是具有多效性作用的促炎性细胞因子,可促进脑缺血损伤区黏附分子的表达和炎性细胞的浸润[15]。研究表明,TNF-α可通过促进血管内皮细胞黏附分子表达,诱导神经细胞凋亡,加重缺血性脑损伤[16]。
本研究结果表明低、中、高剂量的丁苯酞均能明显降低缺血性脑卒中模型大鼠神经功能评分,减少模型大鼠的脑梗死体积,对大鼠的神经系统起保护作用。与假手术组相比,模型组大鼠脑组织NF-κB p65蛋白表达与IL-6、TNF-α水平显著升高,NF-κB p65入核明显增加,说明缺血性脑卒中的发生可能由于NF-κB激活促进 IL-6、TNF-α等炎症因子分泌,IL-6、TNF-α水平升高导致炎症过程的增强,进而激活单核细胞侵入脑血管内膜形成泡沫细胞,诱发或加重脑卒中的发生。丁苯酞低、中、高剂量组大鼠脑组织NF-κB p65蛋白表达与IL-6、TNF-α水平明显低于模型组,NF-κB p65入核明显减少,说明丁苯酞可阻止NF-κB核转位,抑制NF-κB p65蛋白活化,调节炎症因子的转录,防止炎症因子逆向持续活化NF-κB,从而减缓重缺血性脑卒中发展。综上所述,丁苯酞可改善大鼠神经行为学功能、缩小脑梗死体积,其机制可能与抑制NF-κB的活化,抑制脑组织NF-κB p65蛋白表达,降低IL-6、TNF-α的水平有关。