树鼩PSEN1全长编码序列的克隆及分子特征分析
2019-09-03李明学王文广李娜匡德宣仝品芬黄鑫黎晓慧孙晓梅陆彩霞
李明学,王文广,李娜,匡德宣,仝品芬,黄鑫,2,黎晓慧,孙晓梅*,陆彩霞*
(1. 中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心,昆明 650118; 2. 昆明医科大学,昆明 650500)
早老素-1(presenilin 1,PSEN1)是一种早老素蛋白,在人类中由位于染色体14q24.2的PSEN1基因编码,属于进化保守基因家族成员[1-2]。随着研究的不断深入,人们发现PSEN1是构成γ-分泌酶中四种核心蛋白之一[3],γ-分泌酶与β-分泌酶二者共同作用连续分解淀粉样前体蛋白(amyloid precursor protein,APP)产生β-淀粉样蛋白(Aβ)[4-5]。β-淀粉样蛋白(Aβ)累积是阿尔茨海默病(Alzheimer’s disease,AD)一个重要病理特征[6-7]。相关的研究结果已明确表明PSEN1、PSEN2和APP是AD的致病基因[1]。PSEN1 作为构成γ-分泌酶的核心蛋白之一不仅在AD发病中起重要作用,而且在信号通路中亦起着关键作用。据文献[8]报道PSEN1蛋白可以影响Wnt信号通路,能与β-连环蛋白结合形成复合物,使其不被降解。而在Notch信号通路中,由于PSEN1在蛋白水解过程中起重要作用,从而影响Notch受体的成熟和活化[9]。
树鼩(Tupaiabelangerichinensis)是一种新型的实验动物,其生理、生化、解剖结构以及基因组等生物学特性比啮齿类更接近于非人灵长类,已被广泛应用于生物医学研究中。Yamashita 等[10]在正常年老的树鼩大脑中检测到Aβ累积这一重要的病理特征。Fan等[6]分析树鼩脑组织中与AD相关131个基因,并与人、猕猴和小鼠进行同源性比对,发现树鼩与人类AD基因的序列同源性高于小鼠,而且树鼩脑组织中Aβ累积与NFTs的表达模式与人类脑组织相似,具有类似的年龄依赖效应。这些研究提示树鼩可以作为一个潜在的AD动物模型。
本研究以确定树鼩PSEN1完整编码序列为目的,对其进行分子特征和组织表达量分析,为今后制备树鼩PSEN1单克隆抗体、研究其在树鼩AD模型中Aβ累积机理及癌症研究中奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
采用本实验室繁育的普通级中缅树鼩3只,体重160~200 g,2~3岁,由中国医学科学院医学生物学研究所树鼩种质资源中心提供【SCXK(滇)K2018-0002】。实验操作在本中心实验设施内进行【SYXK(滇)K2018-0002】,并遵循实验动物使用的3R和福利伦理原则。
采用过量戊巴比妥钠给予树鼩安乐死后,迅速解剖树鼩,并取心脏、肝、脾、肺、肾、胰、脑和肌肉等组织,立即放入-80℃冰箱,冷冻储存。
1.1.2 试剂与仪器
柱式TRIzol总RNA提取试剂盒(B511321,生工,中国);M-MuLV First Strand cDNA Synthesis Kit M-MuLV试剂盒(B532435,生工,中国);Ex Taq® Hot Start Version试剂盒(RR006 A,TaKaRa,日本);One Step TB GreenTMPrimeScriptTMPLUS RT-PCR Kit (Perfect Real Time)(RR096 A,TaKaRa,日本);柱式胶回收试剂盒(B518131,生工,中国);PMSF(ST506,碧云天,中国);蛋白裂解液(P0013,碧云天,中国); BCA蛋白浓度测定试剂盒(增强型)(P0010,碧云天,中国);丙烯酰胺快速电泳预混液(1610183,Bio-Rad,美国);0.2 μm PVDF膜(162-0177,Bio-Rad,美国);PSEN1(GTX101028,GeneTex,美国);β-actin(8H10D10,Abgent,美国);TBST(T1081-500,索莱宝,美国); Goat Anti-Rabbit IgG(S0001,Affinity,美国);Goat Anti-Mouse IgG(S0001,Affinity,美国);Immopbilon Western Chemilum HRP Substrate(WBKLS0100,Merck,美国);超速离心机(L8-80 M,Hermle,德国);梯度PCR仪(TP600,TaKaRa,日本);实时荧光定量RCR(CFX-96,Bio-Rad,美国);凝胶成像系统(GelDoc 2000,Bio-Rad,美国)
1.2 方法
1.2.1 树鼩PSEN1 cDNA的分子克隆
(1)PSEN1引物设计
根据Genbank已经注册登记的人PSEN1(NM 000021.3)、小鼠PSEN1(NM 001362271.1)和黑猩猩PSEN1(NM 001132655.1)的保守序列,设计表1中的4组引物,该4组引物分别覆盖了树鼩PSEN1 mRNA的整个编码区(表1)。
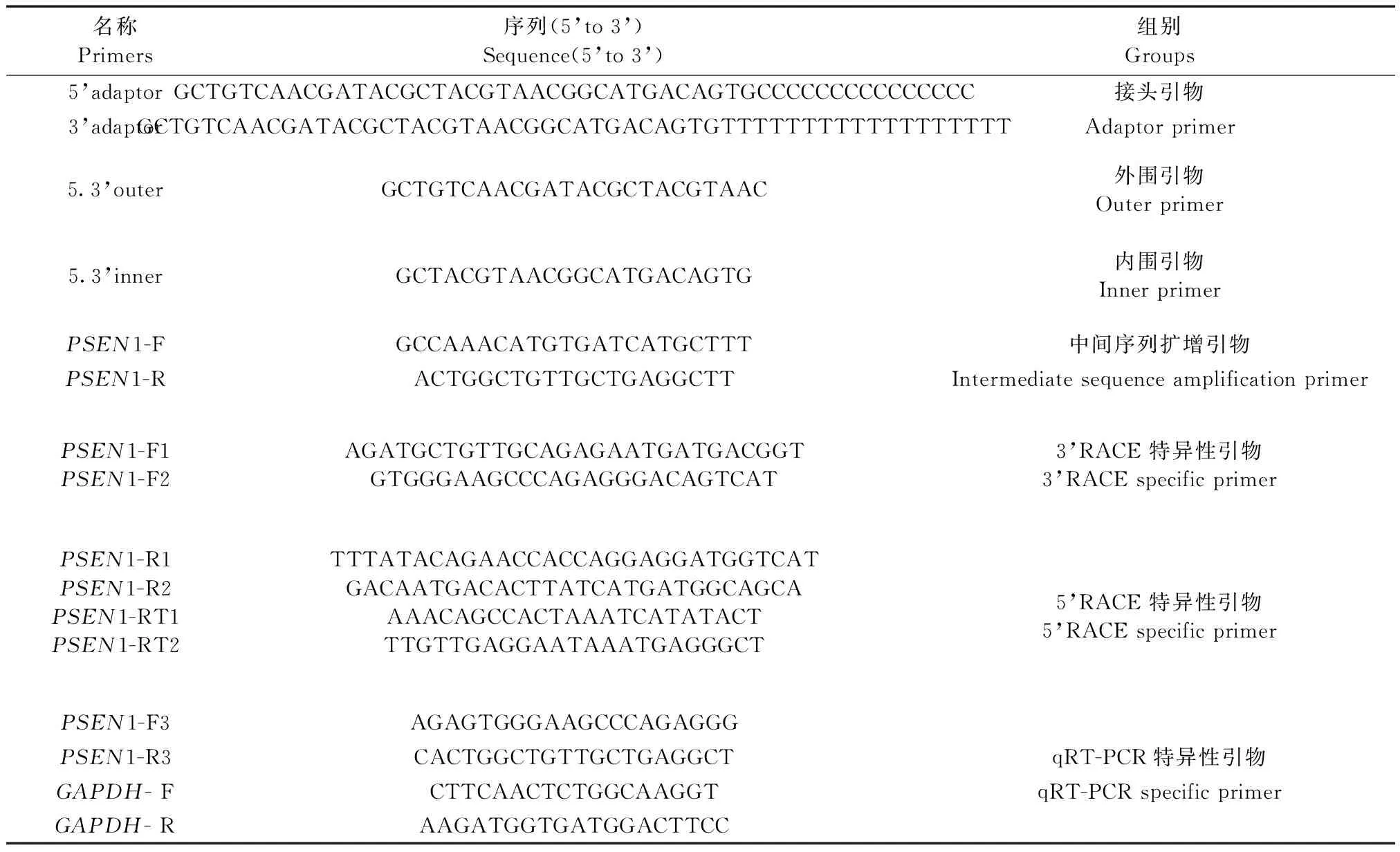
表1 树鼩PSEN1和内参GAPDH的引物设计Table 1 Primer design of the tree shrew PSEN1 and GAPDH
(2)RNA与cDNA制备
取脑组织放入1.5 mL离心管,采用柱式Trizol总RNA提取试剂盒提取组织总RNA,并采用3’adaptor 引物和M-MuLV First Strand cDNA Synthesis Kit M-MuLV试剂盒一步法逆转录成cDNA,并去除基因组DNA污染。
(3)普通PCR
以3’adaptor为反转录引物的cDNA为模版,采用表1中PSEN1-F和PSEN1-R中间序列扩增引物和TaKaRa Ex Taq® Hot Start Version试剂盒进行普通PCR,进行基因调取。循环参数:95℃ 3min;94℃ 30 s、58℃ 30 s、72℃ 1 min、33个循环;72℃ 7 min。PCR产物电泳后回收测序。
(4)3’RACE巢式PCR
以3’adaptor为反转录引物的cDNA为模版,采用3’RACE 特异性引物和接头引物进行巢氏PCR。
采用PSEN1-F1和5.3’outer引物进行第一轮PCR,循环参数:95℃ 3 min;94℃ 30 s、58℃ 30 s、72℃ 1 min、33个循环;72℃ 7 min。以第一轮PCR产物为模版,采用PSEN1-F2和5.3’inner引物进行第二轮PCR,循环参数:95℃ 3 min;94℃ 30 s、 58℃ 58 s、72℃ 1 min、33个循环;72℃ 7 min。PCR产物电泳后回收测序。
(5)5’RACE巢式PCR
以特异性引物PSEN1-RT1、PSEN1-RT2进行反转录,得到cDNA,经RNase H 和TdT处理后,采用5’RACE 特异性引物和接头引物进行巢氏PCR。以5’adaptor和PSEN1-R1为引物进行第一轮PCR,循环参数:95℃ 3 min;94℃ 30 s、68℃ 30 s、72℃ 1 min、33个循环;72℃ 7 min。以第一轮PCR产物为模版,采用5.3’outer和PSEN1-R2引物进行第二轮PCR,循环参数: 95℃ 3 min;94℃ 30 s、68℃ 68 s、72℃ 1 min、33个循环;72℃ 7 min,PCR产物电泳后回收测序。
(6)测序
PCR产物交由公司(生工生物工程股份有限公司)(上海)测序。将PCR纯化产物插入pMD-18T载体后,转化大肠杆菌感受态细胞,提取质粒进行双酶切鉴定,最终进行双向测序。进行序列拼接得到全长编码序列,拼接时要求序列间碱基重合大于40 bp,一致性大于90%。
1.2.2 分子特征分析
本文用于参考的核酸及氨基酸序列均来源于GenBank,以NCBI、DNAMAN 5.0和MEGA 6.0分别进行核酸序列、氨基酸序列、物种间亲缘关系分析。
1.2.3PSEN1的表达模式分析
(1)RNA相对表达定量
从树鼩的13个组织(其中脑组织分别取材顶叶、额叶、颞叶、枕叶、海马体和小脑)中提取总RNA。在MyIQ2双色实时PCR检测系统上,使用One Step TB GreenTMPrimeScriptTMPLUS RT-PCR Kit(Perfect Real Time)和表1中的PSEN1特异性引物(PSEN1-F3和PSEN1-R3)与内参GAPDH特异性引物(GAPDH-F和GAPDH-R)进行qRT-PCR。
(2)Western Blot
对收集的13个组织提取蛋白,超声波破碎仪破碎组织,并用含PMSF的裂解液裂解细胞。蛋白浓度测定按照碧云天(增强型)BCA试剂盒说明书操作进行。采用Western Blot标准方法,25 mg总蛋白的上样量进行SDS-PAGE凝胶电泳。采用0.2 μm的PVDF膜进行转膜,分别用抗PSEN1和β-actin抗体(稀释浓度1∶1000)4℃过夜孵育,TBST清洗3次,每次10 min。摇床常温孵育goat anti-rabbit IgG与goat anti-mouse IgG二抗(HRP标记,稀释浓度1∶5000)60 min,TBST清洗3次,每次10 min。最后采用ECL底物化学发光法进行显色, Bio-Rad凝胶成像系统进行成像。使用Image J软件对PSEN1蛋白条带测定灰度值。
2 结果
2.1 树鼩PSEN1全长编码序列扩增
以树鼩脑组织总RNA为材料,反转录后进行PCR扩增测序。将中间序列及5’和3’RACE实验得到的序列进行拼接,得到1680 bp的核酸片段。将树鼩PSEN1 PCR 产物经T/A 克隆并双向测序,得到树鼩PSEN1基因全长编码序列(GenBank登录号:MK135065),开放阅读框长度为1128 bp,编码375个氨基酸(图1)。
2.2 树鼩PSEN1系统发育树构建及氨基酸序列比对分析
利用MEGA 6.0 软件对树鼩与人(NM 000021.4、NM 007318.2)、黑猩猩(NM 001132655.1)、猕猴(NM 001266480.1)、小鼠(NM 001362271.1)、大鼠(NM 019163.3)等13个物种的PSEN1基因进行亲缘关系分析并构建进化树,结果发现,如图2所示,可观察到树鼩与人、黑猩猩及恒河猴的遗传距离较近,而与大鼠、小鼠距离较远,说明树鼩PSEN1基因在进化关系上更接近于人、黑猩猩和猕猴。
利用Protein BLAST及Clustal W 2.0对树鼩与人(NM 000021.4、NM 007318.2)、黑猩猩(NM 001132655.1)、猕猴(NM 001266480.1)、小鼠(NM 001362271.1) 及大鼠(NM 019163.3)等哺乳动物的PSEN1氨基酸序列进行比较分析,同样发现树鼩PSEN1氨基酸序列与人、黑猩猩及猕猴同源性较高(分别为97.6%、97.07%及96.58%),而与小鼠、大鼠的同源性较低 (分别为95.47%及94.95%),比对结果如图3所示。
2.3 树鼩PSEN1基因在各组织的表达分析
为进一步研究树鼩PSEN1的表达模式,我们采用相对qRT-PCR法测定PSEN1在树鼩不同组织中mRNA表达水平。如图4A所示,PSEN1在脑组织表达较高,尤其在顶叶和额叶中,在其他脏器组织中的表达水平较低,脾脏和肌肉组织PSEN1表达水平中等,而胰腺组织PSEN1表达水平最低。我们进一步检索了人、小鼠和大鼠PSEN1表达信息(www.biogps.org),并与树鼩PSEN1在各个组织中的表达量进行对比,绘制了聚类热图,结果发现PSEN1在树鼩额叶表达最高,在大鼠、小鼠的海马表达最高,在人的枕叶表达最高,PSEN1在外周组织的表达量均较低(图4B)。
2.4 树鼩PSEN1蛋白的表达模式分析
为了评估PSEN1蛋白的表达,我们使用人类的抗PSEN1抗体对树鼩的13个组织进行Western Blot 检测PSEN1的表达水平。在所有检测组织中除了心脏和肌肉,其他均表达了PSEN1蛋白(图5 A)。为了进一步确认树鼩13个组织PSEN1蛋白的表达量,使用Image J软件对PSEN1蛋白条带测定灰度值。通过计算PSEN1蛋白灰度值和β-Actin蛋白灰度值的比值(图5B),结果表明PSEN1在脑组织高表达,其中表达最高的部位为小脑。外周组织表达较低,其中在肝表达量最低。

图1 树鼩PSEN1核苷酸序列及对应氨基酸Figure 1 Nucleotide sequences and corresponding amino acids of the tree shrew PSEN1
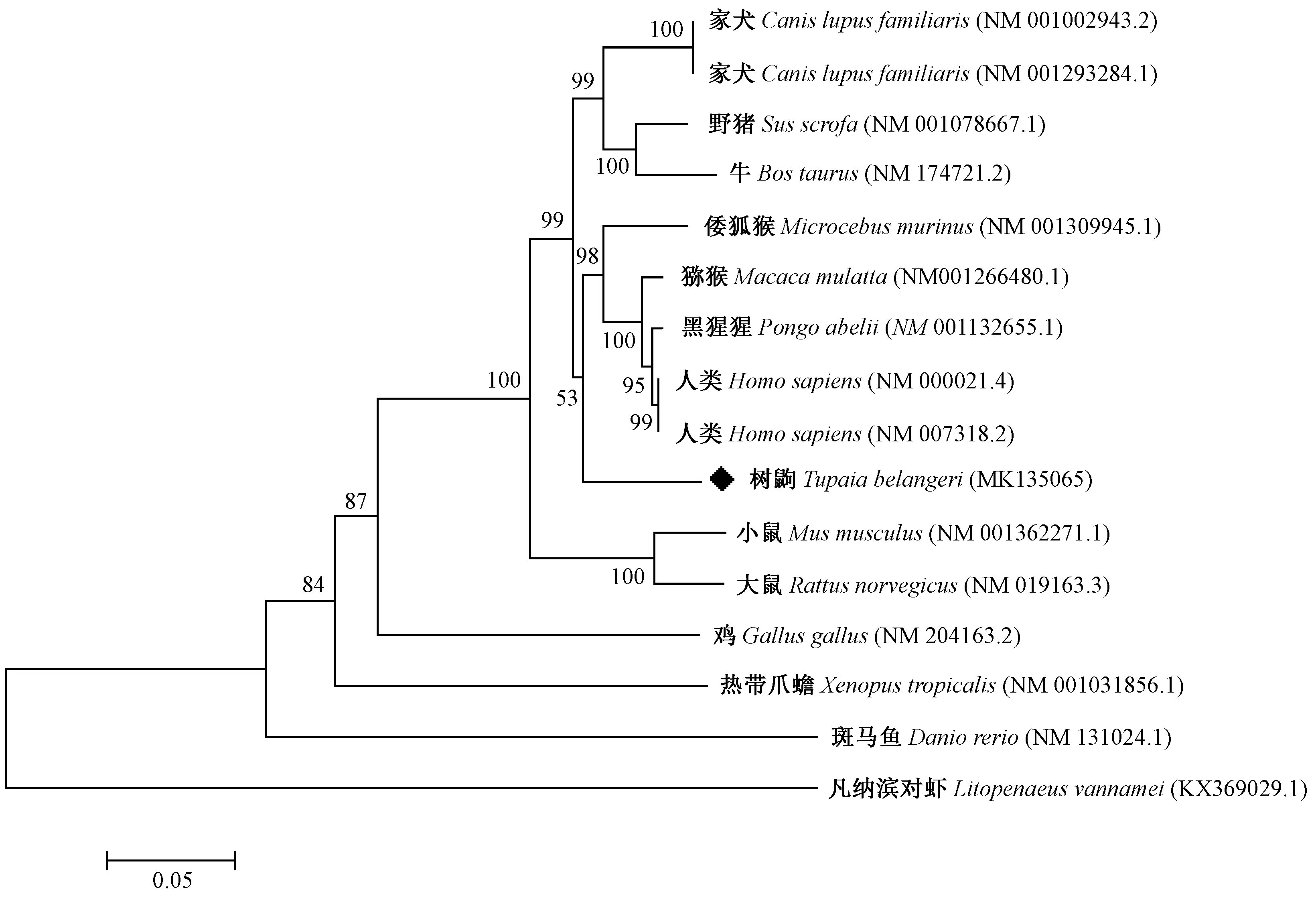
注:自展值:1000次。方法:邻接法。图2 树鼩PSEN1系统发育树分析Note. Bootstrap: 1000 replicates. Method: Neighbor-joining method.Figure 2 Phylogenetic tree of the tree shrew PSEN1
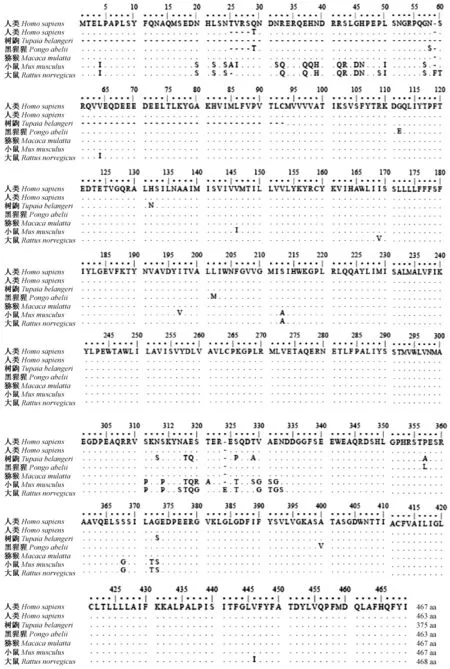
注:相同的氨基酸用·表示,缺失的氨基酸用-表示。图3 PSEN1氨基酸序列比对结果Note. Identical amino acids are shown by a dot, gaps are represented by a dash.Figure 3 Comparison of the PSEN1 amino-acid sequences
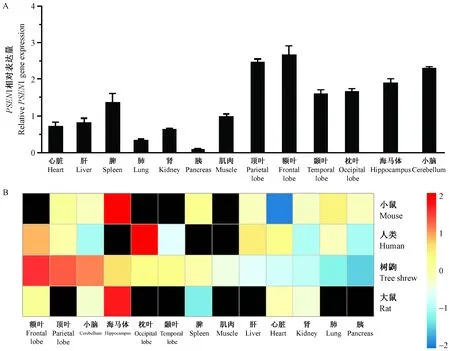
注:A:树鼩13种组织中PSEN1 mRNA的相对表达量分析。 B:树鼩与人类、小鼠和大鼠13个组织中PSEN1的表达量聚类热图。黑框表示缺失该信息。图4 树鼩PSEN1 mRNA表达谱Note. A, Quantitative real-time PCR analysis of PSEN1 mRNA expression in 13 organ tissues of tree shrew. B, Heat map of PSEN1 gene expression in 13 organ tissues of tree shrew, human, mouse and rat. Black boxes indicated missing information.Figure 4 Expression profile of PSEN1 mRNA in the tree shrew

注:A:树鼩13种组织中PSEN1蛋白的表达分析;B:树鼩13种组织的PSEN1蛋白定量分析。图5 树鼩PSEN1蛋白表达Note. A. Expression of PSEN1 protein in 13 organ tissues of tree shrew. B, Quantitative analysis of PSEN1 protein in 13 organ tissues of tree shrew.Figure 5 Expressions of PSEN1 protein in the tree shrew
3 讨论
在本研究中,我们对树鼩PSEN1基因克隆并测序,得到了全长序列。以树鼩和其他13类物种的PSEN1序列,采用邻接法、最大似然法和最小简约法三种构建法进行系统发育分析,发现三种系统发育树的结点、进化分支和分支长度都极为相似,说明构建PSEN1基因的系统发育树是准确的。以邻接法构建的系统发育树分析结果表明,树鼩PSEN1比小鼠、大鼠更接近人类和非人灵长类动物(图2)。将树鼩PSEN1与人类、非人灵长类及大小鼠等5类物种进行氨基酸序列比对分析,发现树鼩PSEN1氨基酸序列与人类的同源性接近97.6%(图3)。
我们采用qRT-PCR技术对树鼩13个组织中PSEN1基因进行相对定量分析,发现树鼩PSEN1在脑组织的表达量明显高于外周组织。将树鼩PSEN1表达量与在BioGPS上获得的PSEN1在人类、小鼠和大鼠部分组织表达量绘制聚类热图进行分析,发现PSEN1在树鼩额叶表达最高,在大小鼠的海马表达最高,在人的枕叶表达最高,而在外周组织的表达量均较低。同时从图4B中也反映出,树鼩PSEN1的表达水平比小鼠、大鼠的表达较高,这更有利于对PSEN1的功能研究。树鼩PSEN1的氨基酸序列与人类的同源性高达97.6%,因此利用人PSEN1抗体来鉴定树鼩PSEN1蛋白是可行的。在对树鼩13个组织的PSEN1蛋白的表达进行Western Blot分析时发现树鼩小脑组织的PSEN1表达要远高于其他组织(图5B)。通过上述对PSEN1基因和蛋白的表达分析,两者之间的表达结果存在一定的差距,推测PSEN1在大脑的表达有自分泌和旁分泌模式[11],也说明树鼩PSEN1具有较为复杂的转录水平调控模式,因此树鼩可能是开展PSEN1基因表达机制研究的良好动物模型。
Western Blot分析结果显示,PSEN1在树鼩大脑中的颞叶、海马体与小脑中表达水平较高。研究显示:颞叶负责处理听觉信息,并与记忆和情感有关[12];海马体主要负责记忆存储、信息处理和定向等功能[13];小脑不仅负责运动功能还负责处理与知觉、语言及认知等功能外的非运动功能[14]。此前,大量早期研究表明,阿尔茨海默病(AD)患者或AD 模型鼠的大脑皮层颞叶和海马体内有大量Aβ沉积[15]。但后续随着临床研究的不断发现,AD 病人小脑内会出现与大脑皮层和海马体相似的形态变化,并且小脑后叶的萎缩伴随着的是更加严重的认知行为的损害[14]。PSEN1作为γ-分泌酶的核心部分,与β-分泌酶共同作用,将淀粉样前体蛋白(APP)水解产生与AD直接相关的Aβ40和Aβ42[3-4,16]。PSEN1基因突变后并不损害γ-分泌酶的酶切功能,仅PSEN1构像发生异构变化[17-18],使γ-分泌酶改变酶切位点,导致 Aβ42/Aβ40比值增大。据此我们推测,脑组织中PSEN1高表达的三个区域(颞叶、海马体和小脑)可能会出现大量淀粉样斑块累积,进而影响其功能,从而能引起个体产生符合AD部分临床表现(如记忆障碍、失语、认知功能减退、视空间定向和执行功能障碍等)[12,19]。Fan等[6]也证实,老年树鼩与人类因Aβ累积而受累部位是一致的,主要是海马体与大脑皮质组织。这些证据都有力的表明树鼩可以作为一个潜在的AD研究模型。
近年来的研究表明,PSEN1除了在AD中的作用,还发现在癌症中也扮演重要角色。PSEN1参与Wnt[7]、Notch[8,20]信号通路的调控,并与PI3K-AKT-mTOR通路、Ras-Raf-MEK通路相互影响,影响结黑色素瘤[21]、脑胶质细胞瘤、乳腺癌等多种恶性肿瘤的细胞增殖、侵袭、转移及新生血管生成等进程[22-23]。但由于所影响的信号通路较多,导致PSEN1在不同细胞环境和组织中扮演着不同的角色,即可以表达出促癌的功能,也能表达可以抑癌的功能。
PSEN1基因是目前国内外研究的热点之一,该基因与AD、肿瘤等多种疾病相关。对于AD的药物治疗,现阶段效果最卓越的药物靶点就是γ-分泌酶,因此针对PSEN1深入研究将有助于研制有效的抗AD药物。另外,目前以AD所建立的成熟动物模型只有转基因小鼠[24],但由于物种差异,治疗策略和药物并不能成功地转化到人类身上。现阶段已有研究者证明,树鼩可以作为一个可行的、理想的实验动物用于AD研究[6,25]。随着PSEN1基因和树鼩动物模型研究的不断深入,相信它会在AD的治疗和药物研究等方面起到愈来愈大的作用。
综上,本研究通过调取树鼩PSEN1基因,获得其全长编码序列,通过系列比对、系统进化等分析发现树鼩PSEN1基因比小鼠、大鼠更接近人类和非人灵长类动物,有助于了解 PSEN1在Aβ发生、AD发展中的作用,有利于树鼩PSEN1单克隆抗体的合成与制备,并为进一步研究其作用机制奠定基础。
