LncRNA CASC2靶向miR-634表达抑制神经胶质瘤细胞的生物学行为①
2019-09-03杨福兵朱明建徐有临
刘 露 杨福兵 朱明建 徐有临
(西南医科大学附属医院神经外科,泸州646000)
神经胶质瘤是发生于神经外胚层的恶性肿瘤,据最新统计,我国胶质瘤的发病率从1973年的5.9/10万上升到2016年的6.61/10万[1],目前研究表明,神经胶质瘤的发病与抑癌基因的失活、氧化应激损伤、遗传基因突变和细胞自噬抑制有关,但具体发病原因及其机制尚不明确[2],因此迫切需要阐明胶质瘤的病因及其可能的机制,并找到更有效的诊疗策略。 近年来,全基因组转录研究发现,只有大约1%的人类基因组作为蛋白质的蓝图,而更大比例的基因组被转录为非编码RNA[3]。长非编码RNA(Long non-coding RNA,LncRNA)是非蛋白质编码转录本长度超过200个核苷酸(nt),已证实LncRNA在各种人类肿瘤的进展中充当关键分子[3]。如Cancer susceptibility candidate 2(CASC2)是位于染色体10q26的LncRNA,最初被鉴定为子宫内膜癌的下调基因,并且也充当肿瘤抑制基因[4]。越来越多的研究表明CASC2的上调,可明显抑制恶性肿瘤细胞的增殖、侵袭及迁移[5]。Huang等[6]研究表明,CASC2在结肠癌中呈低表达状态,增加CASC2的表达可以通过抑制miR-18a的表达,进而抑制JAK2/STAT3通路的激活,从而抑制结肠癌细胞的恶性生物学行为,并且CASC2的表达与临床分期及淋巴结转移密切相关[6]。可见CASC2可能是治愈恶性肿瘤的重要靶点,然而关于神经胶质瘤中CASC2的表达水平以及其是否参与胶质瘤形成,知之甚少。因此我们研究CASC2在神经胶质瘤患者体内表达水平与疾病分期的关系,通过构建CASC2过表达载体,研究CASC2对胶质瘤细胞的增殖、侵袭和转移的影响,并对其可能的机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 样本 收集2017年1月至2018年6月在我院行神经胶质瘤切除术患者的肿瘤组织18例及其病例资料,术后病检均证实为神经胶质瘤,并且取同时期脑外伤及癫痫手术中切除的脑组织18例作为对照组,取材大小约0.5 cm×0.5 cm×0.5 cm,取材后立即将标本放入液氮罐中保存,直至提取RNA。术前所有患者未经放疗及化疗,术前患者均签署研究知情同意书,本研究经我院伦理委员会审批通过。
1.1.2 试剂 Lipofectamine-2000、RPMI1640细胞培养基、胎牛血清购于美国Invitrogen公司,Matrigel基质胶购于美国B&D公司,双荧光素酶实验试剂盒、逆转录试剂盒、实时定量PCR试剂、荧光素酶报告基因载体psi-CHECK载体购于美国Promega公司,RNAiso Plus购于日本TaKaRa公司。CCK-8试剂盒、全蛋白提取试剂盒、BCA蛋白浓度检测试剂盒、高灵敏ECL化学放光试剂盒购于上海碧云天公司。人胶质瘤细胞A127、U251、U87、正常人星形胶质细胞系HA及人肾上皮细胞HEK293细胞均购于中科院上海细胞库。人表皮生长因子受体(Epi-dermal growth factor receptor,EGFR)、p-AKT、PI3K、GAPDH抗体均购于美国Abcam公司,IgG二抗购于上海碧云天,CASC2 mimics、CASC2-NC mimics、miR-634 mimics、miR-NC mimics 购于苏州吉玛制药公司,miR-634启动子的野生型和突变序列由上海生工合成,并连接到pcDNA3.1质粒上。突变质粒构建试剂量盒QuikChange Site-Directed Mutagenesis kit购于美国CA公司。Transwell小室购于美国康宁公司。
1.2 方法
1.2.1 细胞培养及转染 A127、U251、U87和HA细胞在补充有10%胎牛血清的RPMI1640培养基中培养,温度为37℃,并控制CO2浓度为5%。将细胞传代培养至第3代,以70%~80%的密度接种于培养基中。根据转染手册,使用Lipofectamine-2000将miR-CASC2 mimics转染至U87细胞,并将CASC2-NC mimics转染至U87细胞中作为对照组1;再将miR-634 mimics转染至U87细胞,并将miR-NC mimics转染至U87细胞中作为另外对照组2。
1.2.2 RNA提取和实时定量PCR 根据RNAiso Plus操作说明书提取并扩增总RNA,并使用RNA逆转录试剂盒进行逆转录反应,得到cDNA模板,将10 μl qPCR混合物及每种引物0.5 μl混合均匀,配制成最终的20 μl反应混合物。用于扩增的热循环参数如下:94℃变性2 min;94℃ 20 s,58℃ 20 s,72℃ 30 s,40个循环;25℃ 5 min终止反应,构建熔解曲线并在62℃和95℃之间进行分析,使用2-ΔΔCT法计算靶基因的相对表达水平。实验重复3次。本研究中使用的引物如下:CASC2上游引物,5′-GAGGAGCCATCCGCACATCACAAT-3′,下游引物5′-AG-CTTAGACTGTAAGCTGGTCTCA-3′;U6内参上游引物:5′-AACGCTTCACGAATTTGCGT-3′,下游引物5′-CTCGCTTCGGCAGCACA-3′;miR-634上游引物:5′-CCUUCAAUUUGACCGUCCU-3′,下游引物:5′-AAU-AAAACCAGGUCGAAUAGGU-3′;β-actin上游引物:5′-CCACACCTTCTACAATGAG-3′,下游引物5′-ATAGCACAGCCTGGATAG-3′。
1.2.3 双荧光素酶活性测定 为了确定CASC2与miR-634的调控关系,使用TargetScan(www.targetscan.org)和Starbase(starbase.sysu.edu.cn)数据库预测其靶基因,并发现两者具有互补的结合位点。从正常人基因组DNA扩增含有CASC2互补位点的miR-634 3′UTR序列,并克隆到psi-CHECK载体中,将该结合位点作为野生型miR-634 3′UTR。使用QuikChange Site-Directed Mutagenesis Kit产生突变型miR-634 3′UTR重组质粒。在转染不同质粒组合后48 h,根据说明使用双荧光素酶测定试剂盒检测荧光素酶活性,共转染的海肾荧光素酶质粒用作确定转染效率的内部对照,使用双荧光素酶报告分析系统(Promega)检测荧光强度。实验重复3次。
1.2.4 免疫蛋白印迹实验 根据说明使用总蛋白质提取试剂盒提取总蛋白质,并测定每个样品中的蛋白质浓度,通过SDS-PAGE分离后,将蛋白转移至PVDF膜中,使用BSA封闭液封闭1 h,EGFR(1∶1 000)、p-AKT(1∶2 000)、PI3K(1∶1 200)、GAPDH(1∶2 000)4℃孵育过夜后,TBST溶液洗膜3次后,在室温下孵育二抗(1∶10 000)1 h。使用ECL显影液检测EGFR、p-AKT和PI3K蛋白的表达水平,GAPDH作蛋白内参对照。实验重复3次。
1.2.5 CCK-8细胞增殖活性测定 将指数生长的U87细胞(5×105个/ml)接种到96孔板,然后分别将细胞培养72 h,加入10 μl/ml CCK-8溶液,然后在37℃、5%CO2下孵育4 h。使用酶标仪在490 nm波长下测量细胞在48 h的OD值,细胞活力(%)=[OD(实验组)-OD(空白)]/[OD(对照组)-OD(空白)]×100%。实验重复3次。
1.2.6 Transwell迁移和侵袭实验 将200 ml含细胞的培养基(1×104个)接种到每个Transwell的上部隔室中,并在37℃下孵育24 h,使细胞通过多孔膜迁移。孵育24 h后,残留在腔室上表面的细胞被完全去除,而膜的下表面用4%多聚甲醛固定20 min,然后在0.5%(w/v)结晶紫溶液中染色5 min,洗涤后,使用Image-Pro Plus 6.0软件测定不同组别中的细胞数。侵袭实验前预先用40 ml Matrigel基质胶在4℃条件下过夜融化,并与3倍体积的无血清培养基混合均匀后加入24孔Transwell小室(每孔50 μl),其余实验步骤及方法同迁移实验。实验重复3次。

2 结果
2.1 CASC2的表达与神经胶质瘤患者病理分期相关以及淋巴结转移呈负相关 我们收集整理18例神经胶质瘤患者相关临床资料进行对比分析,见表1。结果发现CASC2的表达与年龄、性别(P>0.05)。CASC2的表达与神经胶质瘤的病理分期相关以及与淋巴结转移呈负相关,神经胶质瘤病理分期越高,CASC2在神经胶质瘤组织中表达水平越低(P<0.05),并且在发生转移的患者中CASC2的表达水平明显降低(P<0.05)。
2.2 CASC2在胶质瘤组织及A127、U251、U87、HA细胞系中表达降低 实验结果发现,神经胶质瘤中CASC2的表达较外伤及癫痫组织降低(P<0.05,图1A)。CASC2在A127、U251、U87细胞系中表达降低,并且在U87细胞系中降低最为显著(P<0.05,图1B)。因此选取U87进行后续实验研究。
2.3 CASC2可靶向下调U87细胞系中miR-634的表达 实验结果发现,神经胶质瘤组织中的miR-634的表达含量较对照组织降低(P<0.05,图2A)。miR-634在A127、U251、U87细胞系中表达同样降低(P<0.05,图2B)。双荧光素酶报告基因结果显示,与对照组相比,CASC2 mimics与miR-634 3′UTR Wt共转染的HEK293细胞中miR-634的表达活性明显降低(P<0.05,图2D)。
表1 CASC2表达与神经胶质瘤患者临床病理特征的关系
Tab.1 Correlation between expression of CASC2 and clinicopathological features of Glioma

Clinicopathological datanCASC2 relative expressionP valueAge(year)0.642≤40100.62±0.18>4080.59±0.14Gender0.315Male90.60±0.17Female90.68±0.16Pathological stage0.001Ⅰ-Ⅱ61.28±0.25Ⅲ-Ⅳ120.32±0.11Lymphatic metastasis0.002-130.80±0.15+50.22±0.10

图1 CASC2在神经胶质瘤组织中及A127、U251、U87细胞系中的表达水平Fig.1 Expression level of CASC2 in glioma tissues and A127,U251,U87 cell linesNote: *.P<0.05 vs HA group.

图2 CASC2与miR-634在U87细胞系中的调控关系Fig.2 Regulation of CASC2 and miR-634 in U87 cell lineNote: *.P<0.05 vs HA group;#.P<0.05 vs CASC2-NC mimics group.

图3 过表达CASC2可抑制U87细胞系增殖、迁移和侵袭的影响Fig.3 Overexpression of CASC2 can inhibit the prolifera-tion,migration and invasion of U87 cell lineNote: *.P<0.05 vs CASC2-NC mimics.
2.4 过表达CASC2可抑制U87细胞系增殖、迁移和侵袭 CCK-8实验结果表明过表达CASC2后,在24、48、72 h时间点,U87细胞增殖数量较对照组明显减少[(0.20±0.06)vs(0.26±0.08)、(0.31±0.10)vs(0.47±0.19)、(0.53±0.21)vs(0.82±0.28),(P<0.05,图3A)];过表达CASC2表达后,Transwell实验表明U87细胞迁移及侵袭数量明显低于对照组[(228.79±29.65)vs(358.13±47.02)、(158.77±22.51)vs(262.33±31.40),P<0.05,图3B]。
2.5 过表达miR-634可促进U87细胞系增殖、迁移和侵袭的影响 CCK-8实验结果表明过表达miR-634后,在24、48、72 h时间点,U87细胞增殖数量较对照组明显增加[(0.23±0.05)vs(0.18±0.03)、(0.43±0.08)vs(0.32±0.06)、(0.75±0.08)vs(0.44±0.09),(P<0.05,图4A)],Transwell实验表明U87细胞迁移及侵袭数目明显多于对照组[(258.47±30.69)vs(162.13±21.58)、(222.82±27.10)vs(164.25±23.79),P<0.05,图4B]。
2.6 过表达miR-634负向调控EGFR、PI3K、p-AKT蛋白的表达 实验结果表明过表达miR-634后,与对照组相比,EGFR、PI3K、p-AKT蛋白表达均不同程度降低,与miR-634的表达呈明显负相关(P<0.05,图5)。
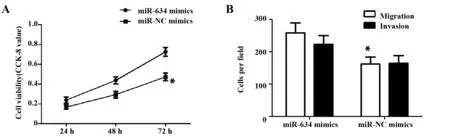
图4 过表达miR-634可促进U87细胞系增殖、迁移和侵袭Fig.4 Overexpression of miR-634 can enhance the proliferation,migration and invasion of U87 cell line

图5 过表达miR-634对EGFR、PI3K和p-AKT蛋白表达影响Fig.5 Effect of miR-634 overexpression on EGFR,PI3K and p-AKT protein expression
3 讨论
由于肿瘤呈浸润性生长,因而神经胶质瘤复发率高,预后极差[7],目前放疗及化疗等辅助治疗手段对神经胶质瘤的治疗起到一定的作用,但是效果并不显著,5年生存率尚不足5%,平均生存期仅14个月[8],因此迫切需要寻找治疗神经胶质瘤的新方法。研究发现除蛋白质编码基因发生突变或异常表达外,非编码RNA,尤其是LncRNA的突变和调节在癌症中起主要作用[9]。正常情况下LncRNA可能表现出肿瘤抑制和促癌功能,其表达异常可直接影响肿瘤细胞的恶性生物学行为,并且LncRNA与肿瘤细胞耐药性、肿瘤诊断及预后具有显著相关性[10]。Nie等[11]研究表明LncRNA-UCA1可以通过作用于下游微小RNA(miR-193a-3p),上调ERBB4蛋白的表达,影响非小细胞肺癌的增殖和转移,沉默LncRNA-UCA1表达后,非小细胞肺癌的增殖和转移能力明显增加,同时多种LncRNAs包括CRNDE、MEG3和HOTAIR,已经被鉴定为神经胶质瘤发生发展中的新调节剂,可作为潜在的治疗靶标[12]。因此LncRNA在肿瘤发病机制中的作用是确切的,但其是否具有特异性及敏感性,与在体神经胶质瘤的诊断及预后关系仍不能明了。
CASC2 最初在子宫内膜癌患者中被发现为潜在的肿瘤抑制因子,已被证明具有调节胃癌细胞增殖的能力并与胃癌患者的预后相关[13]。 Gan等[14]对80例原发性肝癌患者的组织进行分析发现,62%的患者组织中CASC2出现了明显下降,并通过过表达CASC2,发现原发性肝癌细胞在小鼠体内成瘤能力明显增加,因此CASC2可能是恶性肿瘤发生发展的共同关键因子,然而,CASC2在神经胶质瘤中的作用仍不清楚。因此本研究通过实时定量PCR检测,发现CASC2在神经胶质瘤组织及细胞中表达明显降低,进一步增强CASC2的表达后,细胞的增殖、侵袭和转移受到明显抑制,这与CASC2在乳腺癌、结肠癌和胃癌中的表达趋势一致。同时我们收集整理18例神经胶质瘤患者相关临床资料进行对比分析,结果发现神经胶质瘤病理分期越低,CASC2在神经胶质瘤组织中表达水平越高,并且在发生转移的患者中CASC2的表达水平明显降低,可见CASC2在神经胶质瘤的发生发展过程中扮演者抑癌基因的角色,可作为治疗时增强疗效的潜在靶标。
miRNA是由长度为20~22个核苷酸组成的短链非编码RNA,miRNA通过转录后水平与3′-UTR结合来调节靶基因的表达[15,16]。越来越多的研究表明,miRNA在肿瘤的发生发展过程中扮演着重要角色,通过与靶基因的3′-UTR结合,形成RNA诱导或沉默复合体,在转录或翻译水平对靶基因表达进行上调或下调,从而对肿瘤细胞生物学行为产生影响[17]。例如miR-634可增强神经胶质瘤CNE-1/Taxol细胞对化疗药物的敏感性,加速神经胶质瘤细胞DNA的损伤[18]。miR-634通过下调mTOR基因的表达,促进宫颈癌细胞凋亡,抑制其恶性生物学行为,并且与宫颈癌的分级分期存在密切的关系[19]。然而神经胶质瘤中CASC2是否与miR-634有相互作用尚不清楚。因此我们进一步对CASC2与miR-634的相互作用机制进一步探究,我们发现miR-634的表达水平在神经胶质瘤组织及细胞中明显降低,进一步增强miR-634的表达后,细胞的增殖、侵袭、转移明显增强,这也验证miR-634在神经胶质瘤进展过程中起着促癌基因的作用,同时我们使用TargetScan、Starbase数据库预测CASC2的靶基因,发现CASC2与miR-634具有互补结合序列,推测miR-634为CASC2的下游靶基因,荧光光素酶基因报告显示CASC2 mimics与野生型载体miR-634 3′UTR Wt共转染后,miR-634的荧光素酶活性显著降低,表明miR-634是CASC2的靶基因,靶向调控miR-634表达水平,可抑制神经胶质瘤胞的增殖、侵袭及转移。EGF于1962年在新生鼠中被首次发现[20]。约20年后EGFR被分离纯化[21]。EGFR主要是通过二聚化后刺激Ras蛋白,导致磷酸化级联反应而激活PI3K/Akt信号通路,从而引起肿瘤的发生、发展[22]。研究表明EGFR和PI3K的表达水平随神经胶质瘤级别上升而增高,EGFR的表达与PI3K的表达呈正相关,可以表明EGFR过表达可能通过激活PI3K信号通路在胶质瘤的发生发展中起作用[23]。并且本实验结果表明促进miR-634表达后,EGFR、PI3K、P-AKT蛋白表达均不同程度降低,与miR-634的表达呈明显负相关,这也表明CASC2可通过下调miR-634的表达抑制神经胶质瘤细胞的增殖、侵袭、转移,其有效作用机制可能是通过抑制EGFR/PI3K/AKT通路实现。但遗憾的是本研究并没有直径证据证明CASC2是调控EGFR/PI3K/AKT直接证据,也未进行相关临床研究,后续还将进一步探讨。
综上所述,本研究证明CASC2可靶向调控miR-634基因的表达,通过EGFR/PI3K/AKT通路,从而抑制神经胶质瘤细胞的增殖、侵袭及转移,可为神经胶质瘤的靶向治疗及临床药物的研制提供新的思路。
